TasA抑菌蛋白对烟草黑胫病的防治效果研究
2023-12-27胡丽榕王亚明黄子豪彭帅英
胡丽榕,王亚明,王 倩,宋 惠,黄子豪,黄 林,2,钟 敏,2,彭帅英,2*
TasA抑菌蛋白对烟草黑胫病的防治效果研究
胡丽榕1,王亚明1,王 倩1,宋 惠1,黄子豪1,黄 林1,2,钟 敏1,2,彭帅英1,2*
(1. 江西农业大学 生物科学与工程学院,江西 南昌 330045;2. 江西农业大学 应用微生物研究所,江西 南昌 330045)
【目的】烟草黑胫病是烟草疫霉菌侵染形成的一种严重危害烟草根茎的土传性疾病,给全球烟草种植业造成严重的经济损失。研究通过构建TasA蛋白原核表达重组菌,研究TasA对烟草黑胫病的抑制效果;并通过改变TasA蛋白的异源表达水平,以期提高该蛋白对烟草黑胫病的抑制效果。【方法】通过PCR扩增技术获得枯草芽孢杆菌抑菌蛋白基因,构建大肠杆菌重组菌;并以烟草疫霉菌()为指示菌,研究TasA蛋白对烟草黑胫病的抑制效果。此外,通过改变克隆载体的拷贝数,研究TasA蛋白的表达量对其抑菌作用的影响。【结果】成功构建了三株大肠杆菌重组菌(pACYC-TasA、pCDF-TasA及pT7473-TasA菌株),且TasA蛋白在三株重组菌中都成功进行了异源表达,分子量为35 ku左右。pACYC-TasA菌株、pCDF-TasA菌株及pT7473-TasA菌株对烟草疫霉菌菌丝体均有抑制效果,抑制率分别为14.85%、25.55%及13.45%。【结论】抑菌蛋白TasA对烟草黑胫病具有显著抑制效果,且过表达pCDF-TasA重组质粒的工程菌对烟草黑胫病抑制效果最佳。
烟草黑胫病;烟草疫霉菌;TasA蛋白;PCR扩增;异源表达
【研究意义】烟草是世界上重要的经济作物,烟草黑胫病自1896年发现以来,其在全球范围内迅速蔓延,已成为烟草种植业最具破坏性的土源性病害之一[1]。我国烟草种植区特别是山东、安徽与河南种植区烟草黑胫病害频发,平均发病率为5%~12%,严重时高达75%,给我国烟草生产业造成严重的经济损失[2]。烟草黑胫病由烟草疫霉菌()引发,该病原菌侵染能力强,且在整个烟草生长期都可发生侵染。有报道指出每年由烟草黑胫病造成的经济损失高达数亿元[3],仅次于烟草病毒病,已成为制约烟草优质、高效、安全生产的重要因素[4]。烟草黑胫病的防治方法包括合理轮作、抗病品种培育、化学防治以及生物防治等。在诸多植物真菌病害防治方法中,生物防治具有高效且不污染环境、对作物安全、对人畜安全、对食品安全等优点,符合人们对食品安全的要求,而且为生态环境的可持续发展提供了技术支持。因此,关于植物病害的生物防治研究日益受到关注。【前人研究进展】芽孢杆菌是植物病害生物防治研究中的重要微生物,其种类多分布广、易分离纯化,是土壤和植物微生态的优势种群。大量研究发现一些芽孢杆菌可以产生多种抗菌物质,包括脂肽类、肽类、磷脂类、细菌素等物质[5]。芽孢杆菌的生防机制包括竞争作用、拮抗作用、诱导植物抗性等方面,尤以产生抗生素、抑菌蛋白和挥发性抗菌物质的拮抗作用为主要的防病机理[6-8]。目前应用于生物防治的芽孢杆菌主要有枯草芽孢杆菌()、苏云金芽孢杆菌()、解淀粉芽孢杆菌()、腊样芽孢杆菌()、巨大芽孢杆菌()及贝莱斯芽孢杆菌()等[5,9]。TasA是一类芽孢结合蛋白,与芽孢外壳和芽孢形成相关,在芽孢形成的早期一直到细胞进入静止期均有合成,并分泌到细胞培养基中[10]。研究表明TasA蛋白具有广谱抑菌活性,对多种植物病原菌有明显的抑制效果,是芽孢杆菌的主要抑菌活性成分[11]。近年来,国内关于芽孢杆菌基因克隆并在原核生物中表达的研究日益增多。杨丽荣等[12]以解淀粉芽孢杆菌YN-1菌株为研究对象,利用PCR方法从基因组DNA中扩增出编码抑制基因的全长DNA,并构建pGEX-4T2/TasA原核表达载体,在BL21(DE3)中表达获得TasA-GST融合表达的抑菌蛋白,且该表达产物能够抑制黄瓜灰霉病病原体的生长;刘通等[13]以短小芽孢杆菌DX01菌株为研究对象,采用PCR方法从DX01菌株基因组DNA中扩增出编码基因的全长序列,并构建原核表达载体pET28-TasA,在BL21(DE3)中表达获得TasA的融合表达蛋白,该融合蛋白对玉米小斑病菌及病菌分生孢子萌发有显著抑制作用,同时对水稻稻瘟病菌菌丝体生长有显著抑制作用;尹向田等[14]以枯草芽孢杆菌ME0717菌株为研究对象,采用PCR方法从该菌基因组DNA中扩增出完整的基因,将其构建到pEASY-E1载体上,并在BL21(DE3)中表达获得抑菌蛋白,该蛋白对桑树疫病菌具有抑制作用;来源于芽孢杆菌CQBS03和BH072的基因分别构建到pEASY-E1和pET28a载体上,并在BL21(DE3)中表达,表达产物能够抑制柑桔溃疡病菌及灰霉病菌生长[15-16];来源于解淀粉芽孢杆菌TF28抗菌蛋白基因用pET22b表达载体,并在BL21(DE3)中表达,并在低温下培养表达,其表达产物能抑制番茄灰霉病和叶霉病、玉米茎基腐病和水稻稻曲病菌生长[17]。【本研究切入点】枯草芽孢杆菌TasA蛋白是一种具有广谱抑菌活性的生物大分子。近年来,关于TasA蛋白抑制植物病原真菌的报道逐年增加。然而,TasA蛋白对烟草疫霉菌的抑制作用尚未见报道。【拟解决的关键问题】通过构建TasA蛋白原核表达重组菌,并以烟草疫霉菌为指示菌,探究TasA蛋白对烟草疫霉菌的抑制效果;此外,通过改变TasA蛋白在大肠杆菌宿主中的表达量,以期进一步提高TasA蛋白的抑菌效果。
1 材料与方法
1.1 供试材料
枯草芽孢杆菌、烟草疫霉菌、大肠杆菌均保藏于课题组实验室,大肠杆菌DH5α用于DNA分子克隆,BL21(DE3)用于蛋白质表达,分子操作相关试剂均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 重组DNA分子构建 根据NCBI数据库中枯草芽孢杆菌的基因序列设计PCR扩增引物,引物序列如下:TasA-F引物5′- GGAGCTTGGTATGAAAAAG-3′(I),TasA-R引物5′-CGGTTTTATTAATTTTTAT CCT-3′(I),下划线分别为限制性核酸内切酶I与I的识别序列;以枯草芽孢杆菌基因组DNA为模板进行PCR反应,扩增基因,PCR反应条件为:95 ℃预变性3 min后进行30个PCR循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸10 min;对目的片段及克隆质粒(pACYCDuet-1、pCDFDuet-1及pT7473)分别进行I与I的双酶切反应;回收酶切的目的片段及载体分子,利用T4 DNA连接酶进行酶连反应,构建三个重组DNA分子即pACYC-TasA、pCDF-TasA及pT7473-TasA分子;将重组DNA分子导入大肠杆菌DH5α感受态细胞中,筛选阳性克隆子并送至北京擎科生物有限公司进行测序;保存经测序验证正确的菌株,并抽提其质粒转化至大肠杆菌BL21(DE3)感受态细胞中,保存菌株。
1.2.2 重组菌株的培养 将-80 ℃保存的菌株接种至3 mL新鲜LB液体培养基中(含有相应抗性),于37 ℃下200 r/min培养过夜;隔天按1%的接种量转接至50 mL新鲜LB液体培养基中(含有相应抗性),于37 ℃、200 r/min培养至OD600值至0.6~0.8;加入终浓度为1 mmol/L的IPTG进行诱导;4 h后将菌液于8 000 r/min下离心20 min,弃上清液收集菌体。
1.2.3 细胞破碎 将菌体使用细胞破碎缓冲液A(50 mmol/L Tris∙HCl缓冲液pH 8.0;100 mmol/L NaCl;10 mmol/L EDTA)重悬至菌浓度为20 mg/mL。破碎过程(所有操作都在冰浴条件下进行)如下:功率200 W,On 2 s,Off 4 s,Cycle 90次,取样作为全菌样本;随后于10 000 r/min下4 ℃离心30 min,收集上清液,作为上清样本;将沉淀使用破碎缓冲液B(50 mmol/L Tris∙HCl缓冲液pH 8.0;100 mmol/L NaCl)洗涤2次,重悬混匀,取样作为沉淀样本。
1.2.4 SDS-PAGE电泳分析 蛋白质样品采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析。蛋白质样品加入2×SDS蛋白样品缓冲液,在100 ℃下变性5 min。在垂直平板凝胶装置中采用4%(w/v)浓缩胶和10%(w/v)分离凝胶进行PAGE电泳。随后,用0.05%(m/v)考马斯亮蓝R-250溶液对凝胶染色4 h;使用脱色液(V(乙酸)﹕V(甲醇)﹕V(水)=1﹕3﹕6)对凝胶进行脱色。
1.2.5 菌丝抑制率测定 制备PDA固体培养基平板,待培养基凝固后分别取200 μL重组菌株的全菌、上清液、沉淀样品均匀涂布至PDA平板上;用无菌打孔器打取5 mm烟草黑胫病的菌饼接至PDA平板中央,用封口膜封口;放至28 ℃恒温培养箱中培养72 h,以单独接种烟草黑胫病菌饼的平板为对照(对照组培养72 h后菌丝长满平板);每个处理设置3个平行,病原菌菌丝抑制率计算公式如下:
菌丝抑制率=(对照菌丝直径-处理菌丝直径)/对照菌丝直径×100% (1)
2 结果与分析
2.1 三株TasA重组菌株的分子构建
将枯草芽孢杆菌抑菌蛋白基因分别克隆至3种质粒载体中,即pACYCDuet-1(4 008 bp)、pCDFDuet-1(3 781 bp)及pT7473(5 443 bp),构建pACYC-TasA、pCDF-TasA及pT7473-TasA重组质粒,3个重组质粒的分子图谱见图1。
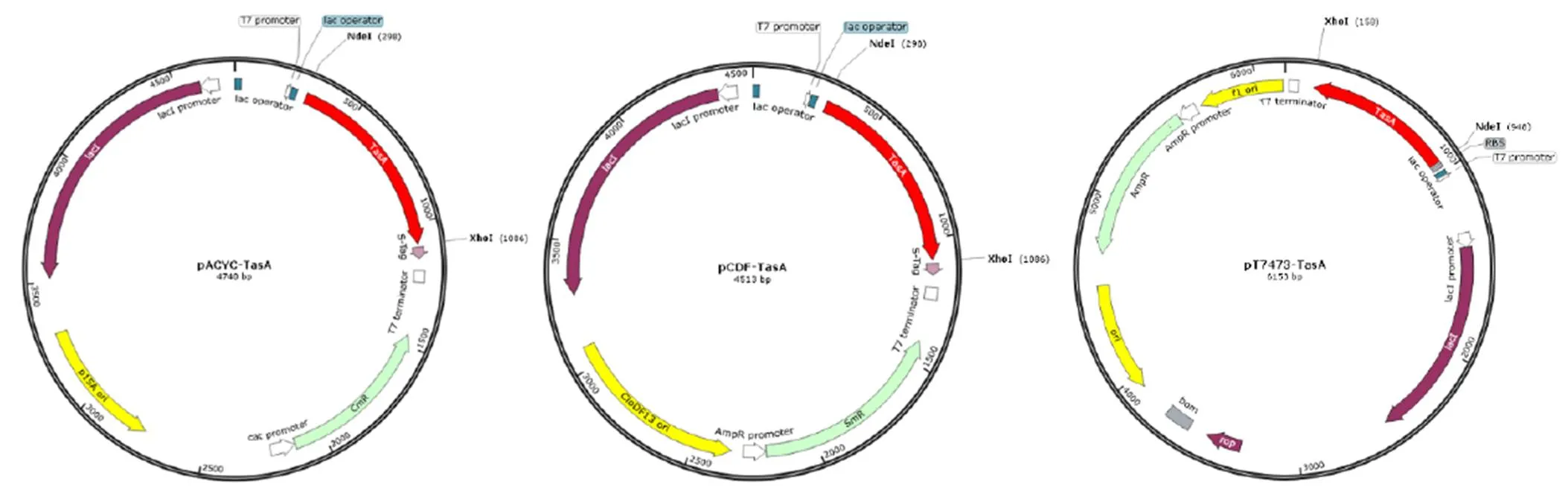
图1 3个重组DNA质粒的分子图谱
以枯草芽孢杆菌基因组DNA为模板,以设计的TasA-F/TasA-R序列为引物进行PCR扩增,其扩增产物经0.75%(m/v)琼脂糖凝胶电泳分析,基因的分子量大小为750 bp左右,与预期的分子量大小(786 bp)一致(图2a)。将PCR产物克隆至3种质粒分子中,并转化至大肠杆菌DH5α感受态细胞中,进行菌落PCR验证(图2b),挑选阳性克隆进行I/I双酶切验证。从图2c可以看出,pACYC-TasA重组DNA分子经双酶切电泳后发现2个DNA条带(4 000 bp与750 bp),其条带分别与载体及基因的大小一致(图2c,1泳道);pCDF-TasA与pT7473-TasA重组DNA分子经双酶切后均发现载体分子与目的基因条带(图2c,2与3泳道),这些结果表明基因已成功克隆至3个载体分子中。随后将经测序验证正确的重组载体导入大肠杆菌BL21(DE3)感受态细胞中,分别构建包含pACYC-TasA、pCDF-TasA及pT7473-TasA重组质粒的大肠杆菌重组菌,并命名为pACYC-TasA、pCDF-TasA及pT7473-TasA菌株。

a)TasA基因PCR产物电泳图。b)菌落PCR鉴定结果,1,2:pACYC-TasA;3,4:pCDF-TasA;5,6:pT7473-TasA。 c)双酶切鉴定结果,1:pACYC-TasA,2:pCDF-TasA,3:pT7473-TasA,M:DNA marker。
2.2 不同质粒拷贝数对TasA基因表达量
将3株重组菌株于37 ℃培养并经1 mmol/L IPTG诱导4 h后,检测各重组菌株中TasA蛋白的异源表达情况。SDS-PAGE电泳结果表明,在35 ku左右观察到一条蛋白质过表达条带,其与TasA蛋白预期的分子量大小一致(图3),说明TasA蛋白在3株重组菌中都成功进行了表达;此外,从3株重组菌的上清液(S泳道)与沉淀(P泳道)样本的电泳结果可以看出,TasA在3株重组菌株中主要以可溶性形式表达,且pCDF-TasA菌株中TasA蛋白的可溶性表达水平较其它两株重组菌株高。
2.3 不同质粒拷贝数对TasA抑菌活性的影响
以烟草疫霉菌为病原指示菌,分别对3株重组菌株的全菌、上清液和沉淀样品进行抑菌活性测定。结果表明,与空的BL21(DE3)宿主菌相比,3株重组菌的全菌和上清样品均能在不同程度上抑制烟草疫霉菌菌丝体的生长(图4)。pACYC-TasA、pCDF-TasA及pT7473-TasA菌株全菌样品对烟草疫霉菌菌丝体的抑制率分别为14.85%、25.55%、13.45%,与空的BL21(DE3)宿主菌对照相比,菌丝抑制率分别为对照菌的2.59、4.45、2.34倍。pACYC-TasA、pCDF-TasA及pT7473-TasA菌株上清样品对烟草疫霉菌菌丝体的抑制率分别为11.66%、22.81%、10.10%。上述结果表明,pCDF-TasA菌株的全菌及上清样品对烟草疫霉菌的抑制效果最好,这一结果与TasA蛋白的表达量结果一致即TasA蛋白在pCDF-TasA菌株中的表达量最高。
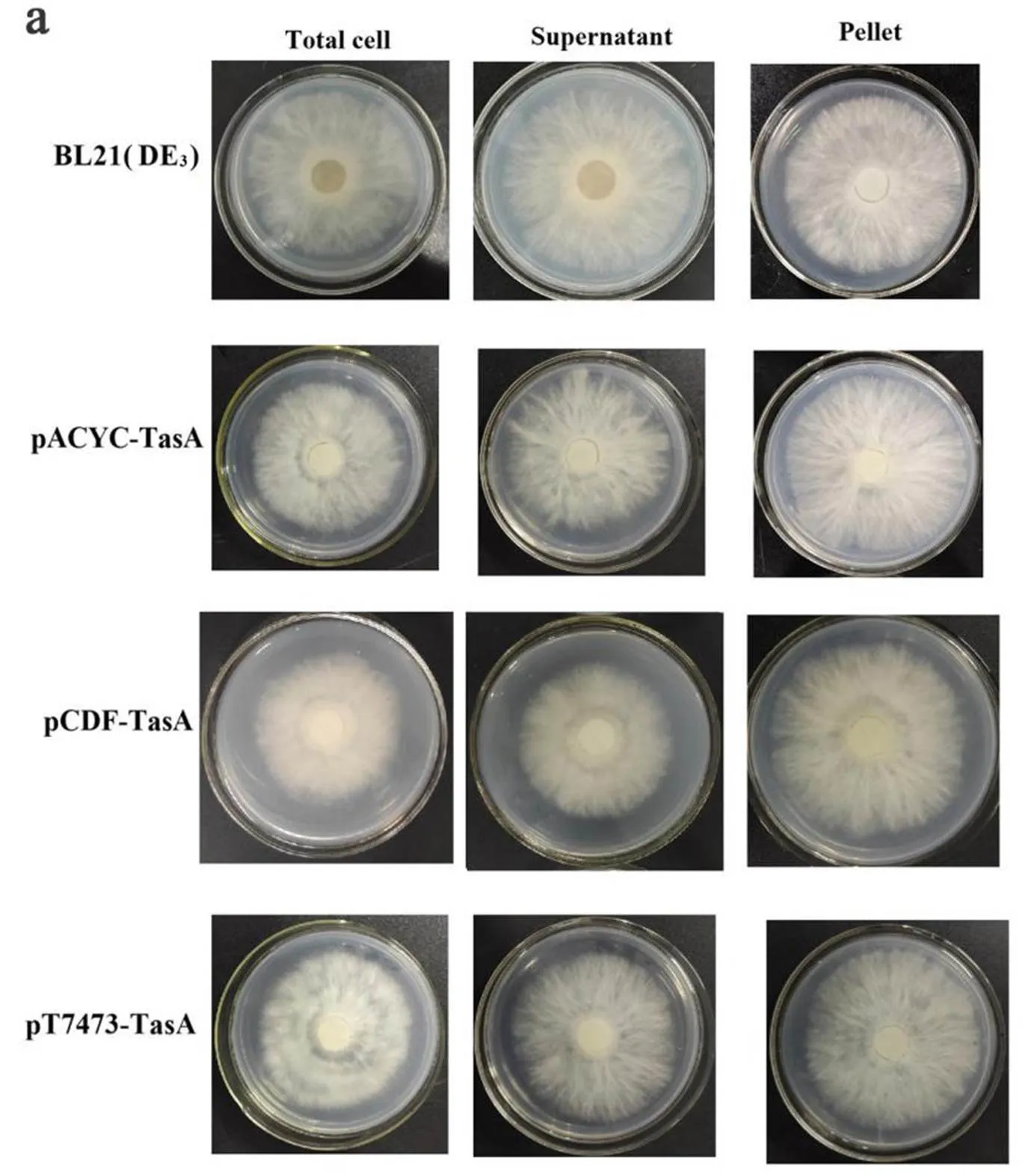
3 讨 论
烟草黑胫病是由烟草疫霉菌引发的土传性病害,通常感染烟草植物的根和茎,每年给全球烟草种植业造成巨大的经济损失。目前防治烟草黑胫病的诸多方法中,生物防治方法因其绿色、环保、可持续等优势,在植物病害防治上展现出巨大应用潜力。当前对烟草黑胫病的生物防治研究主要集中在拮抗微生物的分离筛选方面,且已有诸多拮抗微生物被成功分离筛选出来。例如贾孟媛等[18]从毒鹅膏菌栖息土壤中分离筛选到一株具有显著烟草疫霉菌抑制效果的拮抗细菌亚麻假单胞菌DE4-5;Ding等[19]从贵州烟草黑胫病高发区土壤中筛选到一株对烟草黑胫病有显著抑制效果的拮抗菌——贝莱斯芽孢杆菌GUMT319。枯草芽孢杆菌抑菌蛋白TasA被认为是一种具有广谱抑菌活性的抑菌蛋白,其对诸多植物病原菌都表现出显著的抑菌活性[12-17]。关于TasA对烟草黑胫病的抑制活性尚未见报道。在本研究中,枯草芽孢杆菌TasA蛋白基因在大肠杆菌中成功实现了异源表达。此外,TasA蛋白能有效抑制烟草疫霉菌菌丝体生长,体现出良好的烟草黑胫病防治效果。表达载体是影响基因异源表达的一个重要因素,基因表达量和表达产物活性与表达载体的拷贝数、类型密切相关[20-21]。本研究通过将TasA抑菌蛋白基因克隆至3种不同拷贝数的质粒载体(3种载体拷贝数关系:pACYCDuet-1<pCDFDuet-1<pT7473)中,考察了TasA蛋白表达量对其抑菌活性的影响,提高TasA蛋白的表达量能进一步提高其对烟草疫霉菌的抑制效果。本研究中的TasA抑菌蛋白来源于枯草芽孢杆菌,对其氨基酸序列分析后发现,该蛋白包含信号肽序列,表明TasA蛋白是一种分泌表达型蛋白。在后续研究中,课题组计划以枯草芽孢杆菌为异源表达宿主,实现TasA蛋白基因的高效分泌表达,以进一步提高TasA抑菌活性。综上,本研究拓宽了枯草芽孢杆菌抑菌蛋白TasA的抑菌谱,同时也可为TasA蛋白防治烟草黑胫病提供理论参考。
[1] MA L, ZHANG H Y, ZHOU X K, et al. Biological control tobacco bacterial wilt and black shank and root colonization by bio-organic fertilizer containing bacteriumNXHG29[J]. Applied soil ecology, 2018: S0929139317306820.
[2] 彭海莹. 烟草黑胫病和根黑腐病的生物防治技术研究[D]. 泰安: 山东农业大学, 2020.
[3] 赵亚南, 黄大野, 杨丹, 等. 烟草黑胫病研究进展[J].湖北农业科学, 2022, 61(S1): 25-28+66.
[4] 郭璇, 闫杏杏, 蒋彩虹, 等. 雪茄烟Beinhart1000-1对黑胫病0号生理小种的抗性遗传分析[J]. 中国烟草科学, 2017, 38(2): 56-62.
[5] POULAKI E G, TJAMOS S E.species: factories of plant protective volatile organic compounds[J]. J appl microbiol, 2023, 134(3): lxad037.
[6] ZHANG D, YU S Q, ZHAO D M, et al. Inhibitory effects of nonvolatiles lipopeptides and volatiles ketones metabolites secreted byC16 against[J]. Biol control, 2021, 152: 104421.
[7] CHOUB V, WON S J, AJUNA H B, et al. Antifungal activity of volatile organic compounds fromCE 100 against[J]. Horticulturae, 2022, 8:557.
[8] ZHANG L, WANG Y, LEI S, et al. Effect of volatile compounds produced by the cotton endophytic bacterial strainsp. T6 against Verticillium wilt[J]. BMC microbiol., 2023, 23:8.
[9] GRAHOVAC J, PAJČIN I, VLAJKOV V.VOCs in the context of biological control[J]. Antibiotics (Basel), 2023, 12(3): 581.
[10] STÖVER A G, DRIKS A. Regulation of synthesis of thetransition-phase, spore-associated antibacterial protein TasA[J]. J bacteriol, 1999, 181(17): 5476-5481.
[11] STÖVER A G, DRIKS A. Secretion, localization, and antibacterial activity of TasA, aspore-associated protein[J]. J bacteriol, 1999, 181(5): 1664-1672.
[12] 杨丽荣, 王正军, 薛保国, 等. 解淀粉芽孢杆菌YN-1抑菌蛋白TasA基因的克隆及原核表达[J]. 基因组学与应用生物学, 2010, 29(5): 823-828.
[13] 刘通, 陈云鹏, 李琼洁, 等.短小芽胞杆菌抑菌蛋白TasA基因克隆及功能分析[J]. 上海交通大学学报, 2014, 32(5): 49-56.
[14] 尹向田, 范素素, 徐亮, 等. 桑树内生枯草芽孢杆菌TasA基因的克隆及序列分析与表达产物的抑菌作用[J]. 蚕业科学, 2010, 36(2): 319-322.
[15] 龙贤梨, 王中康, 陈玉龙, 等. 芽胞杆菌CQBS03抑菌蛋白TasA基因的克隆及原核表达[J]. 植物保护学报, 2012, 39(5): 438-442.
[16] HAN Y, FAN J, ZHOU Z J, et al. Cloning and efficient expression ofsp. BH072 TasA gene in[J]. Transactions of Tianjin university, 2015, 21(1): 26-31.
[17] 张淑梅, 姜威, 孟利强, 等. 解淀粉芽孢杆菌TF28抗菌蛋白基因TasA克隆与表达[J].生物技术, 2016, 26(2): 130-135.
[18] 贾孟媛, 王越洋, 唐培培, 等. 烟草黑胫病生防菌的筛选鉴定及其防效[J]. 湖南农业大学学报(自然科学版), 2023, 49(3): 329-334.
[19] DING H, MO W, YU S, et al. Whole Genome sequence ofstrain GUMT319: a potential biocontrol agent against tobacco black shank disease[J]. Front microbiol, 2021, 12: 658113.
[20] GULYÁS D, KOCSIS B, SZABÓ D. Plasmid copy number andgene expression in selection of fluoroquinolone-resistant[J]. Acta microbiol immunol hung, 2019, 66(2): 169-178.
[21] LIU L, OTOUPAL P, PAN A, et al. Increasing expression level and copy number of aplasmid through regulated centromere function[J]. FEMS yeast res, 2014, 14(7): 1124-1127.
Biocontrol Effects of Antifungal Protein TasA on Tobacco Black Shank
HU Lirong1, WANG Yaming1, WANG Qian1, SONG Hui1, HUANG Zihao1, HUANG Lin1,2, ZHONG Min1,2, PENG Shuaiying1,2*
(1. School of Biological Sciences and Engineering, Jiangxi Agricultural University, Nanchang 330045, China; 2. Institute of Applied Microbiology, Jiangxi Agricultural University, Nanchang 330045, China)
Tobacco black shank is a soil-borne disease caused by fugal pathogens of, typically infecting the roots and stems of tobacco plants and causing serious economic losses to the global tobacco industries. Therefore, recombinant strains overexpressing TasA were constructed to reveal the inhibitory effect of TasA on tobacco black shank. Moreover, the heterologous expression level of TasA was altered to improve its inhibitory effects.The TasA gene ofwas PCR amplified and overexpressed inBL21(DE3) strain. The inhibitory effect of TasA protein on tobacco black shank was studied by usingas a pathogen indicator. In addition, the inhibitory effect of TasA under different expression levels was also studied by cloning TasA gene into three vectors with different copy numbers.Three recombinantstrains (pACYC-TasA, pCDF-TasA, and pT7473-TasA strain) were successfully constructed. SDS-PAGE results revealed that TasA protein was overexpressed in all recombinant strains and its molecular weight was around 35 ku. The mycelial inhibition rate ofin pACYC-TasA, pCDF-TasA, and pT7473-TasA strain was 14.85%, 25.55%, and 13.45%, respectively.TasA protein shows a significant inhibitory effect on tobacco black shank, and recombinant strains overexpressing recombinant plasmid of pCDF-TasA exhibit the best inhibitory effect on tobacco black shank.
tobacco black shank;; TasA protein; PCR amplification; heterologous expression
10.3969/j.issn.2095-3704.2023.04.64
S435.72
A
2095-3704(2023)04-0425-07
2023-09-21
2023-10-11
江西省教育厅科技计划项目(GJJ180238)
胡丽蓉(2002—),女,主要从事微生物资源开发与利用研究,1511631708@qq.com;*通信作者:彭帅英,讲师,博士,sypeng@jxau.edu.cn。
胡丽榕, 王亚明, 王倩, 等. TasA抑菌蛋白对烟草黑胫病的防治效果研究[J]. 生物灾害科学, 2023, 46(4): 425-431.
