尾巨桉EugNAC007基因的克隆与功能分析
2023-12-27何沙娥欧阳林男杨嘉麒郑嘉琪陈少雄
何沙娥,欧阳林男,杨嘉麒,郑嘉琪,陈少雄
尾巨桉基因的克隆与功能分析
何沙娥,欧阳林男,杨嘉麒,郑嘉琪,陈少雄*
(中国林业科学研究院速生树木研究所,广东 湛江 524022)
为挖掘桉树木材形成重要NAC转录因子,以尾巨桉DH32-29的转录组测序数据为基础,克隆了一个桉树NAC基因,并对其功能进行了初步研究。序列分析表明:编码序列全长1 711 bp,预测编码蛋白含569个氨基酸,分子量为64.32 KD,定位于细胞核。EugNAC007蛋白在N端具有一个典型的NAC结构域。系统进化分析表明EugNAC007蛋白与拟南芥中调控细胞分裂的AtNTM1亲缘关系较近。实时荧光定量PCR结果显示在木质部中优势表达。在杨树中过表达该基因抑制了植株株高生长。推测可能通过调控细胞分裂的形式参与木材形成过程,但具体作用途径和机制待进步一研究。该研究为深入挖掘桉树木材形成相关重要NAC转录因子提供参考。
桉树;NAC转录因子;基因克隆;基因功能
木材(次生木质部)是十分重要的可再生资源。转录因子在木材形成过程中发挥重要调控作用,鉴定和揭示木材形成相关关键转录因子具有重要意义。NAC转录因子是植物特有的一类转录因子,其命名取自矮牵牛()转录因子NAM(NO APICAL MERISTEM)和拟南芥()转录因子ATAF1(ARABIDOPSIS TRANSCRIPTION ACTIVATOR FACTOR 1)、ATAF2以及CUC2(CUP-SHAPED COTYLEDON 2)的首写字母,其N-末端含有一个高度保守的NAC结构域,约150 ~ 160个氨基酸残基,C-末端含有高度多样性的转录激活功能域[1-2]。NAC转录因子在调控植物生长发育以及植物次生生长等过程中发挥着重要的生物学功能。
迄今已经克隆了多个木材形成相关的NAC转录因子基因,它们广泛参与了形成层细胞分裂、木质部细胞分化及次生壁合成等木材形成相关事件的发生。YANG等[3]发现,拟南芥NAC转录因子XVP(PRECOCIOUS XYLEM DIFFERENTIATION AND ALTERED VASCULAR PATTERNING)控制木质部细胞分化和形成层细胞分裂的平衡。由韧皮部产生的短肽分子TDIF(TRACHEARY ELEMENT DIFFERENTIATION INHIBITORY FACTOR)转移到形成层区域后与受体PXY(PHLOEM INTERCALATED WITH XYLEM)结合,上调下游转录因子()基因的表达水平,促进形成层细胞分裂[4],而XVP能与TDIF共受体BAK1(BRASSINOSTEROID INSENSITIVE1- ASSOCIATED KINASE1)结合,抑制TDIF-PXY信号输出,使基因表达水平降低,减少形成层细胞分裂,同时上调次生壁合成NAC转录因子()的表达水平,促进木质部形成[3]。
目前认为木质部细胞次生壁合成调控网络在维管植物中相对保守[5]。在这个调控网络中,次生壁合成NAC(Secondary wall-associated NAC, SWN)转录因子是整个调控网络的顶层开关元件。以CHEN等[6]报道的毛果杨()细胞壁合成转录调控网络为例,包含了4个层级,由18个转录因子和27个细胞壁成分合成基因组成,木质部发育相关NAC转录因子(Wood-associated NAC transcription factor, WND)()位于调控网络最上层,是该调控网络的主控开关,、、和位于第三层级,其中可直接调控下游的木质素单体合成基因。其他树种中木质部发育相关NAC转录因子如桉树(spp.)中的云杉()中的-也已被鉴定[5,7]。虽然多数报道显示木质部形成转录调控在不同物种中表现保守,但仍存在差别。如巨桉()在木材形成过程中作为正调控因子参与木质素的合成,而其在拟南芥中的同源基因则是负调控叶片衰老,且并未参与木质部发育调控[8]。
桉树生长迅速,是纸浆、造纸、胶合板、生物质能源及其他木质纤维素原材料的主要来源,为我国木材资源供给做出了重要贡献[9]。HUSSEY等[10]对巨桉()基因组分析获得了189个Cs,组织表达分析表明、、、和可能参与了木质化过程,但是这些成员并非已报道的拟南芥木质化过程相关基因(如、、、及)的同源基因,说明桉树可能存在一些与拟南芥中功能不同的木材形成相关NAC转录因子成员。为获得更多重要的桉树木材形成相关NAC转录因子基因,本课题组通过对不同种植密度下尾巨桉(×)的转录组数据分析,发现一个NAC转录因子基因的表达水平在主茎生长量显著增加的木质部中明显升高。本研究克隆了该基因,并通过生物信息学分析、组织表达及转基因开展基因功能研究,以期为深入挖掘桉树木材形成相关重要NAC转录因子提供参考。
1 材料与方法
1.1 试验样品
本试验所用植物材料为盆栽3月龄尾巨桉DH32-29无性系苗,平均直径6.84 mm(于主茎基部10 cm处测量),平均株高65.72 mm。分别取顶端、第一节间至第七节间的木质部,迅速置于液氮冻存。每个样本由5个植株混样组成。使用EASYspin/EASYspin Plus植物RNA提取试剂盒提取RNA(北京爱博森生物科技有限公司);采用反转录试剂盒TRUEscript RT MasterMix(北京爱博森生物科技有限公司)进行反转录获得cDNA,进行后续试验。
1.2 基因克隆与载体构建
根据三代测序数据获得的转录本序列,设计基因特异引物(表1),利用Q5高保真DNA聚合酶(New England Biolabs,M0491)从尾巨桉DH32-29无性系木质部cDNA中扩增目标基因序列。PCR扩增反应体系的总体积为50 μL,其中灭菌水18.5 μL,5 × Q5反应缓冲液10 μL,5 × Q5 High GC Enhancer 10 μL,Q5 超保真DNA聚合酶0.5 μL,正、反向引物各2.5 μL(10 mM),dNTPs(10 mM)1 μL,cDNA模板5 μL。PCR扩增反应程序为98 ℃预变性30 s,98 ℃变性10 s,65 ℃复性15 s,72 ℃延伸2 min,30个循环,72 ℃延伸10 min。
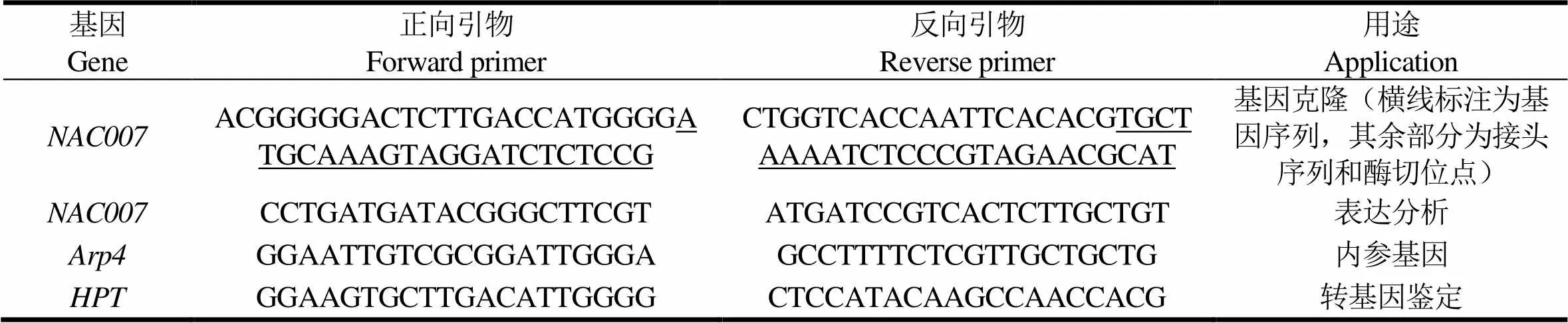
表1 引物信息表
PCR产物经1%琼脂糖凝胶电泳后纯化回收(天根DNA纯化胶回收试剂盒DP214)。使用Hieff Clone Plus One Step Cloning Kit(上海翊圣生物科技有限公司)通过无缝克隆的方法将纯化后的PCR产物克隆进由Nco1和Pml1消化的pCAMBIA1305.1载体中,得到35S∶∶Gene的表达载体。阳性细菌克隆提取质粒进行测序确认。
1.3 基因序列分析
使用Ex-pasy protparam(https://web.expasy.org/ protparam/)在线分析编码蛋白的氨基酸数目、理化性质。通过NCBI CDD分析蛋白保守结构域(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb. cgi)。通过Cell-PLoc网站(http://www.csbio.sjtu.edu.cn/ bioinf/plant-multi/)分析蛋白亚细胞定位。从https://www.arabidopsis.org/下载拟南芥基因和蛋白序列,从http://www.phytozome.net/poplar release 3.1下载毛果杨基因和蛋白序列。利用MEGA 6.06软件的Clustal W工具对3个物种的蛋白序列进行比对分析,选择邻近结合法(Neighbor-joining method)构建系统进化树,校验参数Bootstrap为1 000。
1.4 组织表达分析
以克隆的基因序列为模板设计基因特异引物,以不同节间的木质部cDNA为模板,通过基因特异性引物和内参基因()(表1)进行实时荧光定量PCR,检测目标基因在木材形成组织中的表达情况。荧光定量检测所用试剂盒为2 × SybrGreen qPCR Mix荧光定量试剂盒(爱博森生物公司)。反应体系和运行程序按照试剂盒说明书操作。每个组织样品设置3个生物学重复和3次技术重复。用2-△△Ct法计算基因的相对表达量。
1.5 84k杨遗传转化与分析
质粒经测序确认后进行84k杨树的遗传转化,转化流程主要参照AN等[11]和ZHOU等[12]的方法,使用潮霉素(Hygromycin)按正常流程筛选。转化基本过程如下:从茎尖往下取4周无菌苗的第3 ~ 5片叶作为农杆菌侵染的外植体,用解剖刀沿中脉切3 ~ 4个伤口,预培养2 d。侵染前1 d,准备农杆菌,培养过夜。在侵染当天,当农杆菌菌液的OD600达到0.5左右时,侵染叶外植体,之后在黑暗中共培养3 d。将外植体移至芽再生培养基上进行筛选和芽再生后直接移至生根培养基获得转基因苗。分别提取转基因苗和野生型负对照植株的基因组DNA,利用载体的潮霉素抗性基因引物(表1)扩增鉴定阳性转基因苗。将转基因苗和野生型负对照植株移栽至花盆中进行培养,统一水肥管理,观察植株生长情况。
2 结果与分析
2.1 EugNAC007基因克隆与序列分析
对尾巨桉DH32-29三代转录组测序分析,发现一个NAC转录因子基因MIX-PB_transcript_70069(长度 1 974 bp)的表达量在主茎生长量显著增大的木质部样本中显著升高[12]。根据其序列设计引物,以尾巨桉DH32-29主茎木质部cDNA为模板,扩增目的基因编码区,获得长度约2 000 bp的单一条带(图1A)。经克隆测序,获得长度为1 711 bp的编码序列。序列分析预测其编码一个含569个氨基酸残基的蛋白,在N-末端第29位氨基酸至156位氨基酸含有一个保守的NAC结构域,包含5个亚结构域(图1B);蛋白预测相对分子量为64.32 KD,等电点pI为5.09,属酸性蛋白;亚细胞定位分析显示该蛋白定位于细胞核。

A:从尾巨桉DH32-29主茎木质部中扩增的EugNAC007琼脂糖电泳检测;M,全式金Trans2K Plus DNA Marker(条带自上到下:5 Kb,3 Kb,2 Kb,1 Kb,750 bp,500 bp,250 bp,100 bp);B:EugNAC007编码的氨基酸序列;下划线部分表示NAC结构域,粗体字部分代表5个亚结构域。A, Agarose gel electrophoresis of EugNAC007 gene amplified from stem xylem of E. urophylla × E. grandis DH32-29; M, Trans2K Plus DNA Marker (the fragments size from top to bottom are 5 Kb, 3 Kb, 2 Kb, 1 Kb, 750 bp, 500 bp, 250 bp, 100 bp); B: Amino acid sequence of EugNAC007; Underline indicates the NAC domain, bold indicates the five subdomains.
HUSSEY等[10]系统分析了巨桉NAC转录因子家族,获得了189个巨桉NAC成员,并将之与拟南芥中105个NAC成员、杨树中163个NAC成员等做了进化分析。为明确本研究所获得的尾巨桉NAC转录因子基因与巨桉、拟南芥、杨树NAC成员之间的关系,课题组前期将MIX-PB_transcript_70069蛋白序列与上述3个物种的NAC成员构建了系统进化树,发现MIX-PB_transcript_70069与拟南芥ANAC003(XVP,AT1G02220.1)、ANAC005(AT1G02250.1)、ANAC068(AtNTM1,AT4G01540.1)等成员在同一个分枝[13],这些成员已被证实参与形成层细胞分裂或木质部发育调控[3, 14-15]。本研究选取该分枝部分成员进一步简化了系统关系树(图2),结果显示:MIX-PB_transcript_70069与巨桉EgrNAC007(Eucgr.G01047)的亲缘关系最近,与拟南芥AtNTM1以及杨树3个NAC转录因子的关系较近。其中,拟南芥AtNTM1的功能已知,为调控细胞分裂[14]。本研究将获得的命名为。
2.2 EugNAC007基因组织表达分析
转录组数据显示,在主茎生长量大的植株木质部中,的表达量也显著上调。为了进一步明确在不同发育程度木质部中的表达变化,本研究以叶片为参照,通过实时荧光定量方法对该基因在不同茎节中的表达水平进行分析。结果显示该基因在不同发育程度木质部中的表达水平显著高于叶片。比较不同茎节中的基因表达量,发现该基因在第三节间中的表达水平最高,其次是第七节间,但是各节间的表达水平差异不显著。

图2 尾巨桉EugNAC007(MIX-PB_transcript_70069)与其他物种NAC转录因子的系统进化关系
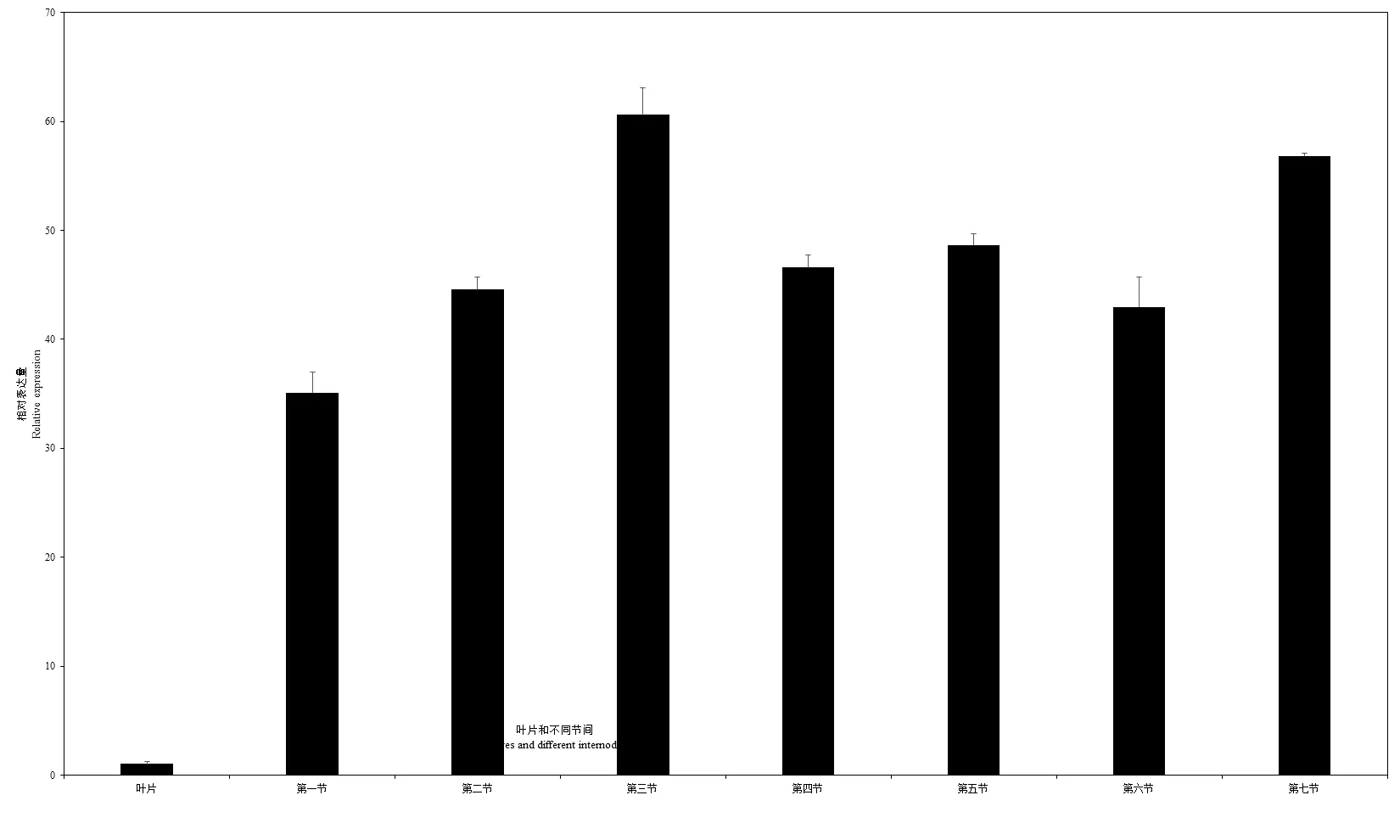
图3 尾巨桉EugNAC007在不同节间木质部和叶片中的表达水平
2.3 转基因植株鉴定与分析
为了证明基因参与木材形成过程的调控,本研究构建了过量表达载体并遗传转化84K杨,利用载体的潮霉素抗性基因引物扩增鉴定阳性转基因植株。结果显示,在12个转基因株系中,11个株系扩增出目的片段,野生型植株(WT)无扩增带(图4)。对野生型和过表达植株进行盆栽培养,保持生长条件一致并观察生长情况,发现过表达植株的株高明显低于野生型的,表明过表达影响了植株正常生长(图5)。

M,全式金Trans2K Plus DNA Marker(条带自上到下:5 Kb,3 Kb,2 Kb,1 Kb,750 bp,500 bp,250 bp,100 bp);WT,野生型植株。M,Trans2K Plus DNA Marker (the fragments size from top to bottom are 5 Kb, 3 Kb, 2 Kb, 1 Kb, 750 bp, 500 bp, 250 bp, 100 bp); WT, wild type.

WT:野生型植株;OE:EugNAC007过表达植株。WT, wild type; OE, EugNAC007 overexpression plants.
3 讨论与结论
NAC转录因子是植物特有的一类转录因子大家族,广泛参与植物生长发育多方面的调控。木材形成是植株正常生长以及生物量积累的重要生物学过程,一些NAC转录因子在木材形成过程中发挥了重要的调控作用[16-19]。研究表明,拟南芥中含有105个NAC成员,杨树中含有163个NAC成员[10],它们中一些成员在形成层细胞分裂、木质部细胞分化、次生壁加厚等木材形成相关生物学过程中发挥了关键调控作用[16]。在拟南芥中,NAC转录因子SND1是次生壁合成的关键调控因子,双突变体植株不能直立生长;而在拟南芥中表达在杨树中的同源基因以及桉树中的同源均能够恢复互补双突变体纤维的垂茎表型(Pendent Stem),并且激活次生壁合成基因的表达[16]。巨桉中含有189个NAC成员,但它们在木材形成中的功能得到验证的极少。SUN等[8]发现在拟南芥中过表达巨桉基因后植株的木质素含量和木质部面积均增加,木质素合成基因的表达水平也升高,说明作为正调控因子参与了木材形成过程中木质素的合成,但在拟南芥中的同源基因为,其功能是负调控叶片衰老。由此可见,发挥了与其拟南芥同源基因不同的功能。为了获得更多的参与桉树木材形成的NAC转录因子,本研究从尾巨桉中克隆了一个NAC转录因子,其编码蛋白N端含有一个保守的NAC结构域,包含5个亚结构域。系统进化分析显示与EugNAC007亲缘关系较近的巨桉、杨树中的成员的功能尚不明确,但与之关系较近的拟南芥的功能已知,其功能为调控细胞分裂[14]。因此,本研究推测可能参与调控木材形成过程中细胞分裂过程,但需要进一步验证。
木本植物的生长包括初生生长(纵向生长)和次生生长(径向生长)两个部分。初生生长来源于顶端分生组织(Shoot Apical Meristem, SAM)和原形成层,促使根与枝条增长,次生生长则使植株周长增加,形成木材(次生木质部)。植株主茎从顶端到基部反应了植株由初生生长向次生生长的转变。为了验证该基因在木材形成中发挥功能,本研究检测了在主茎不同节间的木质部中的表达变化。以叶片为参照,该基因在不同发育程度木质部中的表达水平显著升高,表明该基因主要在木材形成组织中发挥功能。比较不同节间的基因表达水平,发现该基因在第三节间的表达水平最高,但是各节间的表达水平差异不显著。在第三节间表达水平最高的原因可能是由于该节间处于由初生生长向次生生长转变的过程,但需要进一步通过解剖结构观察验证。
为了明确基因表达对植株生长的影响,本研究构建了基因过表达的84K杨转基因遗传材料。发现过表达后转基因植株的生长受到影响,主要表现为植株株高显著低于野生型,这可能是由于过表达后扰乱了植株细胞的正常分裂,使植株生长受限。本研究暂未发现植株直径生长受到明显影响,这可能是由于观察时间较短,植株在次生生长上的差异尚不显著。综上所述,本研究获得了一个桉树转录因子基因,其表达水平对植株株高生长产生了一定影响,可能通过调控细胞分裂的形式参与木材形成过程,但具体作用途径和机制待进步一研究。
[1] Souer E, van H A, Kloos D, et al. Thegene of Petunia is required for pattern formation in embryos and flowers and is expressed at meristem and primordia boundaries[J]. Cell, 1996, 85(2): 159-170.
[2] Aida M, Ishida T, Fukaki H, et al. Genes involved in organ separation in: an analysis of themutant[J]. The Plant Cell, 1997, 9(6): 841-857.
[3] YANG J H, LEE K H, DU Q, et al. A membrane- associated NAC domain transcription factor XVP interacts with TDIF co-receptor and regulates vascular meristem activity[J]. New Phytologist, 2020, 226(1): 59-74.
[4] Etchells J P, Provost C M, Mishra L, et al.4 andact downstream of the PXY receptor kinase to regulate plant vascular proliferation independently of any role in vascular organisation[J]. Development, 2013, 140(10): 2224-2234.
[5] Zhong R, Lee C, Ye Z H.Evolutionary conservation of the transcriptional network regulating secondary cell wall biosynthesis[J]. Trends in Plant Science, 2010, 15(11): 625-632.
[6] Chen H, Wang J P, Liu H, et al. Hierarchical transcription factor and chromatin binding network for wood formation in[J]. The Plant Cell, 2019, 31(3): 602-626.
[7] Raherison E S M, Giguere I, Caron S, et al. Modular organization of the white spruce () transcriptome reveals functional organization and evolutionary signatures[J]. New Phytologist,2015, 207(1): 172-187.
[8] Sun Y, Jiang C, Jiang R, et al. A novel NAC transcription factor from,, positively regulates lignin biosynthesis and increases lignin deposition[J]. Frontiers in Plant Science,2021, 12: 642090.
[9] 陈勇平,吕建雄,陈志林.我国桉树人工林发展概况及其利用现状[J].中国人造板,2019,26(12):6-9.
[10] Hussey S G, Saidi M N, Hefer C A, et al. Structural, evolutionary and functional analysis of the NAC domain protein family in[J]. New Phytologist,2015, 206(4): 1337-1350.
[11] An Y, GENG Y, YAO J G, et al.Efficient genome editing inusing CRISPR/Cas12a[J]. Frontiers in Plant Science, 2020, 11:593938.
[12] Zhou Y, Zhang Y, Wang X, et al. Root-specific NF-Y family transcription factor,, positively regulates root growth and drought resistance by abscisic acid-mediated indoylacetic acid transport in[J].New Phytologist, 2020, 227(2):407-426.
[13] 陈沫.种植密度对尾巨桉幼苗光合特性和木质部生成相关基因表达的影响[D].北京:中国林业科学研究院,2021.
[14] KIM Y S, KIM S G, PARK J E, et al. A membrane-bound NAC transcription factor regulates cell division in[J]. The Plant Cell, 2006, 18(11): 3132-3144.
[15] ZHAO J, LIU J S, MENG F N, et al. ANAC005 is a membrane-associated transcription factor and regulates vascular development in[J]. Journal of Integrative Plant Biology, 2016, 58(5): 442-451.
[16] Zhong R, Lee C, Ye Z H. Functional characterization of poplar wood-associated NAC domain transcription factors[J]. Plant Physiology, 2010, 152(2): 1044-1055.
[17] Zhong R, YE Z H. The poplar PtrWNDs are transcriptional activators of secondary cell wall biosynthesis[J]. Plant Signaling & Behavior, 2010, 5(4): 469-472.
[18] ZHAO Y, SUN J, XU P, et al. Intron-mediated alternative splicing of WOOD-ASSOCIATED NAC TRANSCRIP- TION FACTOR1B regulates cell wall thickening during fiber development inspecies[J]. Plant Physiology, 2014, 164(2): 765-776.
[19] Akiyoshi N, Nakano Y, Sano R, et al. Involvement of VNS NAC-domain transcription factors in tracheid formation in[J].Tree Physiology, 2020, 40(6): 704-716.
Cloning and Preliminary Functional Analysis of theGene in×
HE Shae, OUYANG Linnan, YANG Jiaqi, ZHENG Jiaqi, CHEN Shaoxiong*
(Research Institute of Fast-growing Trees, Chinese Academy of Forestry, Zhanjiang 524022, Guangdong, China)
To identify key NAC transcription factors involved in wood formation, a NAC transcription factor geneof the clone DH32-29 of×was cloned based on RNA sequencing data and its function analyzed. The coding DNA sequence length of thegene was found to be 1 711 bp and encodes an acidic protein with 569 amino acid residuesofmolecular weight of 64.32 KD. The EugNAC007 protein contained a typical NAC domain at the N terminus and shared relatively high homology with theNAC with TRANSMEMBRANE MOTIF1 (AtNTM1) that regulates cell division. The results of RT-qPCR showed thatwas predominantly expressed in xylem tissues. Overexpression ofin poplar suppressed growth of tree height. These results indicated that themay participate in the processes of wood formation through the regulation of cell division, but the regulation mechanism is still unclear. This study advanced deep excavation of NAC transcription factors involved in wood formation processes in.
; NAC transcription factor; gene cloning; gene function
10.13987/j.cnki.askj.2023.04.001
Q785
A
广东省基础与应用基础研究基金联合基金(2020A1515110931);中国林业科学研究院基本科研业务费专项(CAFYBB2021MA010)
何沙娥(1983— ),女,博士,主要从事林木遗传改良研究。E-mail: cerchese@caf.ac.cn
陈少雄(1965— ),男,博士,研究员,主要从事人工林定向培育技术研究。E-mail: sxchen01@163.com
