多模式膝神经射频消融术对比膝关节注射治疗顽固性膝骨关节炎的临床疗效及安全性分析 *
2023-12-27刘德胜司马蕾樊碧发
苗 羽 林 鹋 朱 谦 刘德胜 毛 鹏 司马蕾 樊碧发△
(1 中日友好医院疼痛科,北京 100029; 2 福建省立医院疼痛科,福州 350000; 3 海南医学院第二附属医院麻醉科,海口 570216)
膝骨关节炎(knee osteoarthritis, KOA)是一种因关节软骨逐渐丧失引起的一种退行性关节疾病[1]。膝关节疼痛是KOA 的主要临床症状,可导致功能受限、疲劳、情绪低落和丧失独立生活的能力。中重度KOA 病人常伴有活动范围缩小的剧烈疼痛,并随着时间的推移而加重,最终导致残疾,KOA 是一种常见的致残性疾病。KOA 的患病率为4.2%~15.5%,并随年龄增长而逐渐增加。约80%的KOA 病人在65 岁及以上可以通过影像学确诊,60%的病人出现临床表现[2]。此外,由于人口老龄化和其他合并症,如肥胖(代谢综合征)、关节创伤和肌肉无力等,KOA 病人的数量可能会增加[3]。KOA 对病人的生存质量、身心健康均存在明显的影响,但由于KOA属于退行性疾病,不存在治愈性的治疗方法,目前主要是通过运动康复训练和疼痛控制来提高生活质量。治疗方法包括保守治疗和手术治疗。保守治疗方式包括药物治疗(外用药物、非甾体抗炎药、阿片类药物、抗抑郁药等)、非药物治疗(训练、运动、理疗、矫形术、针灸等),微创治疗包括关节内注射富血小板血浆 (platelet-rich plasma, PRP)、糖皮质激素、玻璃酸钠或羧甲基壳多糖(医用几丁糖)等[4~6]。虽然这些方法对缓解关节疼痛有一定的疗效,但通常伴有耐受性差或药物不良反应。由于存在严重的胃肠道和肾脏的药物不良反应,不建议长期使用非甾体抗炎药;而关节内玻璃酸钠或糖皮质激素注射存在关节软骨恶化、晶体诱导的滑膜炎、脂肪坏死、组织萎缩、血肿、血管坏死和脓毒症等并发症,因此也有争议[7]。当保守治疗无法达到这些目标时,建议行关节镜手术或全膝关节置换术(total knee arthroplasty, TKA)[8],TKA 是改善病人功能和缓解疼痛的最佳选择。但相关研究表明TKA 能有效地缓解了部分终末期膝关节炎病人的疼痛和功能丧失,但仍有14%~53%的病人在术后继续遭受疼痛,且7%~51%的病人报告术后膝关节功能不良[8,9]。同时,部分病人因存在严重心脑血管疾病、出凝血功能障碍等而无法进行TKA手术治疗[10]。
不论是手术治疗还是非手术治疗均存在局限性以及并发症。射频热凝术 (radiofrequency thermocoagulation, RFA)通过局部热作用损毁传递伤害性传入的膝神经,达到疼痛缓解[11],脉冲射频术(pulsed radiofrequency, PRF)通过间歇性电脉冲的电场效应达到调节神经、缓解疼痛的功效[12],而低温等离子射频消融术(low-temperature plasma radiofrequency ablation, LTPRA)是一种较新的治疗疼痛的技术,通过射频能量利用生理盐水介质产生相应的离子颗粒,打破组织中的分子键,导致组织在相对较低的温度下溶解或破坏[13]。RFA、PRF 以及LTPRA 这三种微创技术手段在疼痛科中广泛开展,应用于神经痛以及软组织相关疼痛的治疗,但三者的作用机制并不相同。目前虽然有RFA 用于KOA的治疗的相关研究,但尚无研究将射频联合LTPRA应用于顽固性KOA。因此,本研究通过回顾性分析中日友好医院疼痛科将多模式、多神经靶点治疗与常规的膝关节腔内注射医用几丁糖应用于顽固性KOA 的治疗,探讨其临床疗效和安全性,旨在探索一种准确、安全、有效的治疗顽固性膝关节疼痛的方法,为临床提供理论依据。
方 法
1.一般资料
本研究通过中日友好医院临床研究伦理委员会审核(伦理批号2021-154-K112)。选取2020 年2月至2021 年3 月在中日友好医院疼痛科接受治疗的顽固性KOA 病人66 例。
纳入标准:①年龄≥45 岁;②依据膝关节X片进行Kellgren-Lawrence分级(KL分级),处于3~4期,诊断为中、重度膝关节骨关节病;③术前对6个月的保守治疗(如理疗、镇痛药)无效的慢性顽固性膝关节疼痛;④术前至少3 个月存在中度或以上的顽固性膝关节疼痛,数字分级评分法(numerical rating scale, NRS)评分≥4 分,疼痛部位包括膝关节后侧、膝关节内侧、膝关节外侧以及髌周。
排除标准:①资料不全、失访;②急性疼痛;③疼痛范围超出KOA 的预期分布范围;④存在影响膝关节的其他疾病(如类风湿关节炎、骨髓炎、膝关节肿瘤、痛风、急性期关节内骨折或神经血管损伤等);⑤合并神经根性疼痛;⑥有临床意义的认知障碍、严重的神经系统或精神性疾病;⑦存在严重的内科疾病(如不能耐受微创手术的心肺功能不全);⑧既往接受过膝关节射频消融治疗;⑨有TKA 或部分膝关节置换术史。
2.分组
通过医院病例系统回顾性分析66 例病人的临床资料并纳入本研究中,依据治疗方法不同分为多模式、多神经靶点手术组和膝关节腔内注射组,手术组共纳入35 例病人,接受RFA(包括膝上外侧神经、膝上内侧神经、膝下内侧神经以及隐神经)、PRF(包括胫神经和腓总神经)以及LTPRA(髌周组织)的联合治疗;注射组共纳入31 例病人,接受规律性的膝关节腔内注射医用几丁糖治疗。手术组的手术均在中日友好医院疼痛手术室内完成;注射组的治疗在中日友好医院的疼痛门诊治疗室内完成。
3.手术组治疗方法
病人入手术室,仰卧于手术床上,输注等渗0.9%氯化钠注射液建立静脉通路。进行心电图、脉搏、血氧饱和度和无创动脉压监测。静脉推注2 mg 咪达唑仑使病人轻度镇静,不影响意识。通过鼻导管给氧2~3 L/min。患侧膝关节腘窝处垫枕,膝关节屈曲20°。使用碘酊1 遍、医用酒精2 遍先后消毒治疗区域并进行无菌单覆盖后,使用超声机 (CANON,Aplio i1800 TUS-AI1800, JAPAN)的高频线阵探头(i18LX5, 6~15 MHz, PLI-1205BX)识别靠近膝关节动脉分支的膝上内侧神经(superior medial genicular nerve, SMGN)、膝上外侧神经 (superior lateral genicular nerve, SLGN)和膝下内侧神经(inferior medial genicular nerve, IMGN)。SMGN 和SLGN 分 别 位 于 股 骨 的骨干与股骨内、外侧髁(medial and lateral femoral condyles, MFC 和LFC)的交界处,IMGN 位于胫骨的骨干与胫骨内侧髁(medial tibial condyle, MTC)的交界处。因此超声检查时,可先在矢状位上识别出MFC、MTC 和LFC,然后通过定位其相应的动脉分支来识别相应的膝神经(见图1)。
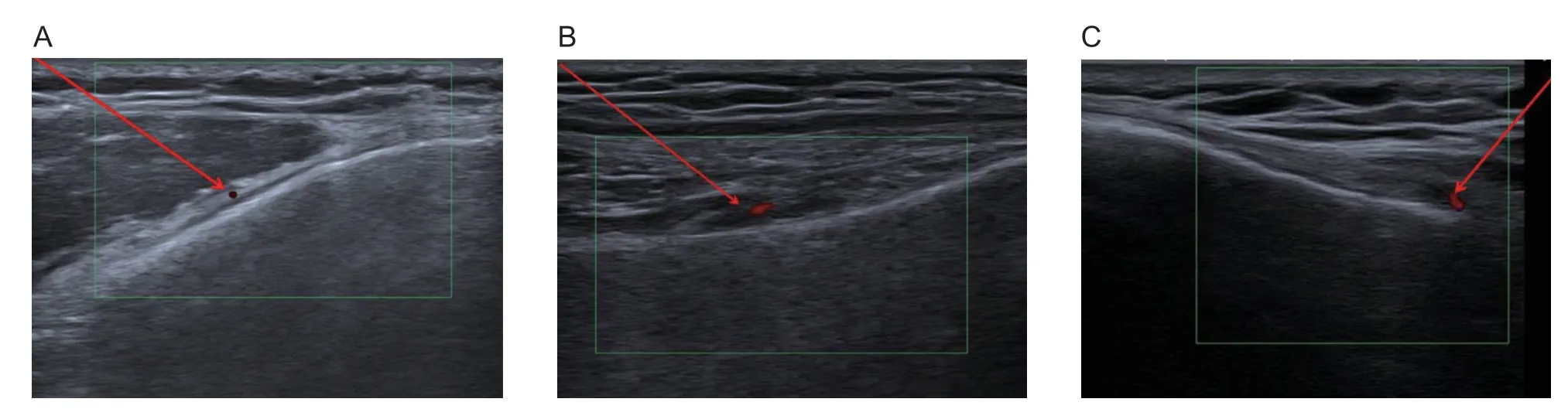
图1 (A)膝上内侧神经彩超下图示;(B)膝上外侧神经彩超下图示;(C)膝下内侧神经彩超下图示Fig.1 (A) Ultrasound imaging of superior medial genicular nerve; (B) Ultrasound imaging of superior lateral genicular nerve;(C) Ultrasound imaging of inferior medial genicular nerve
为了定位SMGN,探头首先在MFC 的矢状位上放置,找到股骨干和MFC 之间的过渡点,以该过渡点为中心,将探头放置在MFC 的水平位,使用彩色多普勒识别搏动的膝上内侧动脉,以此作为SMGN 靶点周围。用25G 针头注射1 ml 1%利多卡因行表面麻醉后,采用平面内进针法,将22G、10 cm、裸露端5 mm 的射频电极套管针(以下简称射频针,产品编号/型号240102,英诺德医疗科技有限公司)穿刺至SMGN。连接射频仪,以2 Hz、1.0~1.5 V 进行运动刺激,无诱发出肌肉抽搐;感觉刺激频率50 Hz,电压在0.5 V 以内诱发出关节相应部位疼痛或异感。刺激试验完成后开始RFA,参数:60℃ 60 s;70℃ 60 s;80℃ 120 s。分别对SLGN和IMGN 实施相同的操作。
为了识别隐神经,在大腿内侧中下1/3 区域,短轴切面上使用彩色多普勒识别搏动的股动脉(见图2)。同上进行局部麻醉后,采用平面内入路,插入射频针至缝匠肌深面的股动脉内侧的收肌管内,连接射频仪,同上完成感觉、运动刺激,刺激试验完成后,确认无肌肉抽搐,存在膝盖内侧、膝内下侧的异感,同上行RFA 治疗。
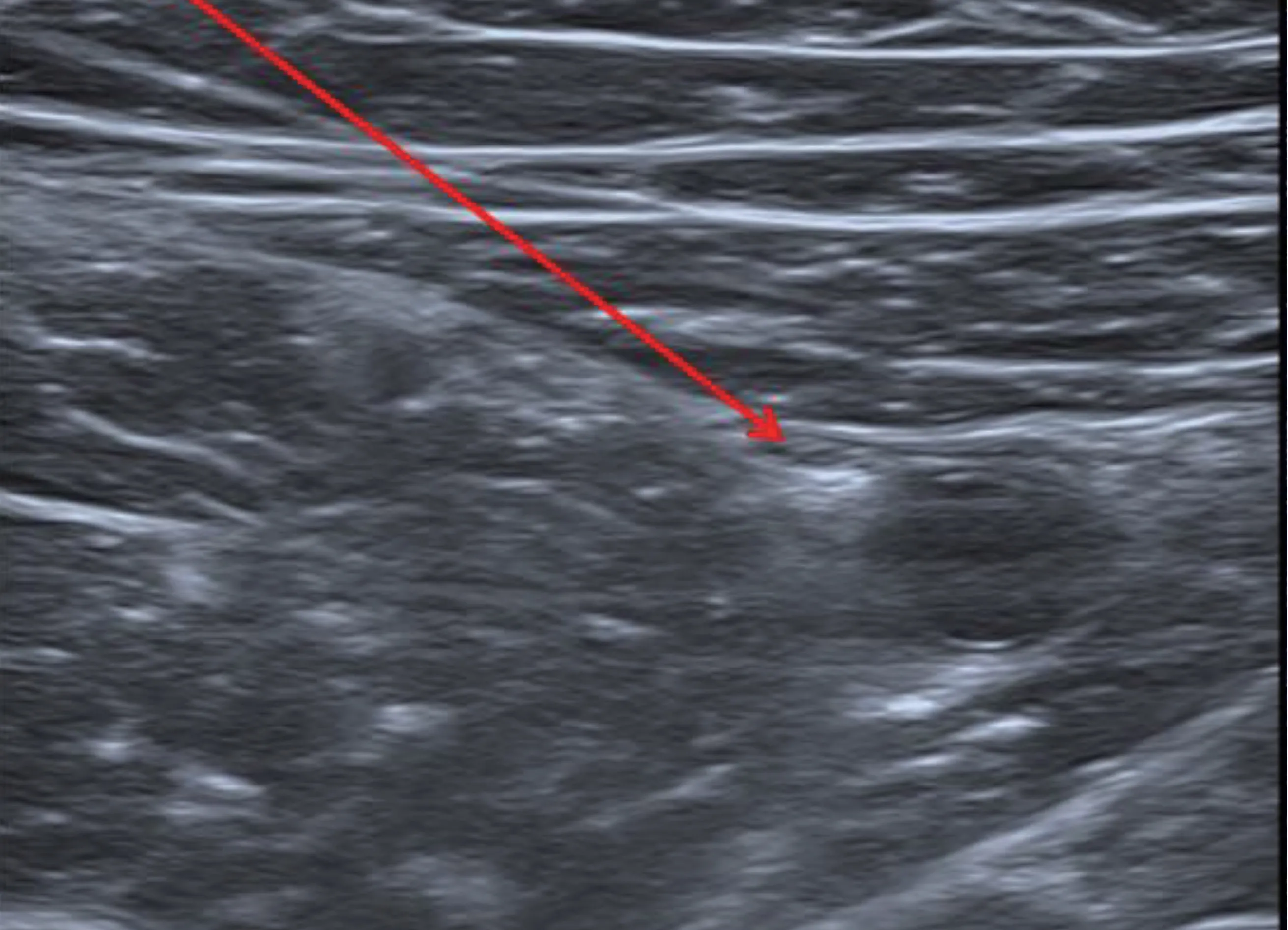
图2 隐神经彩超下图示Fig.2 Ultrasound imaging of saphenous nerve
(2)彩超引导下PRF:PRF 的靶点包括膝关节后方的胫神经(tibial nerve, TN)与腓骨头处的腓总神经(common peroneal nerve, CPN),均使用Cosman射频仪(以下简称射频仪,Cosman Medical, Inc.Burlington, USA)。
病人呈俯卧位,如上消毒、无菌单覆盖腘窝周围。在腘窝中央区域,将高频线阵探头放置在膝关节后方短轴切面上,彩色多普勒识别搏动的腘动脉,动脉的上方可见神经,采用平面内进针法,将射频针穿刺至TN(见图3)。连接射频仪,以2 Hz、0.6 V 进行运动刺激,诱发出腘窝、小腿后方的肌肉抽搐。运动刺激试验完成后开始PRF,参数:45℃ 100 V 600 s。
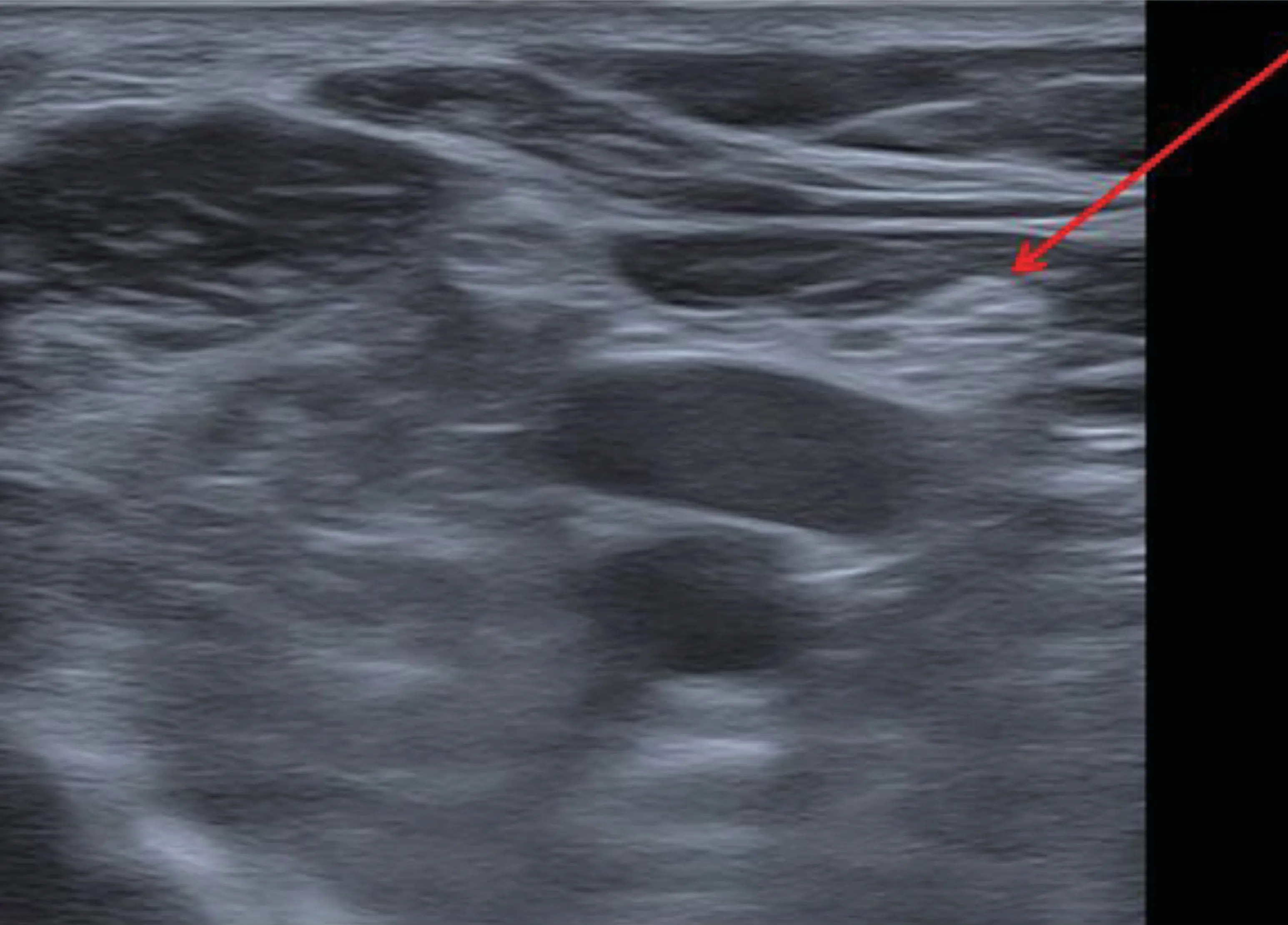
图3 胫神经彩超下图示Fig.3 Ultrasound imaging of tibial nerve
由上而下扫查整个腘窝直至腓骨小头,采用平面内进针法,将射频针穿刺至CPN(见图4),连接射频仪,以2 Hz、0.6 V 进行运动刺激,诱发出小腿前侧、外侧的肌肉抽搐。运动刺激试验完成后开始PRF,参数:45℃ 100 V 600 s。

图4 腓总神经彩超下图示Fig.4 Ultrasound imaging of common peroneal nerve
(3)彩超引导下LTPRA:将等离子刀头连接到低温等离子体多功能操作系统 (Arthroscopic Electrosurgery System 2000, USA )。触诊髌骨上缘、髌骨尖,分别以髌骨上缘与两个侧缘的交界处以及髌骨两侧的侧缘中点为靶点(见图5),针尖不接触髌骨软骨面,在彩超引导下,确认穿刺针穿刺至靶点后,经穿刺针置入低温等离子刀头,并连接等离子体多功能操作系统进行测试,采用1 档,超短时程测试满意后,诱发出髌骨周围、髌股面异感,局部注射1 ml 1%利多卡因,等待5 min 后开启低温等离子射频消融模式,参数:2~3 档(45 W)消融10 s×6 次,每次中间停顿30 s 后再次行低温等离子射频消融。
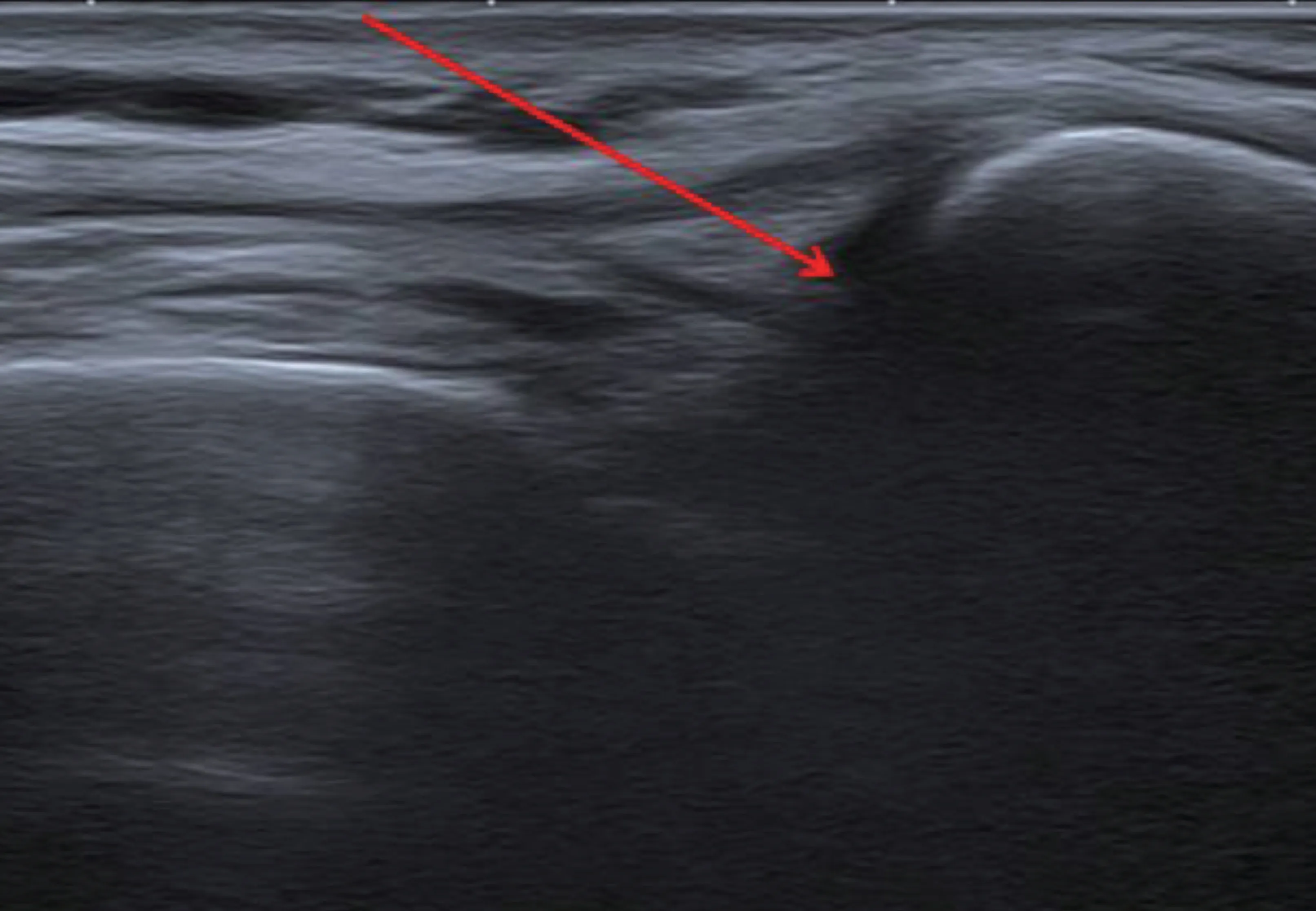
图5 髌周彩超下靶点图示Fig.5 Ultrasound imaging of patellar peripheral structures
4.注射组治疗方法
治疗前根据病人膝关节X 片确定病变最明显的位置:当膝关节内侧间隙病变明显时,则以内侧膝眼为穿刺点;若膝关节外侧间隙病变明显时,则以外侧膝眼为穿刺点。病人仰卧于操作台上,患侧膝关节呈屈曲位90°,确定髌骨外下缘、髌韧带外侧、胫骨平台外侧上方为外侧膝眼,确定髌骨内下缘、髌韧带内侧、胫骨平台内侧上方为内侧膝眼。依据术前穿刺点的选择,分别进行消毒后,取10 ml 注射器从内侧或外侧膝眼垂直皮肤进针,进针过程中,遇阻力则调整针道,出现落空感后,回抽无血,回抽有或无关节液,若存在关节液,则进行充分的关节液抽吸后,再进行药物注射,注射药物前必须确定注射器无明显阻力。注射液配方为:1%利多卡因5 ml 以及2 ml 医用几丁糖(上海其胜生物,20 mg/ml,2 ml/支)。每2 周1 次,3 次治疗为足疗程。
相应地,A′B′和C′D′的中点M′和N′的连线M′N′与Y轴的夹角γ成为等效偏转角,其中点E′成为掘进机的等效几何中心,其横坐标E′x成为等效横向偏移量,由纵坐标可计算机身等效前进距离E′y,高度方向的偏移量不受等效影响,因此不进行分析。四点法定位方法机理研究就是研究等效横向偏移量与实际横向偏移量之间的关系,等效(进尺方向)距离与实际距离之间的关系等。
5.数据收集和随访
数据通过医院电子病历系统收集病人基线资料,并通过电话随访、门诊随访收集病人结局资料。其中主要结局指标为NRS 评分,分别在术前、术后第2 周、1、3、6 和12 个月进行评估,0 为无痛,10 为剧烈疼痛。次要结局指标包括:①西安大略和麦克马斯特大学(the Western Ontario and McMaster Universities osteoarthritis index, WOMAC) 骨关节炎评分,分别在术前、术后第2 周、1、3、6 和12 个月评估病人的疼痛状态、僵硬程度、关节功能,分数越高表示KOA 越严重;②使用非甾体抗炎药和(或)阿片类药物的相关比例,术前、术后第2 周、1、3、6 和12 个月,占比 = 使用人数/总人数;③手术相关并发症包括术后是否出现穿刺点疼痛、疼痛加重、感觉减退、局部麻木、出血、感染等;④5级李克特量表评估病人对整体治疗的满意度,分别为非常满意、满意、不确定、不满意、非常不满意。
6.统计学分析
采用 SPSS 24.0 (IBM, Armonk, NY, USA)进行数据统计分析。对于连续资料,当满足正态分布时,采用均数±标准差表示,偏态分布数据用中位数(四分位间距)表示。分类资料采用计数和百分数来表示。采用Shapiro-Wilk 检验对变量进行正态性检验。针对成组设计的连续资料差异性分析,正态分布的数据采用独立样本t检验,偏态分布的数据采用Mann-Whitney U 检验,治疗前后比较采用重复测量方差分析或Friedman 检验。针对分类资料差异性分析采用卡方检验或Fisher 精确检验。双侧检验P< 0.05 认为差异有统计学意义。
结 果
1.两组病人的人口学和疾病特征
对两组病人的性别、年龄、体重指数(body mass index, BMI)等人口学特征、病程、术前NRS评分、WOMAC 评分、KL 分级、ID-pain 评分以及术前使用非甾体抗炎药等情况进行分析,两组比较差异无统计学意义(见表1)。
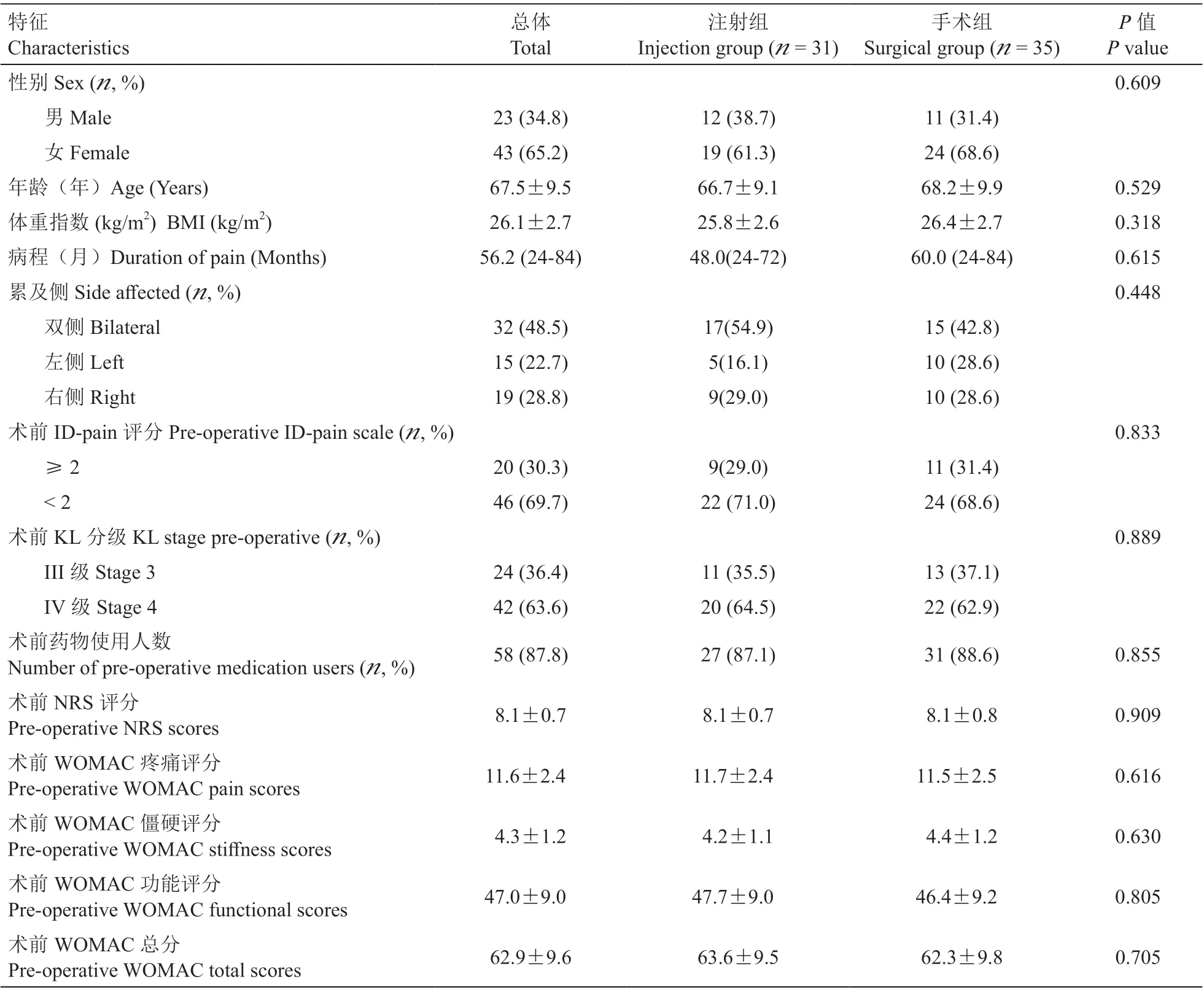
表1 治疗前基线特征Table 1 Baseline characteristics before treatment
2.临床结局
(1)NRS 评分:与术前相比,手术组术后2 周、1 个月、3 个月、6 个月、12 个月的NRS 评分均明显下降;与术前相比,注射组在术后2 周、1 个月、3 个月时NRS 评分下降,但在6 个月、12 个月时NRS 评分逐渐恢复至术前水平。手术组NRS 评分在各随访时间点的下降程度均明显高于注射组(P<0.05,见图6)。

图6 两组病人术后不同时间点NRS 评分变化*P < 0.05,与术前相比;#P < 0.05,与注射组相比Fig.6 Changes of NRS scores in two groups at different time after operation*P < 0.05, compared with pre-operation; #P < 0.05,compared with group injection.
(2)WOMAC 评分:与术前相比,手术组在术后2 周、1 个月、3 个月、6 个月、12 个月的WOMAC 疼痛评分均明显下降;与术前相比,注射组在术后2 周、1 个月、3 个月、6 个月时WOMAC疼痛评分下降,但在12 个月时与术前比较差异无统计学意义。手术组WOMAC 疼痛评分较注射组在术后2 周、1 个月、3 个月、6 个月、12 个月的随访时间点均明显下降(P< 0.05,见图7)。

图7 两组病人术后不同时间点WOMAC 疼痛评分变化*P < 0.05,与术前相比;#P < 0.05,与注射组相比Fig.7 Changes of WOMAC pain scores in two groups at different time after operation*P < 0.05, compared with pre-operation; #P < 0.05,compared with group injection.
WOMAC 僵硬评分:与术前相比,手术组术后2 周、1 个月、3 个月、6 个月、12 个月的WOMAC僵硬评分均明显下降;与术前相比,注射组在术后1 个月、3 个月时WOMAC 僵硬评分下降,但术后2 周、6 个月、12 个月时与术前比较差异无统计学意义。手术组WOMAC 僵硬评分较注射组在术后2周差异无统计学意义,但在术后1 个月、3 个月、6个月、12 个月的随访时间点均明显下降(P< 0.05,见图8)。
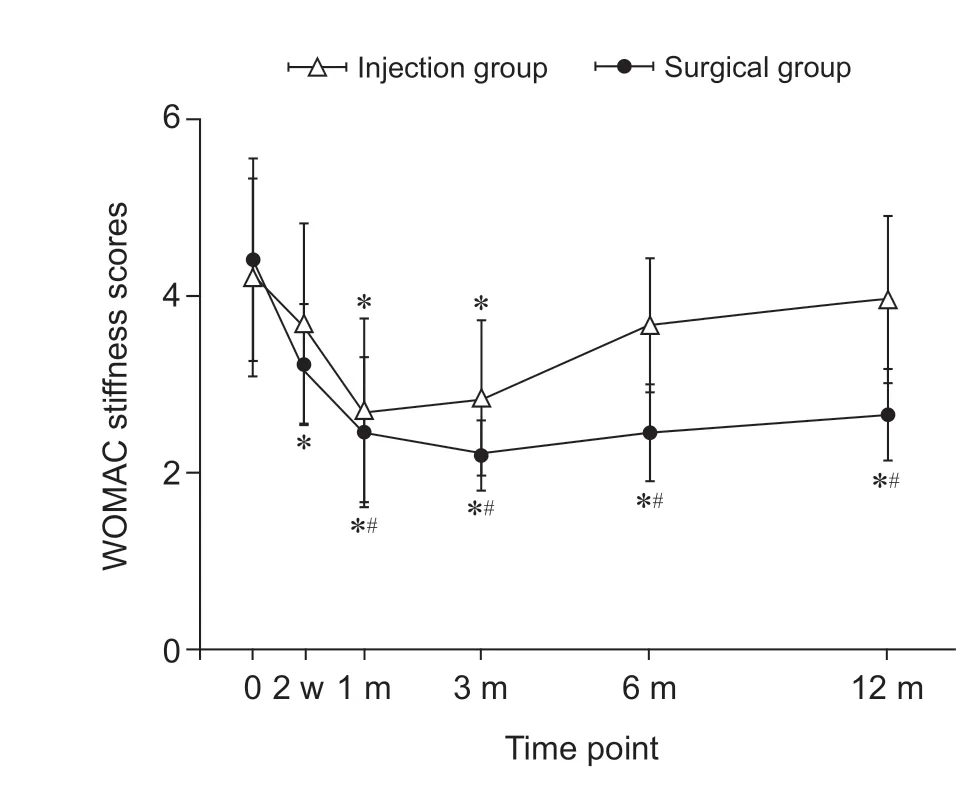
图8 两组病人术后不同时间点WOMAC 僵硬评分变化*P < 0.05,与术前相比;#P < 0.05,与注射组相比Fig.8 Changes of WOMAC stiffness scores in two groups at different time after operation*P < 0.05, compared with pre-operation; #P < 0.05,compared with group injection.
WOMAC 功能评分:与术前相比,两组在术后2 周、1 个月、3 个月、6 个月、12 个月的WOMAC功能评分均下降;但手术组WOMAC 功能评分较注射组在术后2 周、1 个月、3 个月、6 个月、12 个月的随访时间点均明显下降(P< 0.05,见图9)。
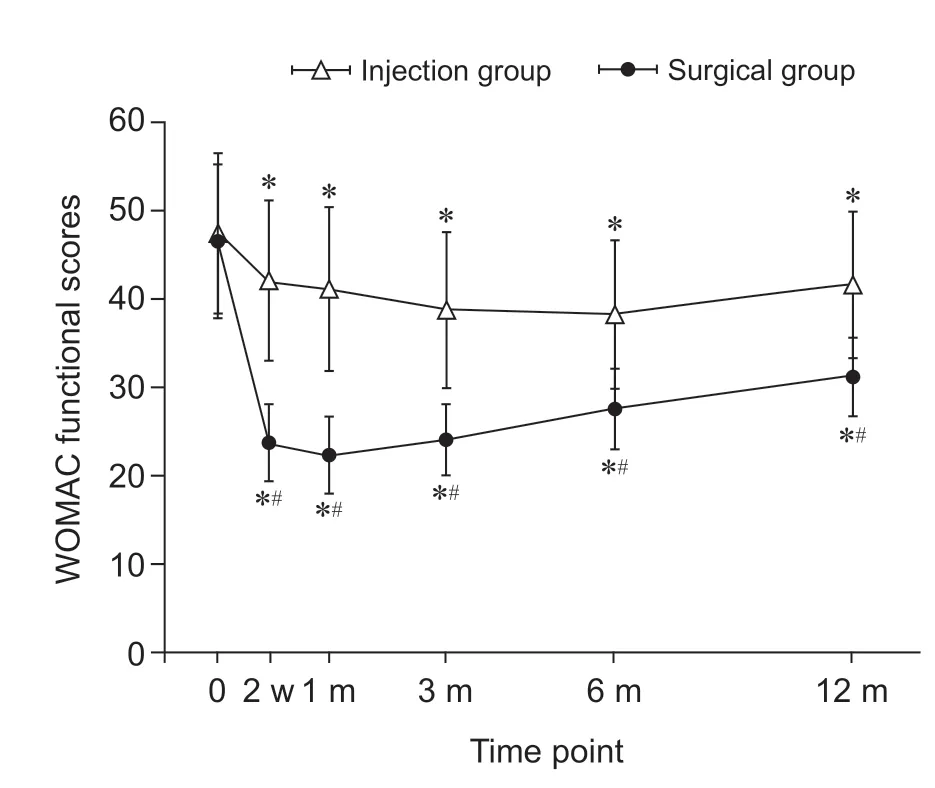
图9 两组病人术后不同时间点WOMAC 功能评分变化*P < 0.05,与术前相比;#P < 0.05,与注射组相比Fig.9 Changes of WOMAC functional scores in two groups at different time after operation*P < 0.05, compared with pre-operation; #P < 0.05,compared with group injection.
(3)WOMAC 总分:与术前相比,两组在术后2 周、1 个月、3 个月、6 个月、12 个月的WOMAC总分均下降;但手术组WOMAC 总分较注射组在术后2 周、1 个月、3 个月、6 个月、12 个月的随访时间点均明显下降(P< 0.05,见图10)。
图10 两组病人术后不同时间点WOMAC 总分变化*P < 0.05,与术前相比;#P < 0.05,与注射组相比Fig.10 Changes of WOMAC total scores in two groups at different time after operation*P < 0.05, compared with pre-operation; #P < 0.05,compared with group injection.
3.药物的使用率
与术前相比,手术组的术后药物使用率明显下降;注射组的药物使用率在术后也存在一定程度的下降,但只有在术后1 个月与术前相比差异有统计学意义,其余随访时间点变化差异无统计学意义。组间比较,手术组药物使用率较注射组在术后2 周、1 个月、3 个月、6 个月、12 个月的随访时间点均明显下降(P< 0.05,见图11)。
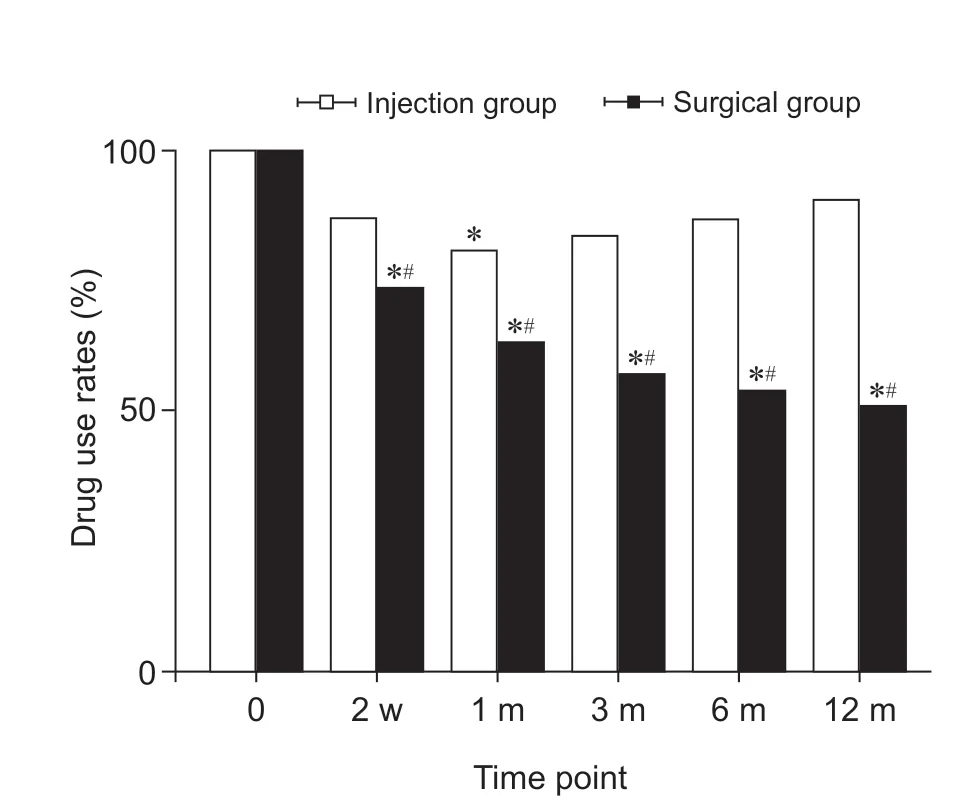
图11 两组病人术后不同时间点药物使用率变化*P < 0.05,与术前相比;#P < 0.05,与注射组相比Fig.11 Changes of drug use rates in two groups at different time after operation*P < 0.05, compared with pre-operation; #P < 0.05,compared with group injection.
4.相关治疗并发症
手术组在术后有3 例出现穿刺点疼痛,2 例出现局部穿刺处皮肤瘀斑,未观察到下肢麻木、下肢无力、感觉减退、感觉异常、神经痛等不良反应;注射组在术后仅观察到3 例出现局部穿刺处皮肤瘀斑,未见其他不良反应,两组并发症比较差异无统计学意义(见表2)。

表2 两组病人治疗相关并发症比较Table 2 Comparison of the treatment-related complications between two groups
5.病人的满意率
术后12 个月,手术组中29 例病人对术后效果满意或者非常满意,6 例对效果不确定,无存在不满意的评价;注射组中12 例病人对术后效果满意或者非常满意,7 例对效果不确定,12 例存在不满意的评价(P< 0.05,见表3)。

表3 术后病人的满意率 (n, %)Table 3 Patient satisfaction rate after treatment (n, %)
讨 论
根据在临床实践中的观察和既往研究报道,发现顽固性KOA 病人的疼痛可以发生在膝关节的任何部位,多表现为持续性膝关节前方以及后方的疼痛,上下楼梯、蹲起动作及平地行走受限,伴随膝关节长时间固定姿势后改变体位时僵硬感和不适感,在外观方面会有不同程度的膝关节内翻或外翻或/和旋转畸形,明显影响日常活动甚至影响睡眠及非负重活动,最终导致残疾。KOA 疼痛是多因素的,包括伤害性疼痛机制和神经病理性疼痛的机制。有调查研究表明,神经病理性疼痛在KOA 病人中比例约23%~40%[14,15],在本研究中同样发现KOA病人ID-pain 评分≥2 分病人占1/3 左右。且已有研究认为,顽固性KOA 病人合并中枢敏化状态[16],但由于此类病人其中枢敏化临床识别和治疗仍处于起步阶段,还有待更多的高质量研究加以证明。
有效的治疗手段是减轻疼痛的同时尽可能地改善其功能。近年来,在慢性疼痛相关疾病的治疗中,介入性疼痛的治疗得到广泛使用。然而,在骨关节炎的相关指南中[17],只是作为一个2C 证据级别的推荐。事实上,针对顽固性、终末期KOA 对保守治疗无效又不适合手术治疗或者不接受外科手术治疗的病人,临床上仍然面临着严峻的治疗选择问题,替代性微创的介入性疼痛治疗显现出其独特的优势。PRF 通过间歇性电脉冲(通常以频率为2 Hz 的20 毫秒脉冲提供500 KHz 的电流)执行,以保持目标温度低于42℃,从而避免热损伤对神经组织的宏观破坏,同时通过电场调节神经、保持疼痛缓解[18,19]。有研究表明,PRF 后脊髓中离子通道活性和c-Fos 产生发生变化可能导致伤害感觉的长期抑制[20]。RFA通过射频范围内 (500 KHz) 的电流传递到神经组织,提供了一种热介导的神经结构损伤,针对传递伤害性信号的神经,中断疼痛传导,产生长期的疼痛缓解[19,21]。LTPRA 是一种相对新颖的微创技术,其工作原理是通过100 kHz 的射频能量使电极尖端周围的局部组织形成等离子场,其中含有大量携带足够动能的离子颗粒,通常在约40~70℃的低温下切断组织中的有机分子键来消融目标组织[13,22],包括神经纤维和椎间盘髓核组织等。
在任何情况下,确定膝关节囊的神经支配对于缓解疼痛和恢复关节的稳定性是至关重要的。准确识别起源于膝关节的神经伤害性传入通路将为改善或中断伤害性疼痛提供治疗基础。膝关节的神经支配遵循希尔顿定律,即支配关节的神经也支配运动关节的肌肉和关节上的皮肤[23]。膝关节的感觉神经支配涉及股神经、腓总神经、隐神经(股神经分支)、胫神经和闭孔神经的关节分支。这些关节分支的顶点被称为膝神经。将支配膝关节囊的神经分为前、后两组[24,25],膝关节前囊的感觉输入包括:①股神经(the femoral nerve, FN)的分支,包括其肌支、股内侧肌神经(the nerve to vastus medialis, NVM)、股外侧肌神经(the nerve to vastus lateralis,NVL)、股中间肌神经(the nerve of the vastus intermedius, NVI)和隐神经髌下支 (the infrapatellar branch of saphenous nerve, IPBSN),其中膝上内侧神经(SMGN)起源于NVM;②腓总神经(CPN) 的分支,包括其末端关节支/前支、膝上外侧神经(SLGN)、膝下外侧神经(the inferior lateral genicular nerve, ILGN)和腓返神经(the recurrent fibular nerve, RFN);③胫神经(TN)的分支膝下内侧神经(IMGN)。总体而言,将膝关节前囊神经支配分为四个象限,其中内上象限由SMGN、NVM 和NVI 支配;内下象限由IMGN 和IPBSN 支配;外上象限由NVL、NVI、SLGN 和CPN 支配;外下象限由ILGN 和RFN 支配。而相关研究中未发现闭孔神经的关节分支支配膝关节前囊[26~28]。膝关节后囊的感觉输入来自闭孔神经、坐骨神经、CFN和TN 的后分支。这些分支形成一个神经丛,即膝后神经丛,与腘动脉关系密切。这些膝神经前组和后组之间存在吻合,支配整个膝关节囊。因此,两条或多条膝神经的重叠支配是常见的[27,29]。
鉴于神经支配的广泛性和可变性,将更大比例减少伤害性感觉的输入作为策略目标可能会降低膝神经治疗失败的可能性,从而改进治疗结果[28]。既往存在单独针对隐神经(the saphenous nerve, SN)射频治疗的研究,用于治疗膝关节内下侧的疼痛,研究表明对KOA 病人疼痛的有效缓解至少12 周[30]。而目前存在的许多研究都是针对传统SMGN、SLGN、IMGN 膝神经进行单针射频治疗、双针射频治疗[21,31~33]。近期美国疼痛与神经科学协会的调查表明,95%~96%的受访医师主要针对传统的3个神经进行射频治疗[34],足以显示针对SMGN、SLGN、IMGN 膝神经在KOA 治疗中的重要性,并且相关的综述显示射频治疗在短期6 个月内可有效改善KOA 病人的膝关节疼痛和功能[35]。Guven 等[36]通过随机对照试验比较传统SMGN、SLGN、IMGN膝神经射频与传统的3 种膝神经联合两种神经(隐神经腓返支和髌下支感觉神经)的膝神经射频手术治疗KOA 的有效性,发现5 种神经靶向射频治疗在治疗后1 周、1 个月、3 个月、6 个月的随访时间点NRS 评分、WOMAC 总分及SF-36 评分均有显著改善,并且优于传统3 种神经靶向射频治疗组。
虽然文献中普遍认为顽固性KOA 受累的神经是股神经、坐骨神经和闭孔神经的分支,但对于供应膝关节囊的神经分支的数量和来源却没有一致的意见。由于膝关节的神经支配复杂而广泛,无法定位膝关节囊的所有神经,有文献指出可能需要多达10 个靶点才能达到最佳覆盖范围[37]。当针对10 个以上解剖位置的治疗时,需要占用相当大的手术时间和手术资源,这对临床医师极具挑战。在膝关节神经的尸体解剖中发现,膝关节周围的髌骨周围软组织中有丰富的P 物质传入神经纤维分布[25],由此在TKA 中,经常在保留原有髌骨的情况下,行髌骨周围电凝术(the patellar denervation with electrocautery, PD),从而通过对膝前区疼痛感受器的脱敏或去神经化来减轻髌股关节区疼痛,也就是KOA 病人常主诉的膝前区疼痛[38]。Thiengwittayaporn 等[39]等开展的前瞻性、随机对照试验研究比较TKA 术中有无PD 的疗效,发现合并PD 的病人术后膝前区疼痛的发生率显著降低,并且膝前区疼痛强度的缓解以及病人满意度评分在3 个月时PD 组均明显优于未实施PD 组。但有学者担心PD 可能会导致髌骨本体感觉障碍,导致负重异常,甚至对关节软骨存在损伤。但在相关报道中,并没有发现PD 组术后并发症与非PD 组间存在统计学意义上的差异[40]。借鉴此类做法,并且考虑到与RFA 相比,LTPRA主要作用是基于低温下的分子解离,而不是射频热凝中的热损伤,所引起的并发症更少,因此本研究通过LTPRA 针对髌周软组织,进行髌周部分去神经化。
本研究使用多模式的介入治疗包括PRF、RFA联合LTPRA 治疗顽固性KOA。很多顽固性KOA的病人的疼痛范围囊括膝关节后侧、膝关节内侧、膝关节外侧以及髌周,因此本研究纳入具有疼痛范围广泛的顽固性KOA 人群,采用多模式的联合微创介入镇痛技术,针对不同的神经、不同的部位选择不同的技术手段,在尽可能发挥其优势的基础上避免术后并发症。其中,通过RFA 技术针对传递来自关节囊感觉信号的膝神经终末感觉支,包括传统的3 种神经(SMGN、SLGN、IMGN)以及隐神经,消融膝关节传导痛觉的感觉神经,达到去膝关节痛觉传入的目的;利用LTPRA 作用范围大于RFA,且分子解离的损伤少的优点,模拟PD,达到髌周去神经化、局部髌周软组织消炎的目的;此外,针对膝关节后方、腘窝处的疼痛,由于后方的膝后神经丛,与腘动脉关系密切,并且关节分支变异度大,因此本研究选择彩超下更易识别、定位以及广泛支配腘窝后侧的CFN 以及TN,行对膝关节运动神经功能无损伤的PRF 治疗,达到疼痛缓解的目的。除了彩超直视下穿刺定位以及多模式的治疗方式选择外,本研究在操作过程中还通过射频仪进行感觉、运动刺激测试,诱发所需要的异感或者肌肉跳动,达到尽可能靠近靶点神经、避免损伤运动神经的目的。本研究发现手术组的病人较注射组,疼痛状态、僵硬程度以及关节功能呈持续性改善,随着随访时间的延长,病人疼痛状态、僵硬程度以及关节功能虽较术后短期内略有加重,但仍较术前明显改善。非常重要的是,本研究在随访过程中,手术组药物使用率明显下降,并未发现下肢麻木、下肢无力、感觉减退、感觉异常、神经痛、夏科氏关节病等严重的不良反应,且病人术后满意度优于注射组,愿意向其他病人推荐此项技术手段。
本研究达到了既定的目的,但也存在一定的局限性。首先,本研究是回顾性单中心研究,存在不可避免的偏差;其次,纳入病例数量较少,仅是单中心的研究;最后,因为是回顾性分析,存在数据的失访,无法纳入研究的情况,虽然对治疗效果进行了长时间的回顾性研究、随访,但这可能不足以确定治疗的长期效果。还需要对更大的病人群体进行前瞻性研究,在今后的进一步研究中可以采用随机、对照分组,分为多模式射频镇痛、药物保守或膝关节注射治疗组等进行探讨,评估此疗法的长期效果,为临床顽固性KOA 提供除骨科治疗手段以外,更多有效且切合实际的选择。
综上所述,膝神经射频联合LTPRA 为疼痛医师参与顽固性KOA 病人的管理开辟了新的视野。射频仪电刺激结合超声(双重引导)有助于神经定位,有助于应对膝神经的变异性和复杂性。多模式的治疗可以在不损伤运动神经的前提下,选择性地多靶点阻断膝关节囊的感觉神经,减少来自膝关节痛觉的伤害性输入,最终缓解膝关节疼痛,改善膝关节功能,术后随访期间未发现严重的不良反应,可以作为一种非常有希望的替代治疗模式,期待前瞻性多中心研究的开展。
利益冲突声明:作者声明本文无利益冲突。
