玉足海参变态附着阶段转录组分析
2023-12-25吴晓鹏黄敏伟陈晓瑛赵吉臣刘凤坤张业辉
吴晓鹏,黄敏伟,陈晓瑛,彭 凯,赵吉臣,钟 平,刘凤坤,张业辉,黄 文
1.广东海洋大学 水产学院,广东 湛江 524088
2.广东省农业科学院动物科学研究所/农业农村部华南动物营养与饲料重点实验室/广东省畜禽育种与营养研究重点实验室,广东 广州 510640
3.广东省农业科学院水产协同创新中心,广东 广州 510640
4.暨南大学 生命科学学院,广东 广州 510632
5.广东省农业科学院蚕业与农产品加工研究所,广东 广州 510640
玉足海参 (Holothurialeucoisplota) 隶属于楯手目、海参科、海参属[1],是一种具有较高经济价值的热带海参。在我国主要分布于海南、广东等南部沿海海域的岩礁、珊瑚礁、泥沙质浅海。其体形呈圆筒状,后部比前端粗大,成参可以长到20 cm 以上,口偏于腹面,居维氏器很发达,腹面散生有大量呈乳状突起的管足且排列不规则[2]。玉足海参具有环境适应能力强、耐应激的特点[3],在维持近岸海洋生态系统稳定中扮演了关键角色,是进行放流移植及岛礁生态环境修复工程的理想种类[3-4]。此外,海参自古以来便被视为滋补珍品,在东亚地区被广泛食用以及用作制药原料[5-6]。国内外学者对海参进行营养组成测定和营养评价,发现其富含胶原蛋白、多糖、皂苷、维生素、多肽、脑苷酸等多种活性物质。此外,对这些活性因子的研究也在逐步深入,目前已经证实其具有抗肿瘤、抗氧化、抗凝血、抗病毒和提高机体免疫力等多种生理功效[7-9]。
随着人们对海参营养价值认知的提高,对其需求也日益增大,导致热带海参的过度捕捞,使其自然资源急剧减少[10]。目前,全球超过一半的海参资源被过度开发,约30%的海参渔业已经崩溃[11]。市场需求的剧增以及资源的枯竭使得热带海参人工繁育和养殖技术的研发显得尤为迫切[12]。目前,已有几种热带海参成功实现了人工繁殖[3,13-16],但这些人工繁育技术尚处于探索阶段,其繁育规模小、幼苗数量少,与应用于人工养殖及增殖放流仍有一定距离。玉足海参的繁育和养殖研究尚处于起步阶段,目前可实现人工催产和孵化[3-4,17]。玉足海参幼虫在耳状幼体期间体积逐渐膨大,而在受精约15 d 后 (水温为29~33 ℃),体积开始明显缩小形成樽形幼体,生活状态也由浮游变为底栖[4]。而这一变态过程的高死亡率是热带海参繁育过程中的共性问题,其背后的机制至今不明。本研究基于全长转录组测序技术[18-20],使用Illumina 测序平台对4 个不同发育时期的海参幼体 (小耳幼体、中耳幼体、大耳幼体和樽形幼体) 进行了高通量测序分析。通过研究其幼体不同时期的基因表达差异,探究与海参生长发育相关的重要信号通路并发掘关联基因,旨在提高对该物种生长发育机制的认识,为其育苗和养殖提供分子层面的育种研究借鉴,并为热带海参增养殖业发展及科学研究提供参考依据。
1 材料与方法
1.1 实验材料
实验海参捕捞于深圳大鹏湾海域,并于广东省茂名市电白区金阳生物技术有限公司养殖基地暂养。玉足海参亲本的性腺成熟时期一般在6—8 月,此时是其最佳的繁育时期。因此,本实验在2022 年7 月进行海参亲本的采集、人工繁育及不同发育时期幼体样品的收集。首先从池中捞出亲本进行阴干处理,然后放入桶中待产卵排精。收集精子和卵子,经湿法受精后转入孵化池进行孵化。其后对其幼体发育过程进行监测,并分别收集小耳幼体、中耳幼体、大耳幼体和樽形幼体4 个生长发育时期的个体 (图1) ,其中每个时期采集3 份样品,每份样品包含3 个同一时期的个体。将收集的样品立即放入液氮罐中冷冻,运至实验室于-80 ℃冰箱中保存备用。

图1 玉足海参幼体 4 个发育时期的形态注: a.小耳幼体 (A 期); b.中耳幼体 (B 期);c.大耳幼体 (C 期);d.樽形幼体 (D 期)。Fig.1 Morphology of H.leucospilota larva at four developmental stagesNote: a.Early auricularia (Stage A); b.Mid auricularia (Stage B); c.Late auricularia (Stage C); d.Doliolaria (Stage D).
1.2 RNA 提取与转录组测序
按常规Trizol 法提取玉足海参幼体样品的总RNA,并标记如下:小耳幼体 (A 期)、中耳状幼体(B 期)、大耳状幼体 (C 期)、樽形幼体 (D 期),每个时期的3 个重复样品用1、2 和3 区别。总RNA 的质量浓度大于100 ng·μL-1,OD260与OD280比值介于 1.8~2.2,OD260与OD230比值大于 2.0,确保实验室中所提取的RNA 无污染、无降解。将提取的RNA 样品送至上海美吉生物有限公司,经文库构建后采用Illumina HiSeqTM 6000 高通量测序平台进行转录组测序。
1.3 转录组从头组装
测序所获得的初始图像数据经Base Calling 处理转成序列数据,使用fastp 软件去掉reads 中的接头序列和低质量的序列,从而得到高质量的测序数据(Clean reads)。使用Trinity 软件在默认程序设置下对测序数据进行组装,首先将reads 拼接成长的片段contigs,然后去除掉冗余contigs,将contigs 进行分组,连接成两端不能再延长的转录片段(Unigenes)。
1.4 转录组生物信息学分析
将该次转录组测序获得的所有转录本与6 大数据库分别进行比对注释分析。着重对GO 和KEGG 进行分析。GO 注释包含3 个大分支,即细胞组分 (Cellular component,CC)、生物过程 ((Biological process,BP) 和分子功能 (Molecular function,MF);所有已知基因序列都会被注释到其中,随着分支的展开,基因所具有的功能也越来越详细的注释出来。KEGG 通路可分为细胞过程、药物开发、代谢、遗传信息处理、环境信息处理、生物体系统和人类疾病7 大类别。随着各类别的展开,对类别所包含的注释基因描述就越清晰。采用FPKM 方法来测量基因的表达量水平。在比较不同时期的样本后,使用DEGseq2 软件包筛选一定条件下的差异表达基因,所设定的阈值为 |log2(FoldChange)|>1。按照通用默认值设定Padjust<0.05,则该基因为显著差异表达基因。采用 Goatools 软件对差异表达的基因进行GO 功能富集分析,当经过校正的Padjust<0.05 时,则认为此GO 功能类别存在显著富集情况。KEGG 通路富集分析计算原理同GO 功能富集分析一致,即经过校正的Padjust<0.05 时,则认为此KEGG 通路存在显著富集情况。
1.5 实时荧光定量PCR
随机选择6 个在玉足海参发育过程中表达量显著变化的基因进行实时定量PCR 检测,对转录组数据的可靠性进行验证。用Trizol 试剂提取玉足海参幼体总RNA (上海百赛生物技术有限公司),使用HiScript II Q RT SuperMix for qPCR (+gDNA wiper)(南京诺唯赞生物科技股份有限公司) 合成cDNA 第一链。按照 TB Green®Premix Ex Taq™ II(上海百赛生物技术股份有限公司)说明书进行实时定量 PCR,并使用 SPSS 24.0 软件 进行独立样本t检验,P<0.05 为显著性差异,荧光定量检测数据结果使用2—ΔΔCt方法计算分析。以β-Actin作为内参基因,所用引物见表1,所设计引物的扩增效率和特异性使用cDNA 样品的标准曲线确定和依据熔解曲线分析确定。玉足海参的12 个样品均进行检测,每个样品技术重复3 次。

表1 引物信息Table 1 Primer information
2 结果
2.1 测序数据统计与组装结果
采集4 个不同发育时期的海参幼体样品进行全长转录组测序分析。通过高通量测序后获得了87.38 Gb Raw data。在经过原始数据过滤处理后,每个样品的清洁读数从42 974 554 到59 419 634 不等,有效读数比率为98.9%。详细统计结果见表2,包括原始碱基、有效碱基、Q20、Q30、GC 含量等。随后通过Trinity 软件进行denovo 组装,共得到93 528 个Unigenes。

表2 转录本组装结果统计分析Table 2 Statistics analysis of transcript assembly results
2.2 转录组注释
将获得的Unigenes 分别与GO、KEGG、COG、NR、Pfam、Swissprot 数据库进行比对,获得玉足海参幼体Unigenes 在各个数据库的注释信息。结果有48 087 个Unigenes 得到注释,占整个组装转录本的51.41%,GO、KEGG、COG、NR、Pfam 和Swissprot 数据库中的同源序列注释条数分别为36 422 (38.94%)、31 013 (33.16%)、36 608(39.14%)、47 228 (50.49%)、35 775 (38.25%)和35 567 (38.04%)。NR 物种注释表明(图2),玉足海参与仿刺参 (Apostichopusjaponicus) 同源性最高(73%),其次是绿海胆 (Lytechinusvariegatus)、紫色球海胆 (Strongylocentrotuspurpuratus)、长棘海星(Acanthasterplanci)和蝠海星(Patiriaminiata)。GO 功能注释显示基因功能聚类排名前三位的分别是细胞组分类别的细胞部分、分子功能类别的组合和催化活性 (图3)。KEGG 通路注释显示功能基因参与排名前三位的生物学通路分别是环境信息处理类别的信号转导、人类疾病类别的癌症概述和神经退行性疾病(图4)。
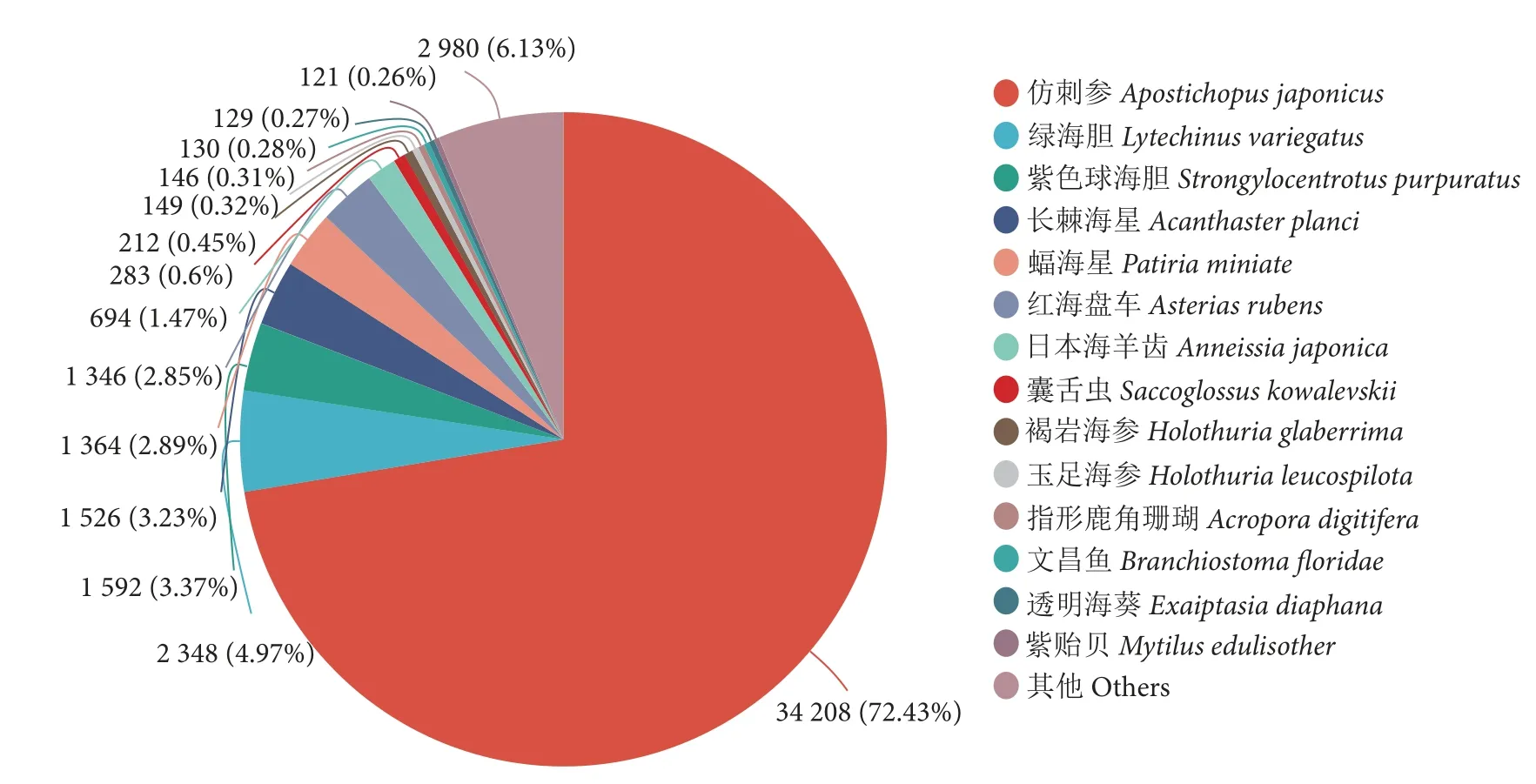
图2 NR 数据库比对统计图Fig.2 Comparison chart of NR database

图3 Unigene GO 功能注释结果Fig.3 GO annotation results of unigene

图4 Unigene KEGG 功能注释结果Fig.4 KEGG annotation results of unigene
2.3 差异表达转录组分析
为探究玉足海参幼体变态发育过程中的基因表达变化情况,本实验对海参的4 个不同发育时期的转录组测序文库进行了比较分析,共检测到43 720个差异表达基因,其中A 期与B、C、D 期比较,表达量差异显著的基因数目分别为17 732 个 (上调9 863 个,下调 7 869 个)、17 189 个 (上调10 025个,下调 7 164 个)、24 081 个 (上调13 700 个,下调10 381 个);B 期与C、D 期比较,表达量差异显著的基因数目分别为11 757 个 (上调 6 229 个,下调 5 528 个)、20 990 个 (上调10 877 个,下调10 113个); C 期与D 期比较,表达量差异显著的基因数目为11 319 个 (上调6 727 个,下调4 592 个)。A期与D 期差异基因数最悬殊,表明玉足海参发育至樽形幼体后,基因表达数量发生显著变化,使机体得以适应变态发育过程。相邻组间 (A_vs_B,B_vs_C,C_vs_D) 上调和下调基因数量虽然基本均呈下降趋势 (图5),但上调基因远多于下调基因,说明在变态发育过程中,更多的基因被释放表达。同时也表明一些基因只在特定时期的表达发生显著变化,这可能与特定的生长发育表达调控相关。

图5 相邻组间差异表达基因火山图注:A_vs_B.B 期以A 期为参照基准比较;B_vs_C.C 期以B 期为参照基准比较;C_vs_D.D 期以C 期为参照基准比较。后图同此。Fig.5 Volcano map of differentially expressed genes between adjacent groupsNote: A_vs_B.Stage B was compared with Stage A; B_vs_C.Stage C was compared with Stage B; C_vs_D.Stage D was compared with Stage C.The same case in following figures.
2.4 GO 和KEGG 富集分析
为探究玉足海参响应变态发育的分子机制,对差异表达的基因进行GO 功能富集和KEGG 通路分析。相邻组间 (A_vs_B,B_vs_C,C_vs_D) 差异基因分别富集于579、371、441 个GO 功能类别。其中,富集频率排名靠前的主要是分子功能、细胞成分、催化活性等与细胞成长相关的生物学功能。KEGG 通路富集分析显示A_vs_B、B_vs_C 和C_vs_D 的差异基因分别涉及342、340 和339 个通路,而且绝大部分被富集的信号通路与生长发育密切相关,包括细胞增殖分化相关通路 (细胞周期、基因复制等)、细胞凋亡通路 (癌症途径、Wnt等)、糖类代谢及脂类相关通路等 (图6)。说明玉足海参变态发育是一个复杂的过程,受到多个基因的调控。
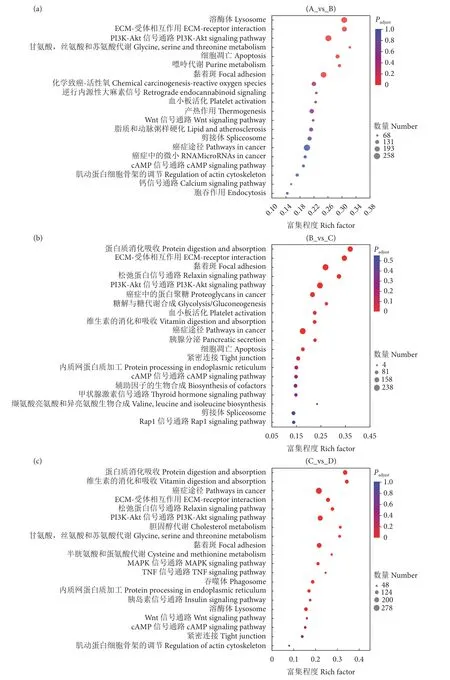
图6 相邻组间差异表达基因 KEGG 通路分析Fig.6 KEGG pathway analysis of differentially expressed genes between adjacent groups
2.5 与生长相关的基因分析
随着玉足海参幼体的生长发育,其体型大小在变态附着阶段会发生转折。首先在耳状幼体时期幼体体积会不断膨大成树突状幼虫 (图1-c),而后在樽形幼体时期幼体体积逐渐收缩成椭圆状幼虫(图1-d)。对相邻组间差异基因分析的结果显示,与生长性状调控相关的基因在特定发育时期显著差异表达。如随着幼体体积的变化,cox1和tll1基因表达量在A 至C 期逐渐上调,然后在D 期显著下调。ctsl2基因在B 期显著上调而在D 期显著下调,c-lectin2基因仅在D 期显著上调,survivin基因只在D 期显著下调。这说明机体依据变态阶段不同生长发育时期的反馈任务去执行相应的表达程序,控制有效调节因子去执行细胞增殖、分化和凋亡功能,使其能够正常渡过变态附着阶段[21-22]。
2.6 实时荧光定量PCR 分析
随机挑选6 个差异表达显著的基因,对目标转录本进行定量分析以验证玉足海参转录组测序结果数据和分析的准确性。结果如图7 所示,实时荧光定量PCR 分析得到的表达趋势与Illumina 测序得到的表达趋势相似,但几个基因的表达差异幅度存在一定差异。这可能是两种方法的灵敏度不同所致。据报道,RNA-Seq 对目的评估基因更为敏感,说明使用测序分析所验证的差异表达转录本较为可靠[23]。

图7 qRT-PCR 验证 RNA-seq 结果Fig.7 RNA-Seq results verified by qRT-PCR
3 讨论
3.1 注释信息分析
玉足海参幼虫发育需经历浮游生活到附着生活的转变,这个过程受到环境和遗传因素的共同影响[24-25]。本研究对组装得到的Unigenes 进行生物学功能注释,共检测到 43 720 个差异表达基因。通过NR 物种相似度功能注释分析,有三分之一的Unigenes 与库中已知基因同源,相似度排名靠前的均为海洋无脊椎动物,玉足海参与这些物种具有较高的亲缘性,尤其是以仿刺参、海星等为代表的棘皮动物相似度最高;它们的许多基因是由共同祖先基因分化演变而成。本实验所获得的NR 序列比对呈现出注释率数值较小,这可能是由于国际公共数据库收录的相近物种基因信息较为匮乏,并且也受到实验条件和测序水平等因素的限制。另外有一小部分序列未注释匹配成功,可能原因是这些序列与现有数据库中的基因序列匹配度较低,可能为无翻译能力的RNA 或者无表达功能的结构域序列[26];它们有可能参与重要的生命活动,并且在生物体内发育功能和过程中起重要作用。对3 个相邻组间GO 注释富集分析 (表3),其中,生物过程最主要的GO 类别聚集是细胞过程、代谢过程,细胞组分最主要的GO 类别聚集是细胞部分、膜部分,分子功能最主要的GO 类别聚集是组合、催化活性。不同比较组间转录本GO 类别与功能富集多数与细胞的完整性及其功能相关,这意味着随着生长周期的延长,细胞内的碳水化合物、脂质等活性物质含量逐渐积累,细胞数量和体积也逐渐增长,相关转录本的功能多与细胞周期调控、细胞组合及催化活性紧密相关。在大耳到樽形幼体生长模式的转换过程中,细胞黏附类别富集频率显著增加,其生物学功能是通过细胞的识别与黏附使具有相同表面特性的细胞聚集在一起形成组织和器官,这很可能是幼体从浮游期到附着期特定器官生长变化的关键功能。同样的,对相邻比较组间转录本参与的KEGG 注释通路进行富集分析,发现其注释多与神经和肌肉发育代谢过程相关。这说明在变态附着发育期间,很多控制神经、肌肉和皮肤等组织表达通路里的转录因子很可能是影响生物体正常发育的关键因素,如肌动蛋白细胞骨架调节、ECM-受体相互作用、钙等信号通路,这有待更为深入的研究。
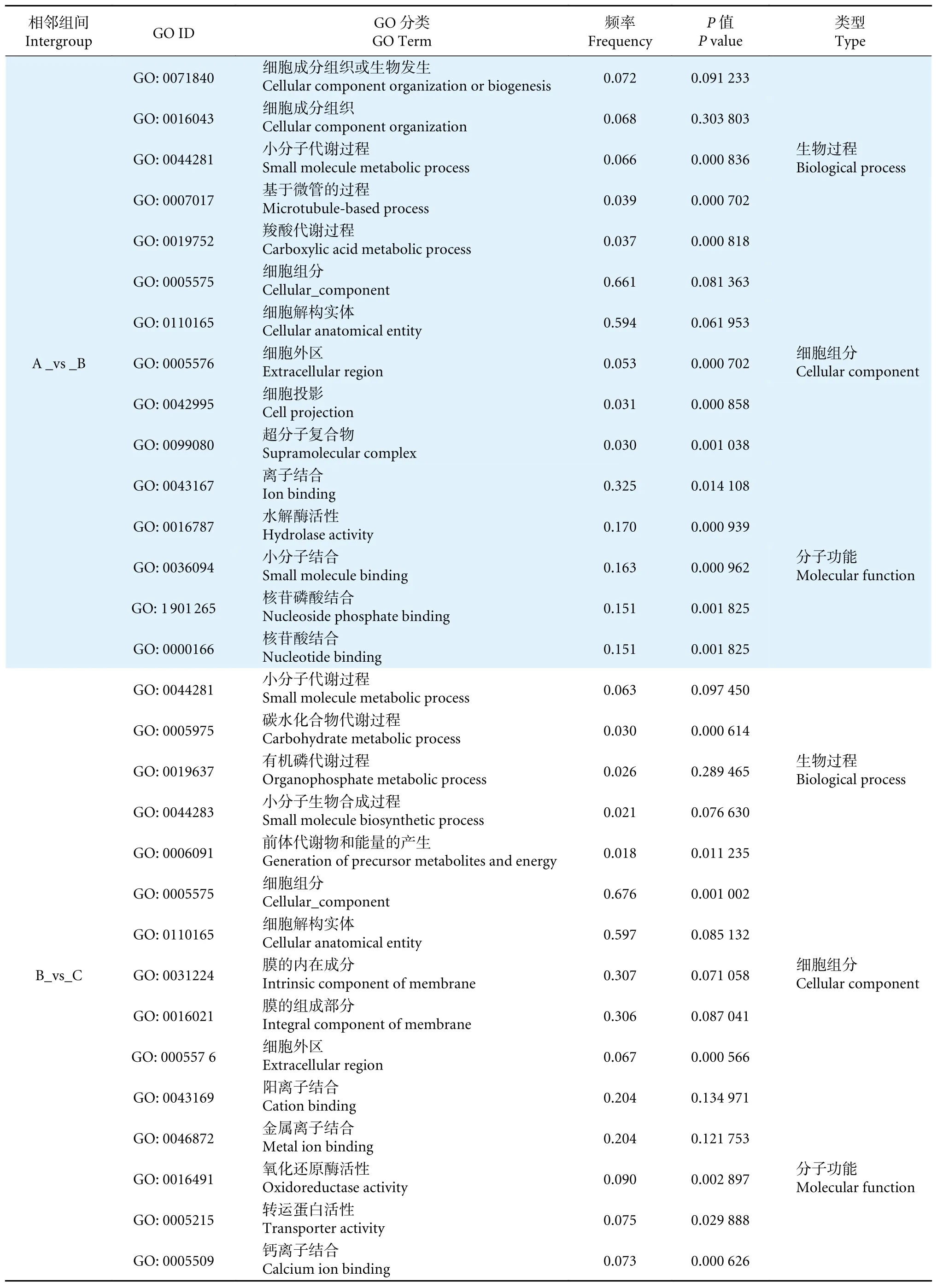
表3 相邻组间差异表达基因 GO 富集分析 (前 5)Table 3 GO enrichment analysis of differentially expressed genes between adjacent groups (Top five)
3.2 变态附着阶段差异基因分析
玉足海参在浮游幼体期主要是以海洋藻类等浮游有机质为食,大耳幼体后期变态为樽形幼体附着后转而以浅层沉积物质为主要摄食对象。因此,这两种截然不同的生活方式可能涉及到两套非常不同的基因调控网络[27]。对4 个时期幼体观察研究发现,樽形幼体时期的死亡率达到54%,这在玉足海参变态发育以及整个生长过程中为最高[3]。然而,目前针对这一阶段的基因调控基础仍不清楚,基因层面的机制受控很可能使变态延迟或变态失败,最终导致幼虫可能因能量消耗过多和环境变化而死亡[28]。分析4 个时期的差别,A 和D 期之间的差异基因数目最多 (24 081 个),而C 和D 期之间的差异基因数目最少 (11 319 个)。表明有较多的调控基因参与了幼体发育过程,多种机制的协同与拮抗作用反馈影响幼体发育的相关基因的激活与抑制。此外,相邻时期表达的差异基因数量逐渐减少且放缓。这表明变态发育引起的玉足海参体内的反应从最开始不稳态到过渡新稳态,至樽形幼体时期达到一个新的平衡。分析比较组间基因表达量差异结果,有高FPKM 值的基因与能量代谢、蛋白质代谢、催化活性、细胞骨架等基本过程相关。它们在体内干细胞正常发育、组织维持和血管生成中可能发挥了重要作用。如在B 期显著上调和D 期显著下调的ctsl2基因,它是一种重要的半胱氨酸蛋白酶,与溶酶体蛋白酶类似,能够清除细胞中多余的蛋白质[29];研究发现,ctsl2可以使仿刺参三倍体的生长速度快于二倍体[30]。此外,也有一些基因虽然并无显著差异的表达,但在变态附着阶段中可能起到至关重要的作用。如作为执行凋亡程序的caspase-3基因,在很多生物体内的细胞凋亡过程中起重要作用,在玻璃海鞘 (Cionaintestinalis)幼体变态发育的研究中,capsase-3依赖性细胞凋亡是通过磷酸化 ERK 执行了尾部的退化过程[31-33],其在玉足海参D 期的表达水平较高。还有作为负调节动物骨骼肌发育和生长因子的肌肉生长抑制素(myostatin) 基因,能通过抑制成肌细胞增殖和多核肌管分化来调节肌肉质量[34-36],其在玉足海参A 和D 期的表达水平较高。因此,差异显著基因可能在玉足海参变态附着的过程中,对机体适应新的生长模式起非常重要的作用。它们可以作为玉足海参选育潜在的候选基因,推动整个幼体繁育的生物学过程研究。
3.3 关键发育信号通路分析
在本次转录组测序中,KEGG 注释显示玉足海参4 个不同发育时期幼体的功能基因涉及细胞周期、Wnt、PI3K-Akt、磷酸戊糖、胰岛素信号转导、蛋白质消化吸收、胆固醇代谢、MAPK 信号通路等8 个与变态发育密切相关的信号通路。如细胞周期信号通路中的cdk、cyclin基因家族网络调控生长发育在其他水生动物的研究中已有报道,cdk基因通过与cyclin基因结合形成复合物,从而调节细胞增殖和分化。对文蛤 (Meretrixmeretrix)的研究发现,cdk基因在各实验组的表达情况与其壳长生长正相关,推测cdk基因在文蛤早期苗种生长中发挥了重要作用[37]。与胚胎发育相关的Wnt 信号通路也有相关报道,在对半球美螅水母(Clytiahemisphaerica) 研究中,wnt3基因通过影响受体基因的表达量来维持其胚胎发育的体轴模式系统中口端和反口端的稳定[38]。在对贝螅(Hydractinia) 的研究中,通过分析frizzled和β-catenin这两个Wnt 信号通路关键基因,以及gsk-3基因的阻断,证实了经典Wnt 信号通路参与了贝螅功能干细胞的调控过程[39]。而PI3K-Akt、磷酸戊糖等通路的基因对生长发育的调控在其他生物中也有报道[40-42],它们在细胞的存活、分化、生长、运动和凋亡等多种生理和病理过程中起到重要作用。这些通路中的基因在玉足海参变态发育过程中如何调控关键生物学过程有待进一步研究。
此外,根据实验观察 (图1),玉足海参在大耳幼体变态成樽形幼体的过程中,颜色逐渐加深、体型逐渐变小,这个过程中的通路调控网络主要是控制幼体发生了细胞凋亡、增殖分化等生命活动,最终大耳幼体在这些程序正常执行之后变成了樽形幼体。此庞大的运作机制是一个最为复杂且极为重要的步骤,这可能是导致其高死亡率的主要原因。对这一时期富集通路的分析发现,癌症途径发挥了关键作用 (图6),其富集注释基因数量显著上升,富集频率在这一时期也居首位。它涉及到很多生长调控和凋亡基因,正常的细胞凋亡会抑制致癌转化,并控制器官形成和免疫反应。如此途经的ap-1基因是信号传导的第三信使,在D 期显著上调表达。它的基因产物能够诱导D N A 与保守的bZIP 结构结合,其活性在信号传导过程中会被MAPK 信号通路的磷酸化调控[43]。通过影响相关免疫、生长基因的转录表达过程,进而参与生物体内的免疫系统防御、细胞增殖分化、编程性死亡等过程[44]。该基因在青蛤 (Cyclinasinensis) 受到免疫刺激后显著上调,其不仅影响免疫应答过程,同时也可能参与了细胞的编程性死亡[43]。该基因也参与了青海湖裸鲤 (Gymnocyprisprzewalskii) 肌肉生长和分化过程,其在肌肉中的表达量显著上调[45]。此外,survivin基因作为凋亡蛋白抑制因子也在这时期显著下调,survivin基因能抑制fas、bax及caspase3/7基因诱导的细胞凋亡[46]。这说明癌症途径参与了细胞凋亡响应的重要过程,具体在玉足海参变态附着阶段如何调控生物学过程也有待进一步研究。
4 结论
本实验通过转录组分析研究了玉足海参变态附着阶段的分子调控机理,结果显示玉足海参幼体生长发育和细胞凋亡发生的信号转导途径具有多样性,其差异基因和通路彼此间相互促进或制约形成了错综复杂的调控网络。针对玉足海参附着阶段死亡率过高的问题,本研究推测主要与细胞是否正常执行凋亡相关,对这些相关差异基因和通路进行内在机理的探索,有助于揭示玉足海参的生长发育规律,为后续开展玉足海参的规模化繁育技术研究奠定基础,同时也可为其他热带海参的人工繁育提供参考。
