芽孢杆菌糖基水解酶GH489的表达及生物活性研究
2023-12-25田宇曦杜思源余晓华夏昊天刘晓艳闵勇陈凌朱镭1邱一敏
田宇曦 杜思源 余晓华 夏昊天 刘晓艳 闵勇 陈凌 朱镭1 邱一敏

摘要:为了探究芽孢杆菌(Bacillus sp.)糖基水解酶GH489的生物活性,通过设计特异性引物扩增得到目的基因gh489,采用大肠杆菌原核表达系统对重组GH489蛋白进行表达,利用组氨酸标签对目的蛋白进行分离纯化,并检测芽孢杆菌糖基水解酶GH489对二斑叶螨的杀螨活性。结果表明,由大肠杆菌BL21(DE3)表达的重组GH489蛋白为可溶性蛋白质,其蛋白质分子质量约为57 kDa。纯化后的GH489重组蛋白显示出良好的杀螨活性,处理24 h后,二斑叶螨的半致死浓度(LC50)为30.296 μg/mL,处理48 h后,二斑叶螨的半致死浓度(LC50)为21.212 μg/mL。
关键词:芽孢杆菌(Bacillus sp.);糖基水解酶;表达;蛋白纯化;杀螨活性
中图分类号:TS201 文献标识码:A
文章编号:0439-8114(2023)11-0198-04
DOI:10.14088/j.cnki.issn0439-8114.2023.11.034 开放科学(资源服务)标识码(OSID):
Expression and biological activity of Bacillus sp. glycosyl hydrolase GH489
TINA Yu-xi1, DU Si-yuan1, YU Xiao-hua2, XIA Hao-tian2, LIU Xiao-yan1,
MIN Yong1, CHEN Ling1, ZHU Lei1, QIU Yi-min1,2
(1.Hubei Biopesticide Engineering Research Centre, Wuhan 430064, China;
2.Yangxin County Specialty Service Center, Huangshi 435299, Hubei, China)
Abstract: In order to investigate the biological activity of Bacillus sp. glycosyl hydrolase GH489, the target gene gh489 was amplified by designing specific primers,the recombinant GH489 protein was expressed using the Escherichia coli prokaryotic expression system, and the target protein was isolated and purified using histidine tags. The acaricidal activity of Bacillus sp. glycosyl hydrolase GH489 against Tetranychus urticae was detected. The results showed that the recombinant GH489 protein expressed by Escherichia coli BL21 (DE3) was a soluble protein with a molecular weight of approximately 57 kDa. The purified GH489 recombinant protein showed good acaricidal activity,after 24 hours of treatment, the half lethal concentration (LC50) of Tetranychus urticae was 30.296 μg/mL, and after 48 hours of treatment, the half lethal concentration (LC50) of Tetranychus urticae was 21.212 μg/mL.
Key words: Bacillus sp.; glycosyl hydrolase; expression; protein purification; acaricidal activity
碳水化合物是地球上最豐富的生物分子。从结构元素(纤维素、甲壳素)、能量分子(淀粉、糖原)到参与细胞识别过程,它们在生物体内发挥不同的作用。将碳水化合物(糖)分子与另一个糖或非糖类物质的基团用共价连接起来,形成长链聚合物。糖基水解酶(Glycoside hydrolases,GH,EC3.2.1),又称为糖苷酶或糖苷水解酶,是一种广泛存在于大部分生物体的酶,可水解糖苷键,形成糖半缩醛或半缩酮和游离苷元。糖基水解酶还可以水解碳水化合物与 O—、N—、S—键的连接。其分类方式具有多样性,可以根据水解反应的立体化学结果(保留或反转)进行分类,也可以根据酶的作用方式分类,即外切(非还原端)和内切(分子中间),还可以基于蛋白序列和结构进行分类。基于序列分类结果得出有150多个不同的糖基水解酶家族[1]。
糖基水解酶存在于绝大部分的生命领域,在原核生物中既是细胞内酶又是细胞外酶,主要参与糖苷分子水解、营养物质获取、操纵子表达调控、翻译后修饰、高等生物溶酶体储存、糖原生物合成和降解。在高等生物中,糖基水解酶存在于内质网和高尔基体(负责N-连接糖蛋白的加工)、肠道中的溶酶体(负责碳水化合物结构的降解)和唾液中的碳水化合物降解酶(淀粉酶),肠道中的内皮细胞糖基磷脂酰锚定酶,如乳糖酶(降解牛奶中的乳糖)、O-GlcNAcase酶(负责定位于细胞质和核的丝氨酸和苏氨酸残基中N-乙酰氨基葡萄糖基的去除)。
糖基水解酶被广泛应用于生物和化学工业,如纤维素酶、木聚糖酶等被用于植物原料的生物炼制,生产高附加值的生物基质产品。在食品工业中,转化酶被用于生产反式糖,淀粉酶被用于生产麦芽糊精;在造纸和纸浆工业、洗涤剂制造工业中,纤维素酶常被用于棉织物的洗涤,通过去除微纤维以保持织物的色泽[2]。此外,一些糖基水解酶具有转糖基能力,用于合成低聚糖和糖苷,例如低聚半乳糖(由β-半乳糖苷酶合成)和辛基葡萄糖苷(由β-glucosidase合成)。糖基水解酶还可以降解微生物生物膜胞外聚合物(EPS)的基质多糖,提高抗生素效力,增强宿主免疫功能[3,4]。除了降解植物多糖外,它们还在抗菌防御机制(溶菌酶)、正常细胞功能(通过甘露糖苷酶合成N-连接糖蛋白)、病毒神经氨酸酶的发病机制中发挥作用[5,6]。
本研究以芽孢杆菌糖基水解酶GH489的基因为研究对象,通过构建GH489重组蛋白表达载体、对GH489重组蛋白进行表达和纯化,测定其杀螨活性,为全面认识和了解芽孢杆菌糖基水解酶的生物活性、进一步丰富芽孢杆菌糖基水解酶的功能研究奠定基础。
1 材料与方法
1.1 质粒与菌株
贝莱斯芽孢杆菌NBIF-256、pColdII冷休克载体、Escherichia coli DH5α以及Escherichia coli BL21(DE3)菌种均来源于湖北省生物农药工程研究中心。
1.2 试剂
质粒DNA小提试剂盒、细菌基因组DNA提取试剂盒均购自Omega公司;Nde I、Xba I限制性内切酶均购自NEB公司;琼脂糖凝胶DNA回收试剂盒、PCR产物纯化回收试剂盒均购自天根生化科技(北京)有限公司;TransStart? FastPfu DNA聚合酶、PCR SuperMix均购自北京全式金生物技术有限公司;dNTPS、T4 DNA连接酶等均购自宝生物工程(大连)有限公司;Ni-NTA 6FF预装重力柱购自生工生物工程(上海)股份有限公司;胰蛋白胨、酵母提取物、氯化钠等常规分析纯试剂均购自国药集团化学试剂有限公司。
1.3 仪器
Gel Doc EZ凝胶成像仪、PCR仪均购自Bio-Rad 公司;UV 2450型紫外可见分光光度计购自岛津公司;无菌超净工作台购自苏净安泰公司;电热恒温培养箱购自恒丰医疗器械有限公司。
1.4 GH489重组表达载体及重组菌株的构建
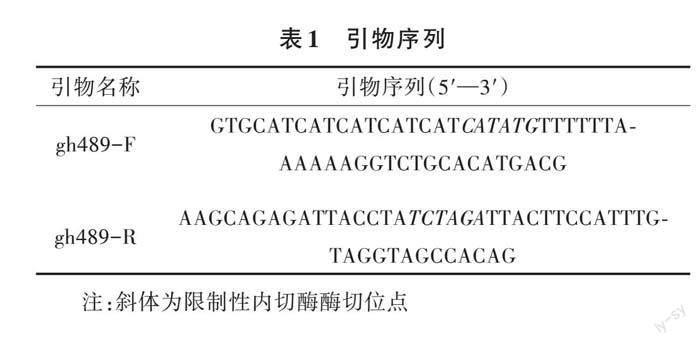
根据贝莱斯芽孢杆菌NBIF-256糖基水解酶GH489(WP_032873382.1)编码基因序列设计引物gh489-F和gh489-R(表1)。以贝莱斯芽孢杆菌NBIF-256基因组DNA为模板,用引物gh489-F和gh489-R扩增gh489基因。PCR反应体系:5×FastPfu PCR buffer 5.0 μL,dNTPs(2.5 mmol/L)2.5 μL,模板DNA(10 ng/μL)1.0 μL,上下游引物gh489-F和gh489-R(10 μmol/L)各1.0 μL,添加ddH2O至终体积为25 μL。PCR反应程序:95 ℃预变性5 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸2 min,共计30个循环;72 ℃延伸5 min,4 ℃保存。纯化回收PCR产物后,用Nde I和Xba I双酶切处理后回收酶切DNA片段,同时将表达质粒pColdII用相同方法酶切处理后回收纯化。利用T4 DNA连接酶连接处理过的DNA片段与载体片段,16 ℃连接过夜。将连接产物转化至Escherichia coli DH5α感受态细胞,挑取抗性单菌落进行菌落PCR验证,初步确定为阳性克隆子后,抽提质粒并测序,保存测序正确的重组表达质粒pColdII-gh489。
将重组表达质粒pColdII-gh489转化至Escherichia coli BL21(DE3)感受态细胞中,经PCR鉴定以及测序鉴定后,保存测序正确的菌种,将其命名为Escherichia coli BL21(DE3)/pColdII-gh489。
1.5 GH489重组蛋白在大肠杆菌中的诱导表达
将Escherichia coli BL21(DE3)/pColdII-gh489菌株接种至含100 μg/mL氨苄青霉素的LB培养基中,37 ℃ 220 r/min培养12 h后,以5%的接种量接种至含100 μg/mL氨苄青霉素的50 mL LB培养基中,37 ℃ 220 r/min培养至OD 600 nm为0.8时,加入IPTG至终浓度为0.5 mmol/L,16 ℃ 220 r/min诱导培养12 h。4 ℃ 8 000 r/min收集菌体,用20 mL裂解缓冲液洗涤菌体1次,4 ℃ 8 000 r/min离心5 min,再用20 mL裂解缓冲液将菌体重悬,超声波破碎后,4 ℃ 8 000 r/min离心30 min,收集上清液得到粗酶液,SDS-PAGE检测蛋白表达情况。
1.6 GH489重组蛋白的纯化
按照Ni-NTA 6FF预装重力柱(5 mL柱体积)说明书操作,进行GH489重组蛋白的纯化。放空预装重力柱中的储存液,加入2倍柱体积的裂解缓冲液平衡Ni-NTA介質。将收集的蛋白粗酶液利用0.22 μm过滤器过滤,随后转入重力柱中,控制流速0.5 mL/min;向重力柱加入2倍柱体积的洗涤缓冲液(咪唑浓度10 mmol/L),控制流速0.5 mL/min,洗去杂蛋白;用10 mL洗脱缓冲液洗脱带组氨酸标签的目的蛋白,以每管1.5~2.0 mL装液量分管收集流出液。利用SDS-PAGE对洗脱后的蛋白进行电泳检测。利用Thermo Scientific Slide-A-Lyzers?蛋白透析盒对重组蛋白GH489进行透析处理,将载有目的蛋白的透析盒放入PBS缓冲液中,每隔1 h更换新的PBS缓冲液,4 ℃透析8 h,收集透析后的蛋白溶液,即获得纯化的GH489重组蛋白。
1.7 GH489重组蛋白的杀螨活性测定
采用玻片浸渍法对纯化的GH489重组蛋白进行室内二斑叶螨的毒杀活性测定,具体操作如下:选取行动活泼、大小一致的成螨个体,将其背部通过双面胶黏附于载玻片的一端,生化培养箱中放置3 h后镜检剔除死亡、受伤与不活泼个体,保证每个玻片上活虫数大于30头。将上述带螨玻片的一端浸于药液(5~7个浓度梯度的GH489重组蛋白液或PBS缓冲液)内5 s,取出并用滤纸吸干残留药液。置于生化培养箱中,定时镜检观察试验结果。用毛笔轻触螨体观察其反应,以螨足不动为死亡标准,统计各处理组的成螨死亡情况。每个处理设置3个重复。以浸渍PBS缓冲液作为空白对照组,计算各组的死亡率、校正死亡率,公式如下:
M =a/b (1)
式中,M为死亡率,%;a为死亡虫数,头;b为供试总虫数,头。
Mcorrected =(Mtest-Mcontrol)/(1-Mcontrol) (2)
式中,Mcorrected为校正死亡率,%;Mtest为处理组死亡率,%;Mcontrol为对照组死亡率,%。
2 结果与分析
2.1 大肠杆菌表达质粒pColdII-gh489的构建
利用引物gh489-F和gh489-R克隆得到糖基水解酶gh489基因编码序列,琼脂糖凝胶电泳检测gh489基因的PCR产物,如图1a所示,1 500 bp处显示出特异条带,片段大小与预期相符(1 513 bp)。gh489片段双酶切回收产物与pColdII载体、T4 DNA连接酶连接、转化至Escherichia coli DH5α,抽提质粒并进行琼脂糖凝胶电泳检测,如图1b所示。重组质粒测序,目的片段区域没有发生突变,重组质粒pColdII-gh489构建完成。将重组质粒转化至Escherichia coli BL21(DE3),获得重组表达菌株Escherichia coli BL21(DE3)/pColdII-gh489。
2.2 GH489重组蛋白的表达与纯化
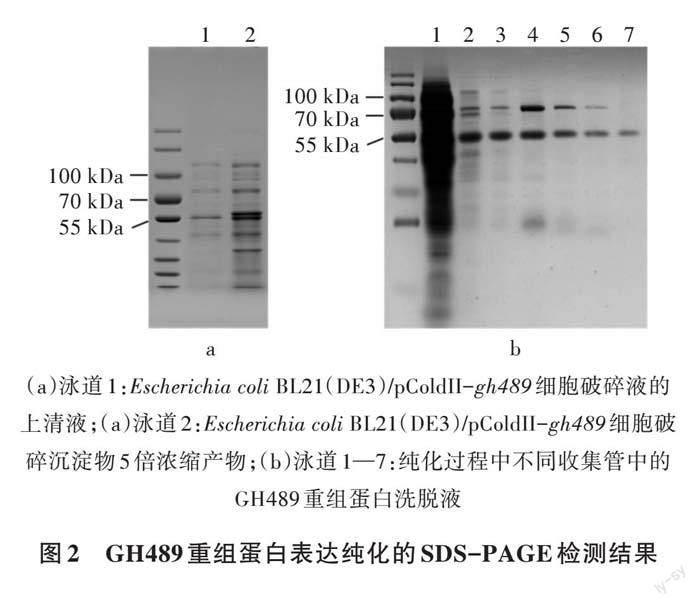
预测GH489重组蛋白的分子质量约为57 kDa,利用SDS-PAGE电泳检测工程菌株Escherichia coli BL21(DE3)/pColdII-gh489的IPTG诱导表达产物。结果表明,由大肠杆菌表达的GH489重组蛋白主要以可溶性形式存在于上清液中,在细胞破碎沉淀物中含一些杂蛋白(图2a)。纯化后的GH489重组蛋白的分子质量约为57 kDa,符合预测结果(图2b)。纯化后的GH489重组蛋白经考马斯亮蓝法分析,其浓度约为313 μg/mL。
2.3 GH489重组蛋白的杀螨活性
按照上述试验步骤,利用SPSS 26.0数据处理软件计算,纯化的GH489重组蛋白悬液对二斑叶螨24、48 h的灭螨活性结果见表2。处理24 h后,GH489重组蛋白杀虫概率模型方程为y=-3.811+2.573x(变量x使用底数为10的对数进行转换),Pearson模型拟合优度检验(x2=6.193,P=0.185)表明模型拟合良好,半致死浓度(LC50)为30.296 μg/mL。处理48 h后,GH489杀虫概率模型方程为y= -2.757 + 2.078x(变量x使用底数为10的对数进行转换),Pearson模型拟合优度检验(x2=2.222,P=0.695)表明模型拟合良好,半致死浓度(LC50)为21.212 μg/mL。结果表明,芽孢杆菌糖基水解酶GH489具有良好的杀螨活性。
3 小结与讨论
二斑叶螨是一种重要的世界性经济害螨,危害多种作物,具有成熟期短、繁殖率高和活动范围小等特点[7]。传统的杀螨剂主要为化学杀螨剂,如喹螨唑、唑螨酯、哒螨灵、吡螨胺、螺螨酯和拟除虫菊酯类杀螨剂,化学药剂的大量且重复、长期使用,不仅会杀死大量的害螨天敌和其他有益生物,同时也使二斑叶螨产生了严重的抗药性[8]。为了减少化学药剂带来的负面影响,从自然环境和天然产物中挖掘低毒、安全、环境友好型农药是目前新农药开发的一个重要策略[9]。植物源杀螨剂的发掘和应用逐渐成为国内外绿色农药领域的研究热点之一。很多植物精油及相关成分对螨虫和其他害虫具有广谱活性,被认为是潜在的植物保护剂,可用于田间害虫管理。植物源农药具有低毒、低残留等优点,对害虫最有效的精油通常具有植物毒性[10]。在试验条件下,球孢白僵菌和金龟子绿僵菌显示出对多种螨虫的致病性[11,12],被认为具有应用潜力。然而,由于批量生产困难,或在室外条件下对螨虫的感染效率低、持久效力差,大多数治螨微生物制剂未能实现商业化使用。因而人们仍然在不断探索和筛选新的治螨微生物资源。
鉴于芽孢杆菌属细菌能产生多种蛋白酶,本研究以芽孢杆菌糖基水解酶GH489为研究对象,探究其杀螨活性。研究表明,在室内条件下芽孢杆菌糖基水解酶GH489具有良好的杀螨活性,该结果将进一步丰富人们对于芽孢杆菌糖基水解酶功能的认识。后续需要进一步建立GH489重组蛋白的田间施用方案,實现该蛋白在农作物螨虫防治上的应用。
参考文献:
[1] SHRIVASTAVA S. Industrial applications of glycoside hydrolases[M]. Singapore:Springer, 2020.
[2] LINARES-PASTEN J, ANDERSSON M, KARLSSON E. Thermostable glycoside hydrolases in biorefinery technologies[J]. Current biotechnology, 2014, 3(1):26-44.
[3] FLEMING D, RUMBAUGH KP. Approaches to dispersing medical biofilms[J]. Microorganisms, 2017, 5(2): 5020015.
[4] FLEMING D, CHAHIN L, RUMBAUGH. Glycoside hydrolases degrade polymicrobial bacterial biofilms in wounds[J]. Antimicrobial agents & chemotherapy, 2017, 61(2):e01998-16.
[5] BOURNE Y, HENRISSAT B. Glycoside hydrolases and glycosyltransferases: Families and functional modules[J]. Current opinion in structural biology, 2001, 11(5):593-600.
[6] HENRISSAT B, DAVIES G. Structural and sequence-based classification of glycoside hydrolases[J]. Current opinion in structural biology, 1997, 7(5):637-644.
[7] 王 丹. 姜黄素对朱砂叶螨几丁质酶活性及基因表达的影响[D].重庆:西南大学, 2016.
[8] 蓝华国, 莫朝龙. 柑橘病虫害绿色防控技术[J]. 世界热带农业信息, 2021 (6): 66-68.
[9] 陳万浩. 二斑叶螨类酵母共生菌和蛛生真菌的分子鉴定及遗传多样性[D]. 贵阳:贵州大学, 2017.
[10] ISMAN MB. Plant essential oils for pest and disease management[J]. Crop protection, 2000, 19(8-10):603-608.
[11] SREENIVAS AG, RAMANUJAM BR, MOHANRAJ P, et al. Efficacy of entomopathogenic fungi against red spider mite Tetranychus neocalodonicus Zacher (Acarl: Tetranychidae)[J]. Karnataka journal of agricultural sciences, 2010, 18(4):192052.
[12] SANJAYA Y, OCAMPO V, CAOILI B. Entomopathogenic characterization of Beauveria bassiana fungi against Tetranychus kanzawai (Kishida) (Tetranychidae: Acarina) spider mite by its region[J]. Thai journal of pharmaceutical sciences,2014, 47:13-21.
