基于LI-RADS添加辅助MRI征象鉴别不典型肝细胞癌与肝内胆管细胞癌
2023-12-25张庆李云熊浩彭婕
张庆,李云,熊浩,彭婕
原发性肝癌在慢性肝病患者中的发病率较高且是其高死亡率的主要原因[1-3],常见病理类型包括肝细胞癌(hepatocellular carcinoma,HCC)和肿块型肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)。我国是HCC高发地区之一,大多数HCC患者都具有慢性乙型或丙型肝炎的病史。在ICC发病机制方面,目前多认为部分患者与病毒性肝炎有关。不典型HCC是指没有典型的“快进快出”影像学表现。由于不典型HCC与ICC的部分影像学表现重叠,且两者在临床上常常都存在肝硬化或病毒性肝炎等基础疾病,导致鉴别两种肿瘤有时非常困难。肝脏影像报告及数据系统(Liver Imaging Reporting And Data System,LI-RADS,又简称为LR)是为肝癌高风险患者的诊断而建立的[4],旨在提高影像检查在HCC高危人群中的诊断效能,并进一步规范影像的解释标准。其中的LR-M类是指没有典型HCC影像表现的肯定或可能的恶性肿瘤,绝大多数为不典型HCC或ICC[5-6]。钆塞酸二钠(gadolinium-ethoxybenzyl-diethylenetriaminepentaacetic acid,Gd-EOB-DTPA;商品名:普美显)是肝脏特异性对比剂,能够提高对肝癌的诊断效能。本研究旨在明确基于Gd-EOB-DTPA增强MRI鉴别LR-M类HCC和ICC时的可靠影像学特征。
材料与方法
1.临床资料
回顾性搜集2017年6月-2022年8月在本院行MRI检查怀疑肝脏恶性肿瘤患者的临床和影像资料。基于2018版LI-RADS筛选出LR-M类肝肿瘤患者,再根据病理结果及影像表现,筛选出其中不典型HCC和ICC患者。纳入标准:①经手术切除或穿刺活检病理证实为HCC或ICC;②在本院行Gd-EOB-DTPA增强MRI检查;③根据2018版LI-RADS适用标准:有肝硬化、慢性乙型肝炎病史,或既往有肝细胞癌病史;④根据2018版LI-RADS中的主要征象及辅助征象,确定肝内病灶属于LR-M类。排除标准:①MRI检查前有肝脏肿瘤手术史;②有其它部位肿瘤发生肝脏转移的病史;③图像质量较差不能用于评价。
2.MRI检查方法
使用Philips Intera Achieva TX 3.0T磁共振仪进行肝脏MRI检查。常规行横轴面T1WI和抑脂T2WI、矢状面和冠状面T2WI;采用梯度回波序列行横轴面DWI(b=50和800 s/mm2)扫描,扫描参数:TR 4.154 ms,TE 2.200 ms,矩阵154×192,层厚5.5 mm,层间距1.0 mm,视野260 mm×260 mm;采用三维容积内插屏气检查(three-dimensional volumetric interpolated breath-hold examination,3D-VIBE)序列行4期动态增强扫描:经肘静脉快速推注Gd-EOB-DTPA,剂量0.1 mL/kg,注射流率为1.0~1.5 mL/s,随后使用高压注射器注入20 mL生理盐水冲管,动脉期、门静脉期、延迟期和肝胆期(hepatobi-liary phase,HBP)的延迟时间分别为20~25 s、60~70 s、2.0 min和20.0 min。
3.图像分析
由一位中级和一位高级职称的腹部组诊断医师在不知晓最终病理结果的情况下独立进行影像学特征的分析。基于2018版LI-RADS中的诊断标准筛选LR-M类病灶,当存在分歧时,加入第三位高年资诊断医师共同协商确定。对于多发LR-M类病灶的患者,仅分析最大病灶。基于2018版LI-RADS中提出的HCC主要征象及特异性辅助征象,结合文献[7]及临床经验,本研究中加入以下HCC特异性辅助征象进行诊断:①形态:圆形/类圆形和分叶状;②瘤内分隔;③瘤周胆管扩张;④局部包膜凹陷;⑤HBP高信号范围(如果病灶内中央高信号区的最长径与最短径的平均值大于肿瘤半径,则定义为大范围;相反定义为小范围);⑥EOB云(ethoxybenzyl cloud)征。
4.统计学分析
使用SPSS 21.0和MedCalc 20.0.14软件进行统计学分析。采用多变量logistic回归分析筛选出LR-M类病灶中HCC的独立预测因素。在加入辅助影像学征象前,将单因素分析中P<0.05的变量纳入多因素logistic回归分析,建立诊断模型A,然后通过添加辅助影像学征象采用同样的方法来构建诊断模型B,筛选出可靠诊断HCC的独立预测因素。采用ROC曲线评价两种模型的诊断效能,并采用DeLong检验对两种模型的AUC进行比较。以P<0.05为差异有统计学意义。
结 果
1.两组患者临床资料的比较
基于2018版LI-RADS的诊断标准共筛选LR-M类肝内肿瘤患者110例(图1~3),其中HCC 42例,ICC 56例,70例经手术切除病理证实,28例经穿刺活检病理证实。两组患者临床资料的比较结果见表1。AFP升高、CA199升高和HBsAg(+)患者的比例在两组之间的差异具有统计学意义(P<0.05),两组之间年龄、性别、有无肝硬化、Child-Pugh分级和病灶长径的差异均无统计学意义(P>0.05)。
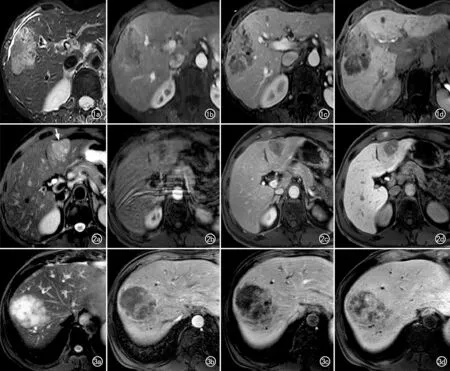
图1 男性患者,56岁,肝细胞癌LR-M类。a)横轴面T2WI示肝右叶病灶呈等~高信号肿块;b)Gd-EOB-DTPA增强动脉期图像,病灶周边呈环状高信号;c)门脉期示肿块内呈持续强化,包膜强化;d)肝胆期示病灶内大范围高信号和呈等~高信号的瘤内分隔。
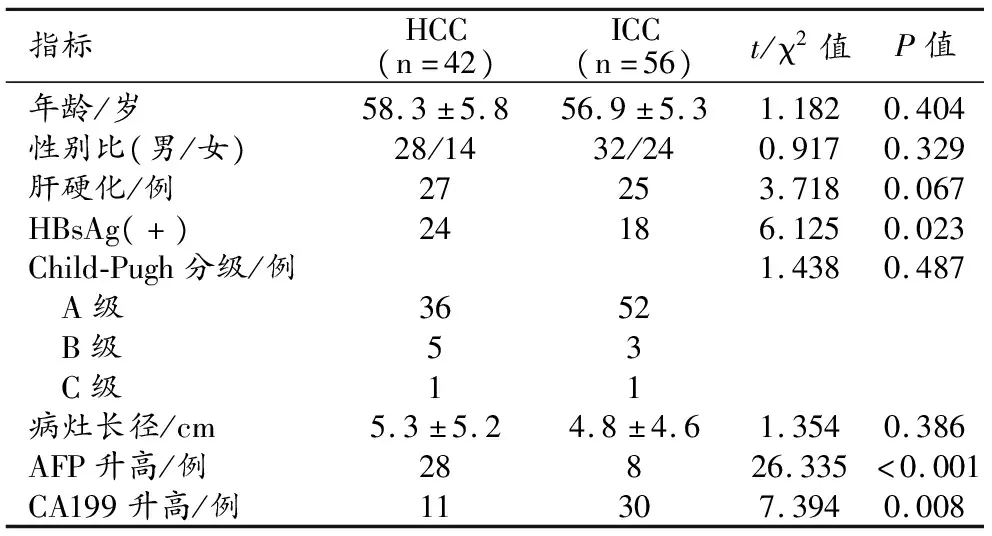
表1 两组患者临床资料的比较
2.两组间LI-RADS主要征象和LR-M类征象的比较
HCC组与ICC组之间各项LI-RADS主要征象及LR-M类影像特征的比较结果见表2。90%的LR-M类病变有靶样表现。在HCC组和ICC组中,动脉期环状高强化是最多见的影像特征,其次是延迟期中央强化和肝胆期靶征。
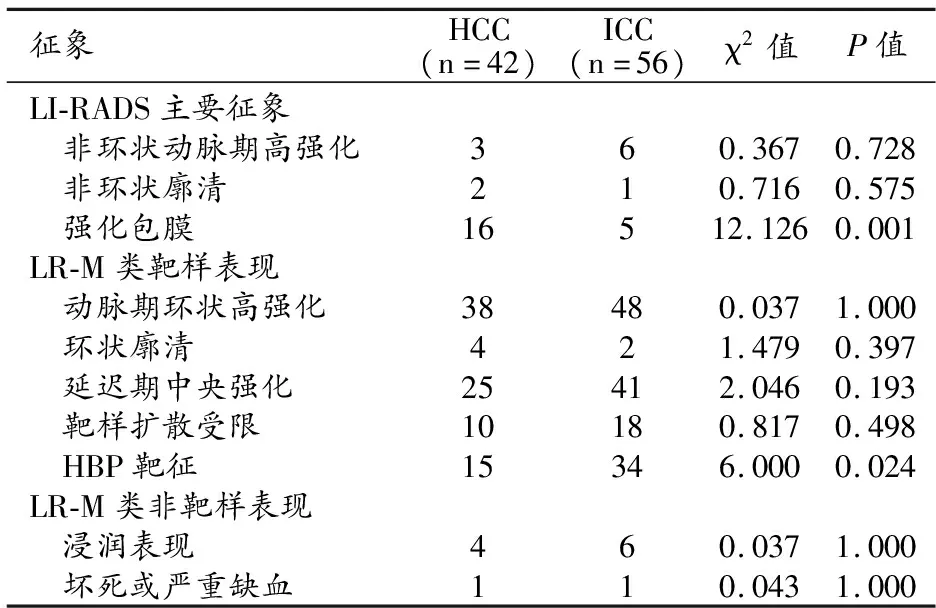
表2 两组之间LI-RADS主要征象和LR-M类征象的比较 /例
3.肿瘤的辅助征象
HCC组和ICC组之间所有辅助征象的比较结果见表3。两组之间马赛克征、脂质沉积、出血、病灶形状、瘤内分隔、瘤旁胆管扩张和EOB云征的出现率以及HBP高信号范围的差异均具有统计学意义(P<0.05)。
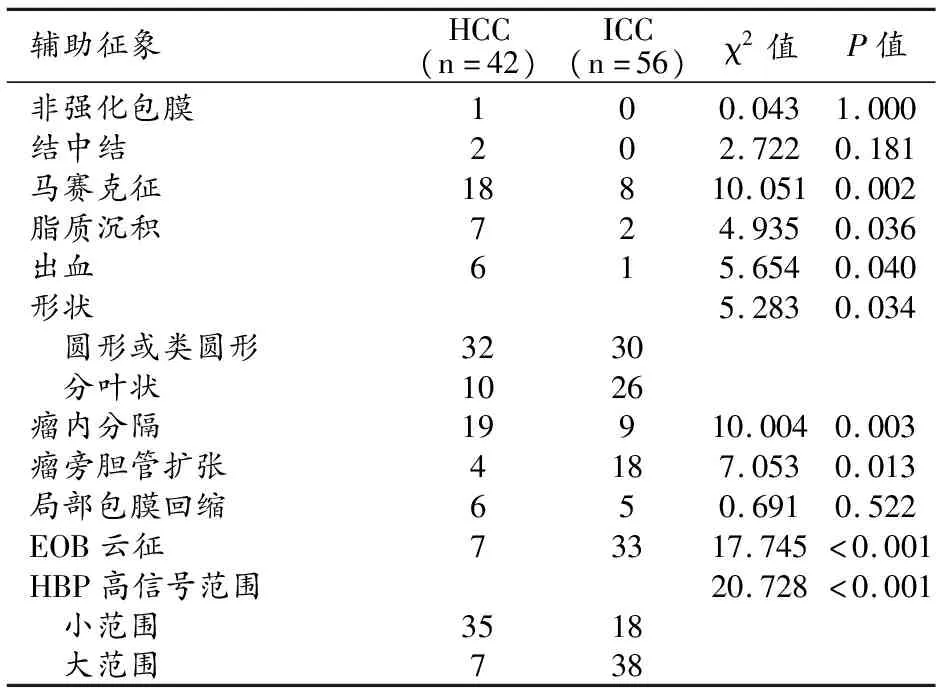
表3 两组之间2018版LI-RADS辅助征象的比较 /例
4.Logistic回归和诊断效能分析
将患者的临床资料、肿瘤LI-RADS主要征象和LR-M类影像特征纳入logistic回归分析建立诊断模型A,在此基础上加入组间差异有统计学意义的MRI辅助征象建立诊断模型B,模型A内纳入的HCC高危因素包括AFP升高和包膜强化,模型B纳入的HCC的高危因素包括AFP升高、包膜强化、瘤内分隔和HBP小范围高信号,logistic回归分析结果详见表4。
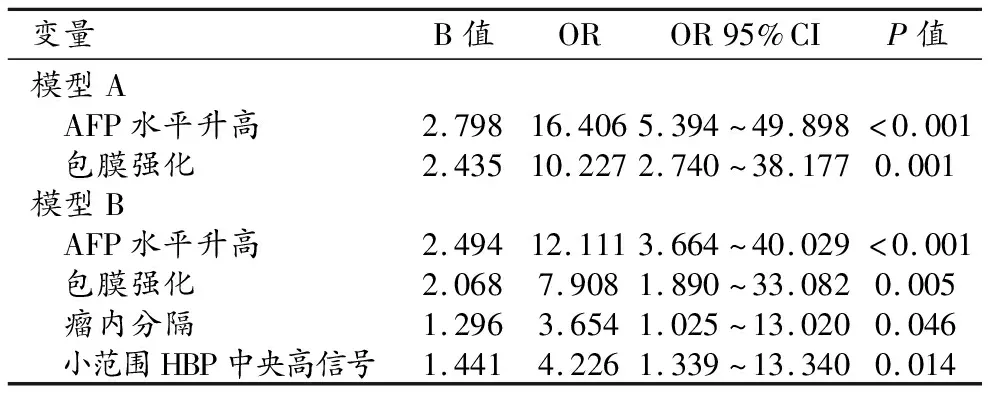
表4 Logistic回归分析筛选出的HCC独立预测因素
两个模型诊断HCC的ROC曲线见图4。模型A的AUC为0.839,敏感度为85.7%,特异度为78.6%;模型B的AUC为0.900,敏感度为76.2%,特异度为87.5%。DeLong检验结果显示模型B的AUC高于模型A且差异有统计学意义(P=0.009),表明模型B的诊断效能更高。
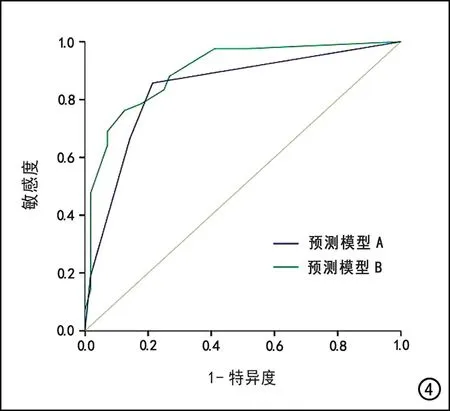
图4 模型A和模型B的ROC曲线,模型A的AUC为0.839,小于模型B的AUC(0.900)。
讨 论
LI-RADS是一个动态的、不断更新的系统,部分解决了HCC诊断标准化这一问题,但其在鉴别不典型HCC和非HCC恶性肿瘤方面仍存在一定的限度,基于此提出了LR-M类,保持了LR-5类的高特异性,同时不牺牲诊断所有肝脏恶性肿瘤的敏感性[8]。LI-RADS中影像特征包括主要征象和辅助征象,当HCC缺乏典型的影像表现时,辅助征象可以进一步提供有用的诊断信息,提高对HCC的诊断效能。本研究结果显示,包膜增强是不典型HCC最可靠的主要影像学特征,基于LI-RADS添加瘤内间隔、小范围HBP高信号等辅助特征可能提高对LR-M类中不典型HCC的诊断效能。
不典型HCC和ICC出现延迟强化与病灶内纤维间质有关,主要是由于肿瘤内纤维组织连接致密,同时纤维-纤维间隔较大,导致对比剂进入和排除缓慢,相应地在MRI增强图像上表现为延迟强化。HBP靶征和“EOB”云征在ICC中更多见,这与ICC的病理基础关系密切,肿瘤周围血管组织丰富,至肝胆期会释放对比剂,而中心部分通常由松散的结缔组织和丰富的细胞间基质组成,导致对比剂在细胞外间隙滞留和清除延迟,随着时间延迟,因此病灶中央“云雾状”强化逐渐明显[9-10]。不典型HCC和ICC病灶内都有一定量的纤维组织,但HCC的纤维组织较ICC更少[11],因此增强扫描时ICC病灶内可见相对较大范围HBP高信号,而不典型HCC的高信号范围较小。ICC更常见分叶状和瘤周胆管扩张,与ICC起源于胆管的导管上皮有关。HCC为富血供恶性肿瘤,肿瘤生长较快,且我们的样本中肿瘤形态较大,病灶中心常常供氧不足,会发生囊变、坏死、脂肪变性及出血等,所以HCC更常见马赛克征、脂质沉积及出血等特征[12]。
Gd-EOB-DTPA作为一种肝脏特异性对比剂[13-14],可被正常的肝细胞摄取,经胆道和肾脏排泄,较长的HBP等待时间更有利于肿瘤纤维组织的显示。我们的研究结果显示,在模型A中包膜强化是诊断不典型HCC的可靠影像特征。在加入辅助征象的模型B中,包膜强化、瘤内间隔或小范围HBP高信号是预测不典型HCC的可靠征象,与之前的研究结果一致[7,15]。强化包膜是与肿瘤的膨胀性生长有关[9]。纤维间隔与HCC肿瘤组织压缩和细胞分化异质性导致纤维成分在不同生长活性的癌组织间凝结有关[16]。HBP高信号是基于不典型HCC含有较为丰富的纤维成分和肿瘤的分化程度有关[11,17,18]。同时我们的研究结果显示模型B显著提高了对HCC的诊断效能及特异度,因此我们认为,瘤内间隔和小范围HBP可作为诊断HCC的辅助特征,进一步提高LI-RADS的特异度及诊断价值,相信关于LI-RADS的相关研究将会推动其不断完善,提高影像医师在肝癌多学科合作中的价值,更好地服务于临床。
本研究存在以下几点局限性:首先,作为一项回顾性研究,选择偏倚不可避免;第二,部分病例的病理结果是通过活检而不是手术标本获得的,不可避免地存在采样误差的可能性;第三,本研究结果的适用性有限,只针对有肝炎病毒感染或肝硬化的患者;第四,本单中心研究的样本量偏少,需要多中心更大样本的研究去证实。
综上所述,包膜强化是诊断不典型HCC的可靠影像学特征,基于LI-RADS系统增添辅助征象能够提高对不典型HCC与ICC的鉴别诊断价值。
