基于3.0T MR增强影像构建鉴别结直肠癌周围癌结节与转移性淋巴结的预测模型
2023-12-25周之怀王龙胜刘三春张玉朱越
周之怀,王龙胜,刘三春,张玉,朱越
结直肠癌周围肿瘤沉积(tumor deposits,TD)指原发肿瘤邻近部位的脂肪或系膜内出现的无淋巴、血管及神经组织结构的结节,且与原发病灶不相连。美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版结直肠癌TNM分期中将无区域淋巴结转移的结直肠癌伴有TD归为N1c期[1]。TD在结直肠癌患者中发生率较高,尤其在临床Ⅲ期以上患者中,结直肠癌TD阳性患者的总生存率和无病生存率明显低于阴性患者,TD是影响结直肠癌术后复发和预后的独立危险因素[2-4]。TD阳性比发生淋巴结转移的结直肠癌患者的预后更差[5]。在相同淋巴结分期的结直肠癌中,发生TD的结直肠癌具有更高的侵袭性及更差的预后[6-7]。因此,对TD阳性患者需要积极治疗和密切随访。本研究通过分析结直肠癌周围TD与转移淋巴结(metastatic lymph nodes,MLN)的相关MRI表现并建立预测模型,旨在提高对二者的鉴别诊断能力,从而指导临床制订个体化的有效治疗方案。
材料与方法
1.临床资料
连续搜集2020年1月-2023年1月本院收治的106例结直肠癌伴有灶周结节患者的病例资料。纳入标准:①原发病灶及灶周结节均经手术病理确诊,术前MRI对结节位置、形态及大小具体分析,术中将原发肿瘤连同周围的脂肪、系膜及结节一起切除,标本切除后根据MRI图像对结节进行分组标记,确保获得的病理结果与MRI图像上显示的结节是对应的;②术前一周内行MRI增强及DWI检查,且图像质量达到诊断要求;③结节与原发肿瘤的距离≤5.0 cm[8],且结节短径≥7 mm,避免过小造成测量误差;④临床资料完整,应该包括血清肿瘤标志物(CEA、CA19-9和CA50)检测结果,肿瘤的部位、分化程度和周围脉管和神经侵犯情况,以及灶周结节的数目和病理类型等。排除标准:①MRI图像上的结节与切除标本无法完全对应;②术前行化疗或放疗等抗肿瘤治疗;③合并其它部位的原发恶性肿瘤;④因肠蠕动伪影或肠内容物影响较重等原因,MRI图像质量不佳。
106例中,男61例,女45例;年龄43~77岁,平均(60.8±10.7)岁。22例TD患者,共发现28个TD和32个MLN;84例仅发现邻近区域淋巴结转移,共计150个MLN。
2.MRI检查方法
使用GE Discovery 750w 3.0T超导MR扫描仪、腹部专用线圈和呼吸门控技术,扫描前对患者进行有效地呼吸训练,主要扫描序列和参数如下。①T1WI:TR 360~510 ms,TE 8.2~14.8 ms;②呼吸触发脂肪抑制FSE序列横轴面T2WI:TR 5200 ms,TE 81~90 ms;③单次激发SE-EPI DWI:b=1000 s/mm2,TR 4800 ms,TE 81 ms;④FRFSE T2WI:TR 3000 ms,TE 103 ms,层厚4 mm、层间距1 mm、视野38 cm×38 cm、矩阵288×224(横轴面)或层厚3 mm、层间距1 mm、视野37 cm×37 cm、矩阵224×224(冠状面)。
增强扫描使用对比剂Gd-DTPA,剂量0.1 mmol/kg,流率3.0 mL/s,分别行横断面、矢状面和冠状面扫描,扫描序列为肝脏快速容积成像(liver acceleration vo-lume acquisition,LAVA ),扫描参数:TR 4.5 ms,TE 1.7 ms,层厚4 mm、层距2 mm(横轴面)或层厚5 mm、层距2 mm(冠状面、矢状面),视野38 cm×38 cm,矩阵288×220。
3.图像分析
主要观察原发肿瘤的部位、周围结节的数目、形态、短径、在ADC图上的信号特点、强化方式及强化率特点。结节数目依据AJCC区域淋巴结转移分期分为1枚(N1a期)、2~3枚(N1b期)及>3枚(N2期);结节形态分为光整和不光整(分叶或毛糙);结节强化方式主要包括均匀强化、环形强化及不均匀强化。
图像数据分析:在GE PACS系统中分别于增强前、后横轴面LAVA图像及ADC图上在结节内勾画ROI,应避开液化坏死部分,ROI大小15~20 mm2,分别测量结节在增强前、后的信号强度和ADC值,计算结节强化率:(增强后信号强度-增强前信号强度)/增强前信号强度×100%。每个结节各项指标需分别测量3次,取3次的平均值作为最终结果。
4.统计学方法
使用SPSS 20.0 统计学软件对数据进行统计分析。呈正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;分类变量采用χ2检验或Fisher精确检验,等级变量采用Wilcoxon符号秩和检验。对组间差异有统计学意义(P<0.05)的变量进行二元logistic回归分析,确定鉴别结直肠癌周围TD与MLN的独立影响因素并建立预测模型,采用ROC曲线分析独立影响因素和预测模型的鉴别诊断效能。以P<0.05表示差异具有统计学意义。
结 果
1.临床资料的比较
TD组和MLN组临床和病理资料的比较结果见表1。患者性别和年龄、CA19-9和CA50水平、肿瘤发生部位、分化程度及周围脉管和神经侵犯情况的差异均无统计学意义(P>0.05),而肿瘤周围结节的数目及CEA水平的差异具有统计学意义(P<0.05)。

表1 TD组和MLN组临床和病理资料的比较
2.灶周结节MRI特征的比较
两种类型灶周结节的MRI征象的比较详见表2和图1~2。两组之间结节强化方式的差异无统计学意义(P>0.05),而结节形态、短径、ADC值及强化率的差异均具有统计学意义(P<0.05)。
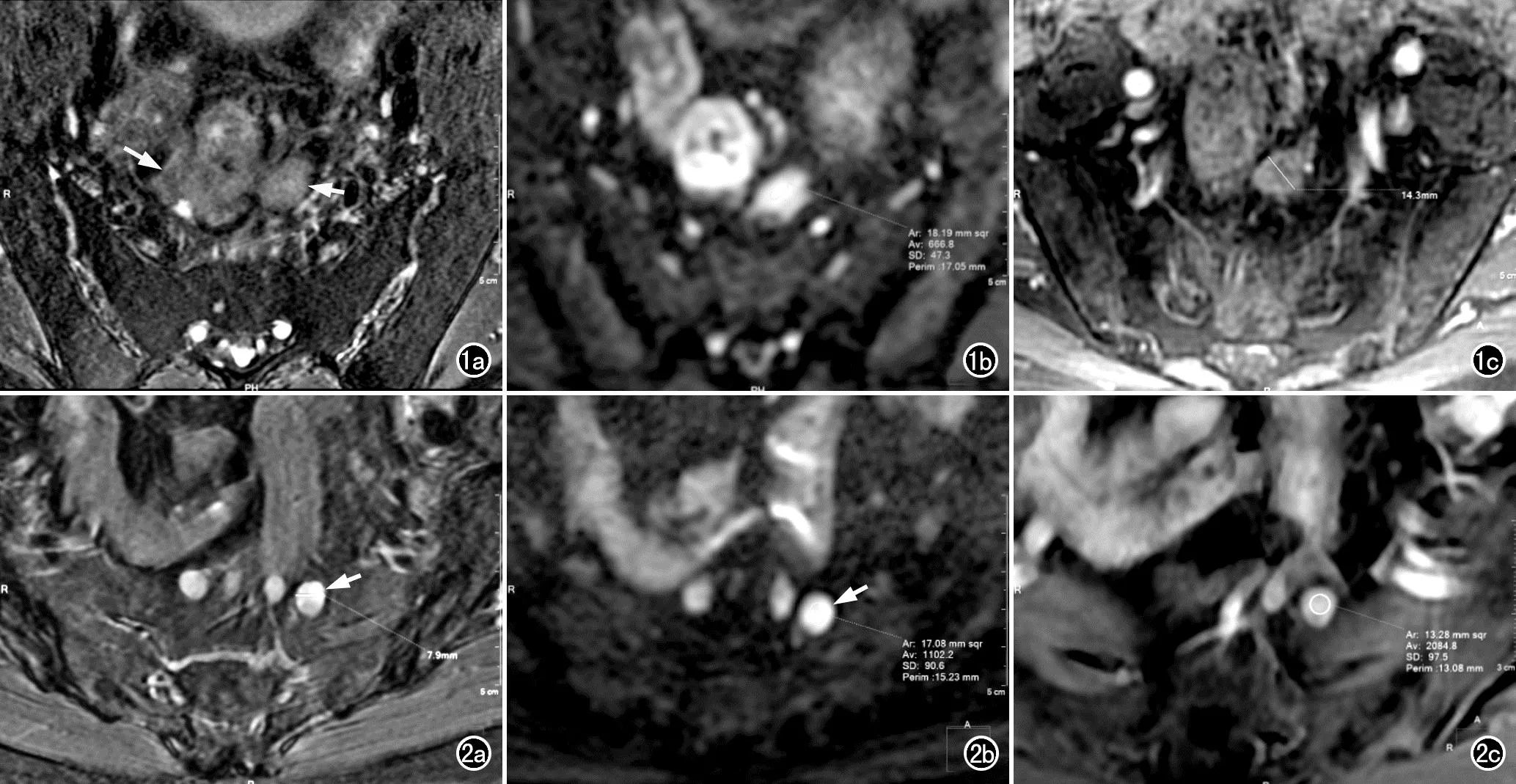
图1 男性患者,71岁,直乙状结肠交界段癌周围TD。a)压脂横轴面T2WI示直乙状结肠交界段肠壁不规则肿块(长箭),左侧邻近区域可见类圆形小结节(短箭),病理证实为TD;b)横轴面DWI示TD形态不规则,周边可见毛刺,ADC值约为0.73×10-3mm2/s;c)横轴面增强扫描示结节呈轻度强化,强化率为61.3%,短径约为14.3mm。
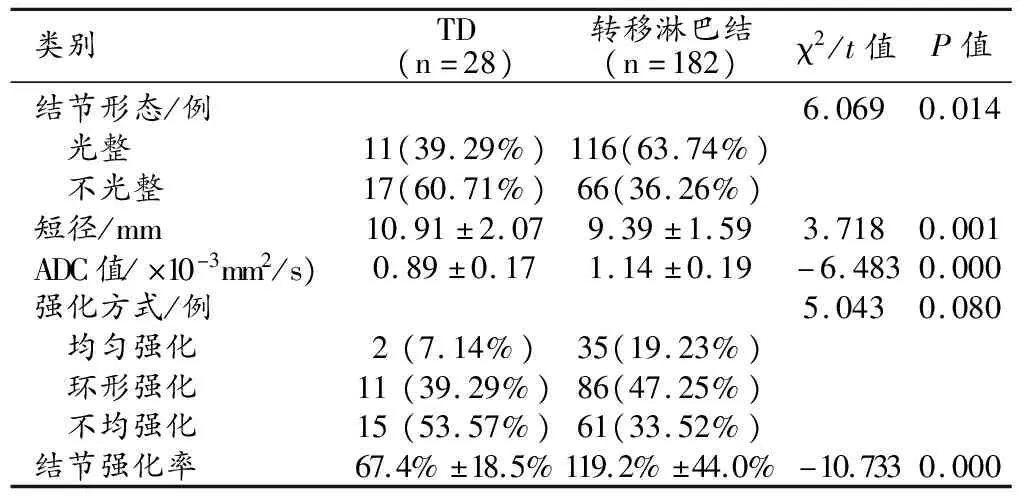
表2 结直肠癌周围TD与转移淋巴结MRI特征比较
3.诊断效能的评估
将组间差异有统计学意义的四个MRI特征纳入二元logistic回归分析,结果显示结节强化率和短径是预测TD的独立影响因素(P<0.05),详见表3。

表3 结节MRI特征二元logistic回归分析结果
ROC曲线分析结果:当结节强化率<75.0%时,诊断TD的AUC、敏感度和特异度分别为0.869、83.2%和80.1%(图3);当结节短径>10.45 mm时,诊断TD的AUC、敏感度和特异度分别为0.719、67.7%、73.6%(图4)。
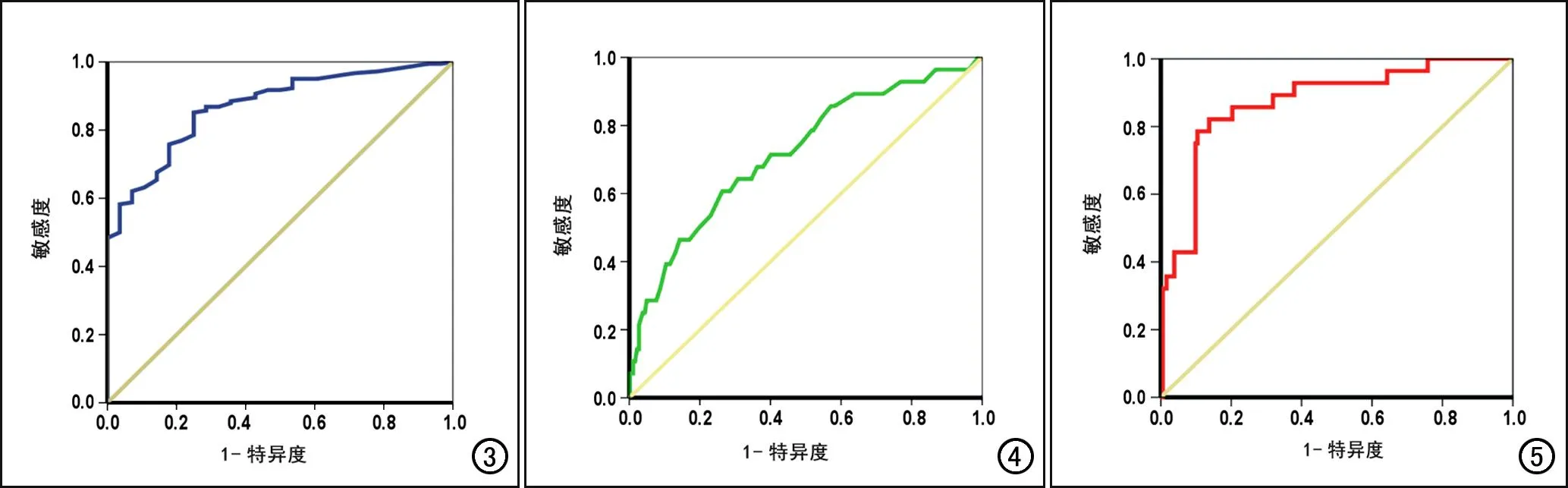
图3 结节强化率鉴别结直肠癌周围TD与MLN的ROC曲线图,AUC=0.869。
二元logistic回归建立的预测模型的AUC为0.872(图5),高于单项指标(结节强化率和短径);当截断值为0.583时,预测模型对结直肠癌周围TD与MLN的鉴别诊断效能较好,其诊断符合率、敏感度和特异度分别是89.7%、84.6%和73.5%。
讨 论
结直肠癌是临床上比较常见的消化道恶性肿瘤,具有较高的死亡率[9],国内外文献报道临床Ⅲ期结直肠癌患者TD阳性率≥26%[10-11]。本研究中纳入的106例结直肠癌患者中,发现周围TD者占比为20.8%(22/106)。Wang等[12]认为出现1个TD结节的权重等同于2枚MLN,据此进行预后评估时的准确性要优于AJCC第8版TNM分期。TD阳性结直肠癌患者需要积极化疗以控制局部复发,减少肿瘤细胞的远处播散,从而提高患者的生存率,使患者受益[13]。TD的发生与结直肠癌KRAS基因突变具有高度相关性,术前TD的诊断可辅助临床医师选择针对性的靶向治疗[14-15];此外,对于术前预测TD阳性的患者,可指导外科医师在手术中对TD周围脂肪组织应完整切除[15]。
临床资料中,结直肠癌周围TD组与MLN组患者在性别、年龄、肿瘤发生部位及血清肿瘤标记物(CA19-9和CA50)水平的差异均无统计学意义(P>0.05),与国内外许多文献报道的结果类似[14,16-17]。秦琼等[11]的研究结果显示右半结肠癌较左半结肠癌更容易发生周围TD,但也有部分研究中发现左半结肠癌和直肠癌发生TD的风险较高[2,13]。本组资料中,直乙状结肠交界、直肠及乙状结肠原发肿瘤发生TD的比例高于其它部位。国外许多文献报道TD阳性结直肠癌的肿瘤分化较差,侵犯邻近血管和神经的风险较高[3,18],本研究中,TD组肿瘤分化程度较低,侵犯邻近血管和神经的概率要高于MLN组,但两组差异无统计学意义(P>0.05),可能与TD组病例数偏少有关,有待于今后增大样本量进一步研究证实。杨彦松等[19]报道血清肿瘤标记物CEA升高是直肠癌淋巴结转移和/或发生TD的独立预测因素,Chen等[13]研究指出CEA水平异常升高的结直肠癌患者发生TD的风险较高且预后较差。本研究中与MLN组比较,TD组中血清CEA水平增高患者的占比更大,且结直肠肿瘤周围结节的数目更多,组间差异均有统计学意义(P<0.05)。22例TD阳性患者中,20例(90.91%)周围还伴有淋巴结转移,2例(9.09%)只有TD存在,22例患者共计28个TD,具体为17例1个TD,4例2个TD,1例3个TD。Bai等[2]研究指出随着TD数目增多,结直肠癌患者的预后越差。
AJCC第5版结直肠癌TNM分期中以结节直径来界定TD与MLN,岳思宇等[20]研究指出TD阳性组淋巴结的长径、短径和面积均大于TD阴性组。本研究中,TD组的短径大于MLN组,且差异具有统计学意义(P=0.001);ROC曲线分析结果显示结节短径>10.45 mm是预测TD的独立影响因素,其敏感度和特异度分别为67.7%和73.6%,有文献报道随着TD直径增大,结直肠癌患者的预后会更差,生存率更低[21]。AJCC第6版中强调结节形态和轮廓是区分TD与MLN的重要因素,罗锦文等[22]报道TD外形多较大且不规则,因TD内肿瘤细胞向各个方向生长不一致而出现分叶状形态及边缘毛糙或毛刺征。本组资料中,TD组中形态不规则结节的占比明显高于MLN组(60.71% vs.36.26%)。Luo等[23]研究指出结直肠癌周围孤立TD对于患者预后的影响与周围神经浸润相当,结直肠癌德尔菲共识建议将起源于壁外静脉、周围神经和淋巴结浸润的肿瘤结节都归为TD[24]。本研究中,TD组平均ADC值小于MLN组,差异具有统计学意义(P<0.001)。有研究中发现在CT平扫图像上TD的密度高于MLN,但强化率要低于MLN[8,22]。岳思宇等[20]的研究中利用双能CT术前预测结直肠癌周围TD,结果显示TD阳性组结直肠癌患者淋巴结碘浓度、标准化碘浓度及能谱曲线斜率均小于TD阴性组,证实了TD内部相对乏血供,也印证了AJCC第8版中明确定义TD内无淋巴、血管及神经组织结构。本研究中二元logistic回归分析结果显示结节强化率也是预测TD的的独立影响因素(P<0.05);当结节强化率<75.0%,其敏感度和特异度分别为83.2%和80.1%。以结节的强化率和短径这2项MRI特征构建联合预测模型,其效能高于单一指标,当其截断值为0.583时,诊断符合率、敏感度和特异度分别为89.7%、84.6%和73.5%。
综上所述,TD阳性的结直肠癌患者常合并有淋巴结转移、血清肿瘤标记物CEA水平异常增高结合MRI特征(结节强化率<75.0%和短径>10.45 mm)有利于TD的诊断,所构建的影像预测模型的准确性、敏感性和特异性均较高,有助于结直肠癌周围TD与MLN的鉴别,值得临床推广应用。
