锥光束乳腺增强CT影像特征与乳腺癌激素受体及HER-2表达状态的相关性
2023-12-25代婷杨鸿羽赵青苏桐王锐吕发金欧阳祖彬
代婷,杨鸿羽,赵青,苏桐,王锐,吕发金,欧阳祖彬
乳腺癌是发病率最高的恶性肿瘤[1]。目前乳腺癌的治疗方式多种多样,包括内分泌治疗、抗HER-2靶向治疗、化疗以及手术治疗等。临床上乳腺癌的治疗决策及预后等与其雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(HER-2)和Ki-67等基因的表达状态密切相关[2],治疗前明确乳腺癌的分子分型至关重要。
目前病理学检查仍然是判定乳腺癌免疫组化结果的金标准,但近几年来的多项研究结果表明,影像学手段在无创性预测乳腺癌的ER、PR、HER-2和Ki-67表达状态及分子分型方面具有较大潜力[3-11]。既往大多数研究聚焦于乳腺MRI检查[4-6]以及全视野数字化乳腺摄影(full-field digital mammography,FFDM)[7-9],但FFDM图像为重叠影像且不能观察乳腺癌的血流动力学特征,而乳腺MRI在评估对乳腺癌诊断具有重要价值的微小钙化方面存在局限性[12]。
锥光束乳腺增强CT(cone beam breast computed tomography,CBBCT)弥补了上述缺陷。CBBCT是基于锥形束 X 射线的一种乳腺专用、具有各向同性的高分辨率CT成像技术,静脉注射对比剂后能在三维基础上显示肿瘤血管及病灶的强化特点,具有无组织挤压、提供三维视角和快速完成扫描(10 s)等优点。目前关于CBBCT影像学特征与乳腺癌ER、PR、HER-2和Ki-67表达状态相关性的文献报道较少。本研究旨在分析CBBCT影像特征与乳腺癌激素受体(ER、PR)和HER-2表达状态的相关性,评价CBBCT影像特征在预测激素受体阳性及HER-2阳性乳腺癌中的效能,挖掘CBBCT在指导乳腺癌个体化治疗方面的临床应用价值。
材料与方法
本研究通过了本院伦理委员会的批准(2022-K313),免除受试者知情同意。
1.研究对象
回顾性搜集2019年1月-2022年6月在本院接受锥光束乳腺增强CT检查的患者资料。纳入标准:①病理确诊为乳腺癌;②免疫组化相关检查资料(ER、PR及HER-2)完整。排除标准:①扫描前接受过乳腺癌相关治疗或穿刺活检;②受检乳房内病灶显示不全;③仅表现为非肿块样强化;④图像质量不符合放射科质量控制标准。
2.CT检查方法
使用科宁公司KBCT-1000锥光束乳腺CT机进行双侧乳房扫描。扫描参数:管电压为49 kVp;管电流由机器根据待检乳房大小及密度自动调整,范围为50~100 mA。受检者取俯卧位,乳房自然悬垂于检查孔洞内。依次行健侧、患侧乳房平扫及患侧、健侧乳房增强扫描。患侧乳房平扫后注入对比剂并使用生理盐水冲管,对比剂采用碘浓度为320或370 mg/mL的碘佛醇,注射剂量为1.2~1.5 mL/kg,生理盐水用量为对比剂用量的1/3,注射流率均为3.0 mL/s;对比剂注射后120 s后依次采集患侧及健侧的乳房增强图像,单次扫描时间为10 s,最终获得两侧乳房平扫及增强扫描图像。
3.数据后处理及影像分析
参考美国放射学会发布的乳腺影像报告和数据系统(BI-RADS)2013版图谱(包括乳腺X线摄影及乳腺MRI两部分)来判定病灶的影像学特征:①肿块形状(圆/卵圆形;不规则形);②毛刺(边缘有以肿块为中心的放射状细线);③可疑恶性钙化(包括非弥漫分布的无定形钙化、粗糙不均质钙化、细小多形性钙化、细线样或细小分支状钙化);④肿块内部强化特征(均匀;不均质;环形);⑤非肿块样强化(non-mass enhancement,NME);⑥子灶(肿瘤主体病灶之外的转移病灶);⑦皮肤回缩;⑧乳头回缩。以上病灶特征由两名医师分别进行双盲法阅片,意见不同需协商达成一致。阅片的同时测量肿块大小以及肿块强化程度(ΔCT)。肿块大小的测量方法:在横轴面、冠状面及矢状面图像上分别测量病灶最长径,取其中的最大值(图1);ΔHU的测量则是选取肿块内强化最明显的区域(图2),计算公式:

图1 肿块大小测量方法示意图。a)横轴面CBBCT图像,肿块最长径为23.4 mm;b)冠状面图像,肿块最长径为19.7 mm;c)矢状面图像,最长径为23.2 mm。此例患者取3个平面图像上测量的病灶最长径的最大值即23.4 mm作为肿块大小。
ΔCT=(CT病灶增强后-CT脂肪增强后)-(CT病灶增强前-CT脂肪增强前)[13]
(1)
两个指标均取两位医师测量数据的平均值。
4.乳腺癌病理检查
HER-2受体表达状态采用免疫组化及原位杂交法(fluorescence in situ hybridization,FISH)进行检测。免疫组化结果的判定:3+判定为阳性;1+则判定为阴性;2+时则需进一步进行FISH检测,检测结果为基因扩增则判定为HER-2阳性,反之为阴性[14]。参照美国临床肿瘤学会(ASCO)/美国病理学家学院(CAP)指南[15],ER及PR阳性的标准为整张切片中细胞核呈现不同程度着色的肿瘤细胞占所有肿瘤细胞比例≥1%,ER或PR≥1%为激素受体表达阳性,激素受体表达阴性的标准为ER及PR均为阴性。
5.统计分析
使用SPSS 26.0统计学软件及R 4.2.0进行数据分析。符合正态分布的计量资料使用均数±标准差描述,采用独立样本t检验明确连续变量在乳腺癌激素受体和HER-2的阳性组和阴性组之间差异;不符合正态分布的计量资料使用中位数(四分位间距)表示,使用曼-惠特尼U检验进行组间比较。分类变量使用频数(构成比)表达,并采用卡方检验或Fisher精确检验分析分类变量在激素受体阳性组与阴性组、HER-2阳性组与阴性组之间的差异。进一步使用二元logistic回归分析分别建立预测激素受体阳性和HER-2阳性乳腺癌的诊断模型,并利用列线图将其可视化,同时采用ROC曲线、校正曲线及决策曲线分析(decision curve analysis,DCA)进行列线图验证,评估其预测效能。以P<0.05为差异有统计学意义。
结 果
1.一般资料
共将136例患者纳入本研究,患者均为女性,年龄26~82岁,平均(52.03±10.47)岁。其中,激素受体阳性组82例(60.3%),激素受体阴性组54例(39.7%),两组患者的年龄分别为(51.63±11.64)和(52.63±8.47)岁,差异无统计学意义(t=-0.541,P=0.589);HER-2阳性组47例(34.6%),HER-2阴性组89例(65.4%),患者的年龄分别为(53.43±9.55)和(51.29±10.91)岁,差异无统计学意义(t=1.131,P=0.260)。
使用碘浓度为320 mg/mL(86例)或370 mg/mL的碘佛醇(50例)进行乳房增强CT扫描,激素受体阳性组与阴性组以及HER-2阳性组与阴性组中使用2种浓度对比剂时肿块强化程度的比较结果详见表1。激素受体阳性组与阴性组以及HER-2阴性组中使用较高碘浓度(370 mg/mL)碘佛醇时,病灶强化程度均略高于(320 mg/mL)碘佛醇组,而HER-2阳性组则略低,但差异均无统计学意义(P>0.05),表明肿块强化程度基本不受对比剂浓度的影响。
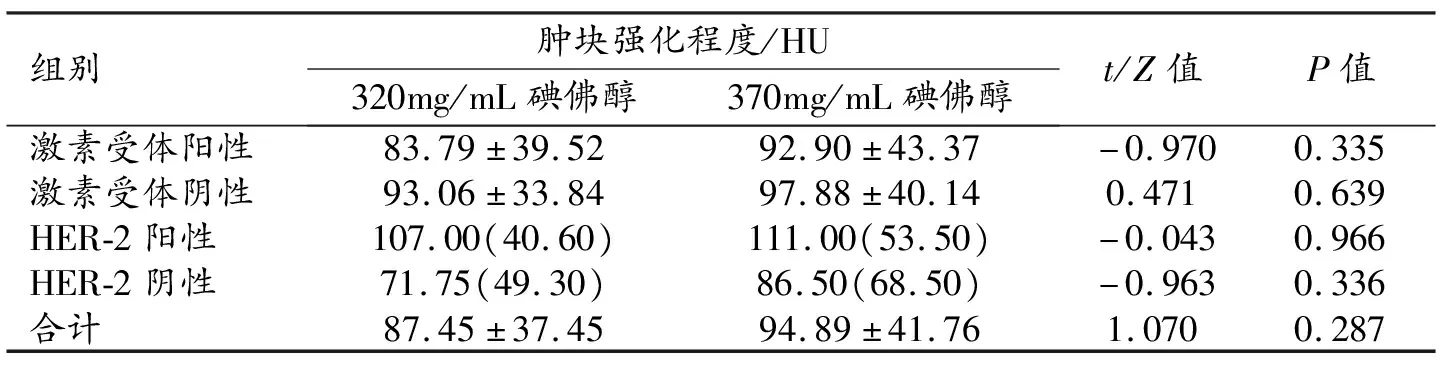
表1 不同浓度对比剂时肿块强化程度的比较
2.乳腺癌肿块大小及强化程度
四组中肿块大小和强化程度的对比见图3~4。
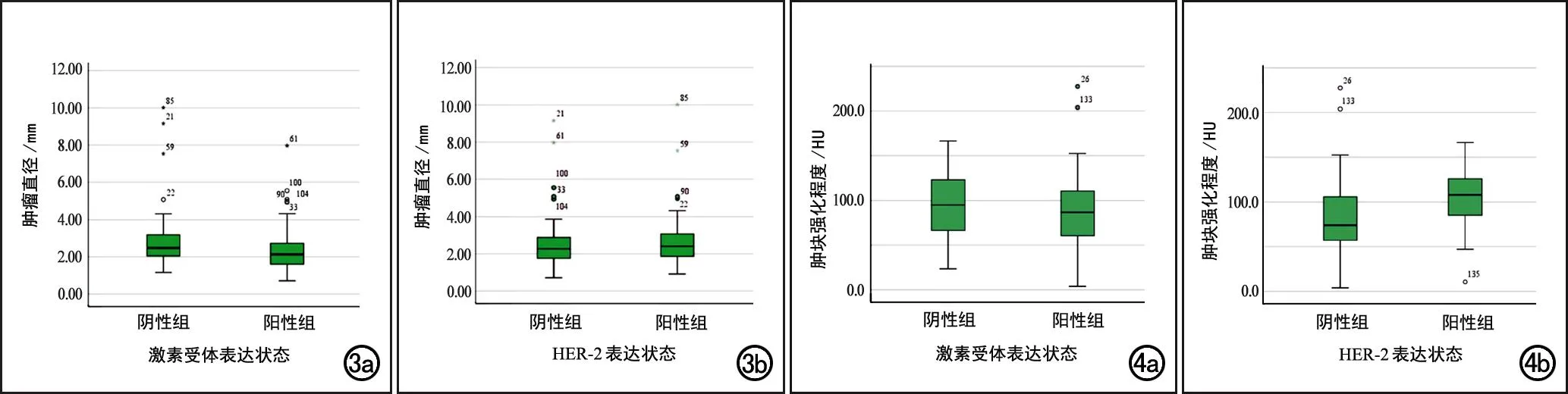
图3 肿块大小箱形图。a)激素受体阳性组及阴性组肿块大小的对比;b)HER-2阳性组及阴性组肿块大小的对比。
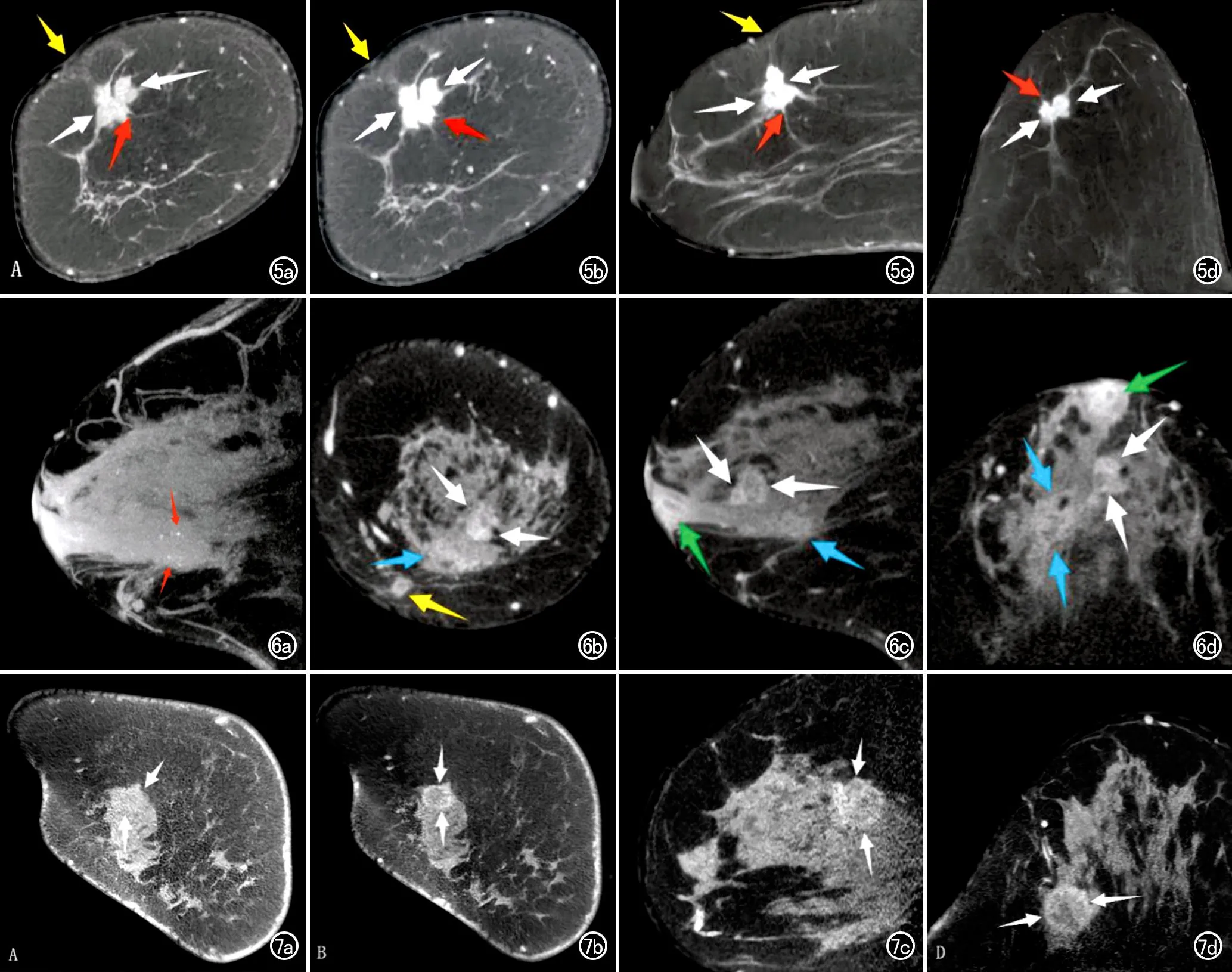
图5 激素受体阳性(ER 95%,PR 70%)、HER-2阴性右乳浸润性乳腺癌CBBCT图像。a)平扫冠状面图像示右乳外上象限内不规则等密度肿块(白箭),边缘可见毛刺(红箭);b~d)分别为冠状面、矢状面和横轴面增强扫描图像,示肿块呈均匀强化,邻近皮肤回缩(黄箭)。
激素受体阳性组和阴性组中肿块大小分别为21.28(11.55)和24.68(11.70) mm,两组间差异有统计学(Z=-2.698,P=0.007)。HER-2阳性组和阴性组中肿块大小分别为24.05(12.75)和22.70(11.77) mm,两组间差异无统计学意义(Z=-0.810,P=0.418)。
激素受体阳性组和阴性组的肿块强化程度分别为(87.12±40.94)和(94.84±36.00) HU,两组间差异无统计学意义(t=1.128,P=0.261)。HER-2阳性组及阴性组的肿块强化程度分别为108.00(43.50)及74.00(52.30) HU,组间差异有统计学意义(Z=-3.576,P<0.001)。
3.乳腺癌CBBCT特征的差异
激素受体阳性组与阴性组之间以及HER-2阳性组与阴性组之间乳腺癌CBBCT特征的比较结果详见表2。激素受体阳性乳腺癌表现为圆/卵圆形肿块、毛刺及皮肤回缩征象的出现率均高于阴性组,差异均有统计学意义(P>0.05)。HER-2阳性组中非肿块样强化、子灶、乳头回缩及可疑恶性钙化的出现率均高于阴性组,组间差异均有统计学意义(P<0.05)。

表2 乳腺癌不同分子分型阳性组与阴性组之间CBBCT特征的比较 /例
4.激素受体阳性及HER-2阳性乳腺癌预测模型及验证
二元logistic回归分析显示肿块的大小、形状、毛刺征以及皮肤回缩征是激素受体阳性乳腺癌的独立预测因素(表3);由这4个征象构建激素受体阳性乳腺癌预测模型,相应的列线图如图8a所示,其ROC曲线、校准曲线及DCA曲线如图9所示。预测模型的AUC为0.788(95%CI:0.711~0.865),敏感度为68.3%,特异度为85.2%;DCA曲线显示阈值概率在33%~96%时使用该模型预测激素受体阳性乳腺癌的净收益更高;校准曲线结果表明列线图预测结果与病理结果之间具有较好的一致性。

图8 乳腺癌预测模型的列线图。a)激素受体阳性乳腺癌;b)HER-2阳性乳腺癌。
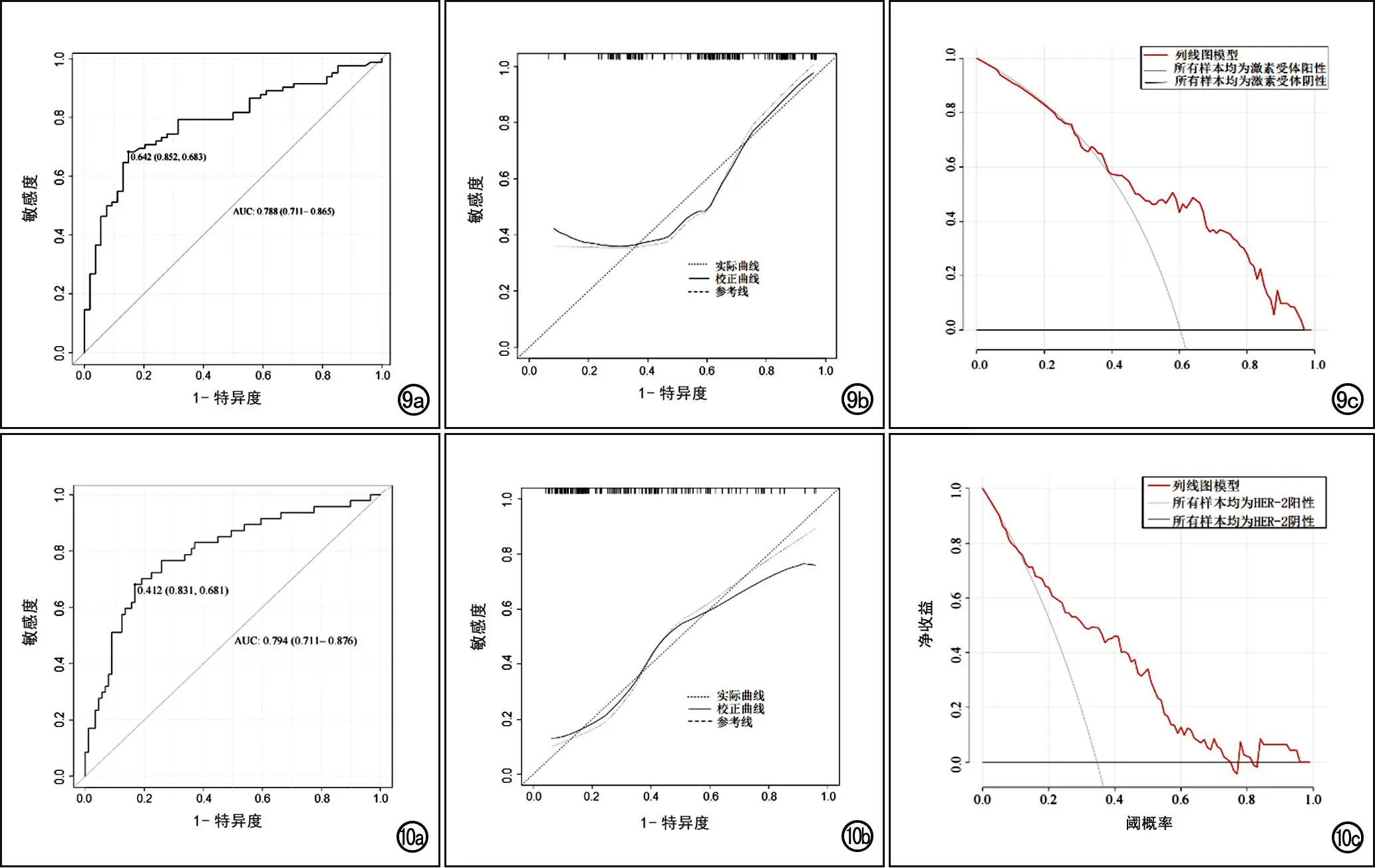
图9 激素受体阳性乳腺癌预测模型的评估。a)ROC曲线;b)校准曲线;c)DCA曲线。
毛刺、可疑恶性钙化、子灶、乳头回缩以及肿块强化程度为HER-2阳性乳腺癌的独立预测因素(表3),据此构建的预测模型绘制列线图(图8b)。ROC曲线显示列线图预测乳腺癌的AUC为0.794(95%CI:0.711~0.876),敏感度为68.1%,特异度为83.1%;DCA曲线显示,当阈值概率为12%~72%、77%~81%及85%~96%时,使用该模型预测HER-2阳性乳腺癌的净收益更高;校准曲线显示校准曲线与标准曲线贴合良好,表明HER-2阳性乳腺癌预测模型的预测概率与实际概率有较好的一致性(图10)。
讨 论
乳腺癌具有异质性,而影像学手段能够观察病灶本身及其周围环境。既往多项研究表明,乳腺X线检查及MRI能够检出乳腺癌、鉴别疾病的良恶性、指导乳腺穿刺、评估及预测新辅助化疗疗效,同时还能够预测乳腺癌ER、PR、HER-2、Ki-67表达状态及分子分型[9,16-21]。CBBCT作为一种高分辨率成像技术,能够三维无重叠显示乳腺病变及病灶强化方式等影像特征,对乳腺疾病的诊断效能及病灶范围评估的准确性与乳腺MRI基本接近[22]。本研究聚焦于CBBCT影像特征与激素受体及HER-2表达状态的相关性,结果显示:与激素受体阴性乳腺癌相比,受体阳性乳腺癌的肿块偏小,呈圆/卵圆形、毛刺征及皮肤回缩征更常见。而HER-2阳性乳腺癌较阴性乳腺癌的肿块强化程度更高,可疑恶性钙化、乳头回缩、非肿块样强化及子灶的出现率更高。本研究结果表明CBBCT部分影像学特征与乳腺癌激素受体及HER-2表达状态具有显著相关性。
1.不同类型乳腺癌CBBCT特征
本研究中发现激素受体阳性乳腺癌肿块更小,Yuan等[4]的研究结果同样发现这一特点。但与本研究结果不同的是,Yuan等[4]的研究中还发现HER-2阳性组及Ki-67阳性组较阴性组的肿块更大,其原因可能是该研究中还纳入了仅表现为非肿块样强化的病例,导致了对肿块大小的测量方法与本研究不同。本研究中还发现激素受体阳性组更多表现为圆/卵圆形,但Ma等[11]的研究中发现激素受体阳性组及管腔型乳腺癌多呈不规则形,两项研究结果不同的可能原因是样本量不同及对肿块形状的判断可能受到主观因素的影响。本研究中发现毛刺多见于激素受体阳性组,这与多项研究结果一致[4,8,11]。毛刺征是侵袭性较弱的标志[11],其病理基础是癌组织渗透到周围区域,导致高间质反应和纤维结缔组织增生[6]。
有研究认为肿块强化程度与乳腺癌分子分型相关[11,23]。本研究与Zhu等[3]的研究结果同样表明HER-2阳性组肿块强化程度大于阴性组,可能是因为HER-2与血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGF-2)相关[24],而后者能够促进更多肿瘤血管生成;Ma等[11]的研究结果显示HER-2过表达型的ΔCT最高,同样也支持上述推论。但Uhlig等[23]的研究结果显示管腔A型肿块强化程度大于管腔B型、HER-2过表达型及三阴性乳腺癌,且HER-2过表达型的病灶强化程度大于另外两种分子分型,该研究与本研究结果的差异为分组方式及ROI放置的方法存在一定差异。
本研究结果显示,肿块内部强化特征在激素受体阳性组与阴性组、HER-2阳性组与阴性组之间的差异均无统计学意义(P>0.05)。Uhlig等[23]的研究中发现不同分子分型乳腺癌之间病灶内部强化特征的差异无统计学意义。但Long等[6]的研究中发现管腔型乳腺癌多为均匀强化,HER-2过表达型则为不均质强化,而环形强化型则以三阴性型多见。不同研究之间结果的差异可能是因为分组方式不同所致;也可能是因为在注射对比剂后CBBCT扫描的时间较MRI短,此时肿瘤组织的强化程度可能未达到最显著,与无强化的坏死组织之间对比欠佳。
本研究结果表明HER-2阳性乳腺癌较阴性组更易出现可疑恶性钙化。既往的多项研究中发现微小钙化与HER-2阳性或HER-2过表达型乳腺癌显著相关[3,11,25,26]。这可能是因为HER-2阳性肿瘤的导管内成分较多,导致乳腺导管内肿瘤组织发生快速增殖和坏死,进而形成微钙化[5,7,10,27]。本研究与Seyfettin等的研究均发现HER-2阳性组中非肿块样强化更多见,可能也与HER-2阳性肿瘤导管内成分较多相关[5]。同时本研究中还发现,HER-2阳性乳腺癌更易出现子灶,这可能与HER-2能够促进肿瘤生长、周围组织侵犯及转移相关[4,10]。
皮肤回缩是恶性肿瘤侵犯悬韧带所致,乳头回缩则是肿瘤组织侵犯乳后中央区导管所致。本研究中发现激素受体阳性乳腺癌更易出现皮肤回缩,HER-2阳性乳腺癌更易出现乳头回缩。但尚未有其它研究将乳腺癌的这2个CBBCT征象纳入研究范围,而皮肤回缩及乳头回缩对临床医师选择保乳手术可提供一定的参考价值。
2.本研究的局限性
本研究存在的不足之处:①样本量偏小,尚不能利用数据进行外部验证,还需要大样本、多中心研究来验证本研究结果;②对CBBCT影像特征的分类和判定参考的是BI-RADS中的MRI以及乳腺X线摄影的特征分类及判定标准,目前尚无乳腺CBBCT影像特征的判定规范,有待进一步探讨CBBCT独有的特征判定标准;③本研究中对乳腺癌影像特征的判定可能存在一定的主观性,可以进一步采用影像组学等客观判定方法探索乳腺癌不同分子分型与CBBCT特征的相关性。
综上所述,CBBCT是一种高分辨率成像技术,其显示的乳腺癌的部分征象与激素受体及HER-2表达状态具有一定的相关性,有望为临床乳腺癌个体化治疗提供参考依据。
