IVIM-DWI联合DCE-MRI对乳腺癌Nottingham指数的预测价值
2023-12-25李美芹刘莹赵凡冯海霞王婷王唯伟
李美芹,刘莹,赵凡,冯海霞,王婷,王唯伟
乳腺癌是女性最常见的恶性肿瘤,异质性明显,严重威胁女性的生命健康[1]。乳腺癌的预后与雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、增殖细胞核抗原(Ki-67 antigen,Ki-67)和人类表皮生长因子受体-2(human epidermal growth factor receptor 2,HER-2)等指标相关[2]。Nottingham预后指数(Nottingham prognostic index,NPI)作为一项国际公认的乳腺癌预后综合评估指标,实用性强,对于患者的预后评估、治疗方案的制订及疗效的监测均具有重要价值[3]。体素内不相干运动(intravoxel incoherent motion,IVIM)模型采用双指数曲线拟合方式,可分离出微循环血流灌注引起的“假扩散”信息[4]。DCE-MRI可利用药代动力学模型量化评价肿瘤的微血管灌注及渗透情况,从而对病变性质做出判断[5]。国内外较多学者对IVIM-DWI或DCE-MRI单一序列在乳腺癌预后术前评估中的价值进行了研究[6,7],但对于两者联合与乳腺癌预后因子的相关性方面的研究尚不多见。
材料与方法
1.一般资料
选取2019年10月-2022年6月在本院经病理证实的166例女性乳腺癌患者,年龄29~79岁,平均(51.37±9.94)岁。纳入标准:①临床拟诊为乳腺癌且接受IVIM-DWI及DCE-MRI检查;②MRI检查后2周内行穿刺活检或手术并进行了乳腺癌的常规病理检查及免疫组化检测(检测指标包括ER、PR、HER-2及Ki-67)。排除标准:①MRI检查前已接受过乳腺病灶的穿刺活检、手术或放化疗;②MRI检查序列不全或图像质量不佳。
本研究获得济宁医学院附属医院伦理委员会批准,并在MRI检查前签署了知情同意书。
2.MRI检查方法
使用GE Discovery 750W 3.0T MR扫描仪和16通道的双乳相控阵线圈。患者取俯卧位,双侧乳房自然悬垂于乳腺线圈内,足先进。横轴面IVIM-DWI采用单次激发SE-EPI序列,扫描参数:TR 2500 ms,TE 90 ms,层厚4.0 mm,层间距0.4 mm,扫描视野350 mm×350 mm,矩阵128×128,12个b值分别为0、30、50、80、100、150、200、500、800、1000、1500和2000 s/mm2,激励次数随着b值的增加依次为1、1、1、1、1、1、1、2、2、4、5和6次,扫描时间6 min 40 s。DCE-MRI使用3D乳腺容积成像(volume imaging for breast assessment,VIBRANT)序列,层厚1.4 mm,层间距0 mm,视野350 mm×350 mm,翻转角12°,先扫描1期蒙片,结束后立即通过肘前静脉以3.0 mL/s的流率注射0.1 mmol/kg剂量的钆喷酸葡胺,然后在自由呼吸的状态下扫描45个时相,每个时相采集时间为7 s,总扫描时间5 min 15 s。
3.图像后处理及分析
将采集数据传输至GE Advantage Windows 4.7后处理工作站。IVIM-DWI图像后处理:利用Function tools中的MADC软件包,获得纯扩散系数(D)、灌注相关扩散系数(D*)和灌注分数(f)的伪彩图。
结合增强扫描图像,在IVIM-DWI灰度图(b=1000 s/mm2)上选取病灶实性成分最大的层面,避开出血、坏死、囊变等区域,在肿瘤实性成分最大的区域内勾画ROI,大小为50~150 mm2。然后将ROI复制到D、D*及f的伪彩图上获取相应参数值。
DCE-MRI图像后处理:利用Function tools中的GenIQ软件(GenIQ General协议,Standard Tofts model),选择固定的基线T1值(1200 ms)和基于人群的动脉输入函数(arterial input function,AIF),获取参数容量转移常数(volume transfer constant,Ktrans)、血管外细胞外间隙容积比(extravascular extracellular space distribute volume per unit tissue volume,Ve)、速率常数(rate constant,Kep)的伪彩图。在45期动态增强强化最为明显的一期图像上选取肿瘤实性成分最大的层面,避开出血、坏死、囊变等区域,在肿瘤实性成分最大的区域内勾画ROI,大小为50~150 mm2,然后将ROI复制到Ktrans、Ve及Kep的伪彩图上获取相应参数值。每例患者在勾画ROI时尽量保证在IVIM-DWI及DCE-MRI图像上选择病灶的相同层面及位置。
由2位乳腺影像诊断医师(5年以上影像诊断工作经验)在不知病理结果的情况下,进行图像分析和数据测量,每个病灶重复测量3次,取3次的平均值并记录;然后对两位医师测量的医师再进行组间一致性分析,如一致性较好,则以其中一位医师的测量结果为准。
4.模型的构建
将不同NPI预后组之间有统计学差异的IVIM-DWI及DCE-MRI定量参数置入二元logistic回归方程中,获得对NPI有鉴别诊断价值的独立影响因素;将上述独立影响因素分别构建IVIM-DWI、DCE-MRI和IVIM-DWI+DCE-MRI多参数模型。
5.病理及免疫组化分析
术后大体标本采用石蜡薄片行HE染色。①NPI分组标准:NPI=肿瘤最大直径(cm)×0.2+淋巴结转移情况评分+病理分级评分。肿瘤最大径根据手术切除的大体标本测量获得;淋巴结转移情况是基于术后病理检查结果来确定,分为1~3期,分别对应于无淋巴结转移、1~3个淋巴结转移和>4个淋巴结转移这3种结果,分别记为1~3分;病理分级为Ⅰ、Ⅱ、Ⅲ级,分别记为1~3分。患者的NPI评分<3.4判定为预后良好,≥3.4判定为预后不良[8]。②ER和PR评估方法:细胞核染色阳性的肿瘤细胞占比≥1%为阳性,<1%为阴性。③HER-2的评判标准:无染色或≤10%的癌细胞呈现不完整的、微弱的细胞膜染色记为HER-2(0);>10%的浸润性癌细胞呈现不完整的、微弱的细胞膜染色记为HER-2(+);>10%的癌细胞呈现弱至中等强度的完整细胞膜染色或≤10%的癌细胞呈现强而完整的细胞膜染色标记为HER-2();>10%的癌细胞呈现强、完整、均匀的细胞膜染色标记为HER-2()。(0)和(+)为HER-2阴性,()为HER-2阳性,()为 HER-2可疑阳性而需进一步行FISH检测,FISH结果显示基因扩增则为HER-2阳性,反之则为阴性。④Ki-67分组标准:高倍镜下(×200)观察任意10个视野,计算每个视野内Ki-67染色阳性细胞数占全部细胞数的比例,取10个视野比例值的平均值,该值≥14%为Ki-67高表达,<14%为Ki-67低表达[9]。
6.统计学分析
使用SPSS 22.0和MedCalc 15.0软件对数据进行统计分析。采用组内相关系数(interclass correlation coefficient,ICC)对两位观察者测量的IVIM-DWI及DCE-MRI定量参数值的组间一致性进行分析(0.11~0.40为一致性较低,0.41~0.60为一致性中等,0.61~0.80为一致性良好,ICC>0.80为一致性较强)。采用Kolmoforov-SmirnovZ检验分析IVIM-DWI及DCE-MRI定量参数是否符合正态分布,再使用Levene检验分析参数值的方差齐性,符合正态分布的参数以均数±标准差表示,组间比较采用独立样本t检验,不符合正态分布的参数则以 M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。采用ROC曲线分析IVIM-DWI、DCE-MRI及IVIM-DWI+DCE-MRI模型对Nottingham指数预后分组的预测效能,计算AUC、敏感度、特异度和符合率。采用Delong检验对不同变量或模型之间AUC的差异进行分析。以P<0.05为差异具有统计学意义。
结 果
1.临床病理资料
166例中,143为浸润性导管癌,11例为导管原位癌,7例为浸润性乳头状癌,3例为浸润性小叶癌,1例为黏液癌,1例为筛状癌。根据基因分型,19例为Luminal A型,88例为Lminal B型,26例为HER-2阳性型,33例为三阴型。按照Nottingham指数值,将患者分为预后良好组(40例)和预后不良组(126例)。
2.一致性分析
两位医师测量的D、D*、f、Ktrans、Kep及Ve值的ICC值(0.811~0.897)均大于0.80,表明一致性均较强。
3.不同预后组间IVIM-DWI及DCE-MRI参数的比较
不同免疫组化指标分组及不同NPI预后分组之间IVIM-DWI及DCE-MRI参数值的比较结果详见表1~3,典型病例的MRI及病理图像见图1。

表2 HER-2、Ki-67不同表达状态组间IVIM-DWI及DCE-MRI参数的比较

表3 不同NPI预后组间IVIM-DWI及DCE-MRI参数的比较
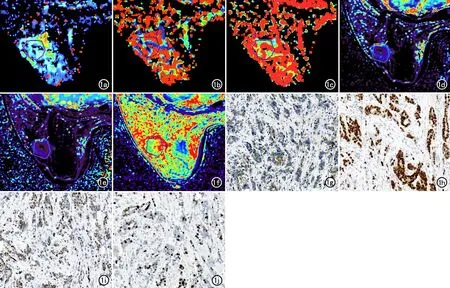
图1 女,59岁,左乳浸润性导管癌II级,Luminal B型。a)D值伪彩图,显示病灶的D值较低呈蓝绿色,D=0.30×10-3mm2/s;b)D*值伪彩图,显示病灶的D*值较高呈红蓝色,D*=30.8×10-3mm2/s;c)f值伪彩图,显示病灶的f值较高呈红绿色,f=41.0%;d)Ktrans值伪彩图,显示病灶的Ktrans值较低呈蓝紫色,Ktrans=0.45min-1;e)Kep伪彩图,显示病灶的Kep值较低呈蓝紫色,Kep=0.56min-1;f)Ve值伪彩图,显示病灶的Ve值较高呈红绿色,Ve=0.78;g)ER染色阳性表现为肿瘤细胞核内出现棕黄色颗粒;h)PR染色阳性表现为肿瘤细胞核内出现棕黄色颗粒;i)HER-2染色阴性,表现为肿瘤细胞膜无或呈微弱棕黄色着色;j)Ki-67为高表达,可见肿瘤细胞核呈棕黄色的细胞较多。
ER阴性组的D*、f和Ktrans值高于阳性组,差异均有统计学意义(P<0.05)。PR阴性组的D*值高于阳性组,差异有统计学意义(P<0.05)。HER-2阳性组的Ktrans、Ve值大于阴性组,差异有统计学意义(P<0.05)。Ki-67高表达组的Ktrans、Kep及D*值大于低表达组,而D值小于低表达组,差异均有统计学意义(P<0.05);预后不良组(NPI≥3.4)的Ktrans、Kep及D*值大于预后良好组(NPI<3.4),而D值小于预后良好组,差异均有统计学意义(P<0.05)。
4.IVIM-DWI及DCE-MRI参数对NPI预后的诊断效能
将组间差异有统计学意义的IVIM-DWI参数(D、D*)和DCE-MRI参数(Ktrans及Kep)分别或联合纳入logistic回归分析,结果显示D、Kep和Kep值为鉴别NPI预后的独立影响因素,相应的回归方程为:P=1/[1+e-(1.871-4.118X1+3.007X2+3.211X3)]。基于回归分析,共构建了3种模型,即DCE-MRI模型(D)、DCE-MRI模型(Ktrans+Kep)和联合模型(D+Ktrans+Kep)。
采用ROC曲线分析3个单项参数及3个模型对乳腺癌NPI预后分组的诊断效能,结果详见表4和图2~3。三个定量参数中,当D≤0.77×10-3mm2/s、Ktrans≥0.24/min、Kep≥0.42/min时,对NPI预后不良的诊断效能最佳,其中以D的AUC最大,其诊断效能优于Ktrans和Kep(Z=2.232,P=0.026;Z=2.077,P=0.038)。联合模型的AUC为0.891,诊断效能高于单一模型(Z=1.963,P=0.049;Z=3.418,P=0.006);敏感度为87.5%,特异度为87.3%,符合率为82.5%。
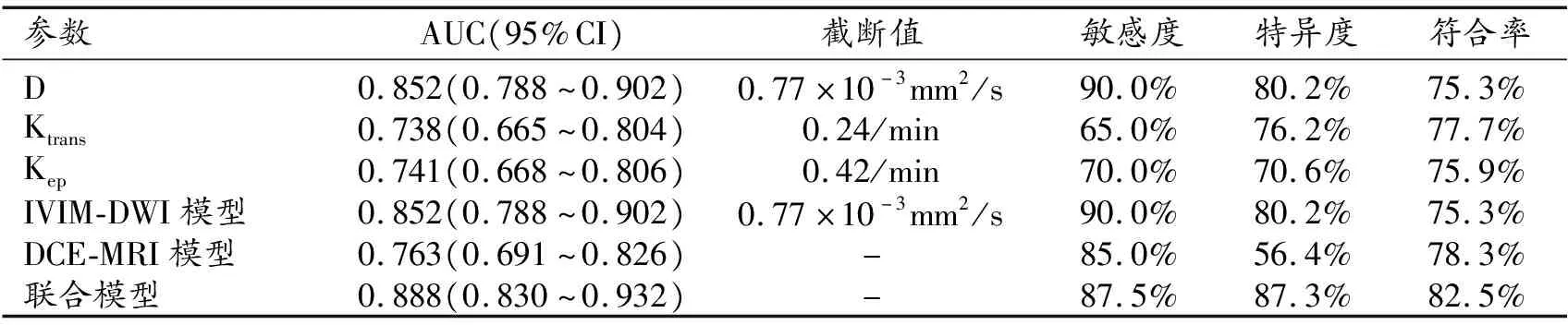
表4 IVIM-DWI及DCE-MRI参数及诊断模型对乳腺癌NPI预后的诊断效能
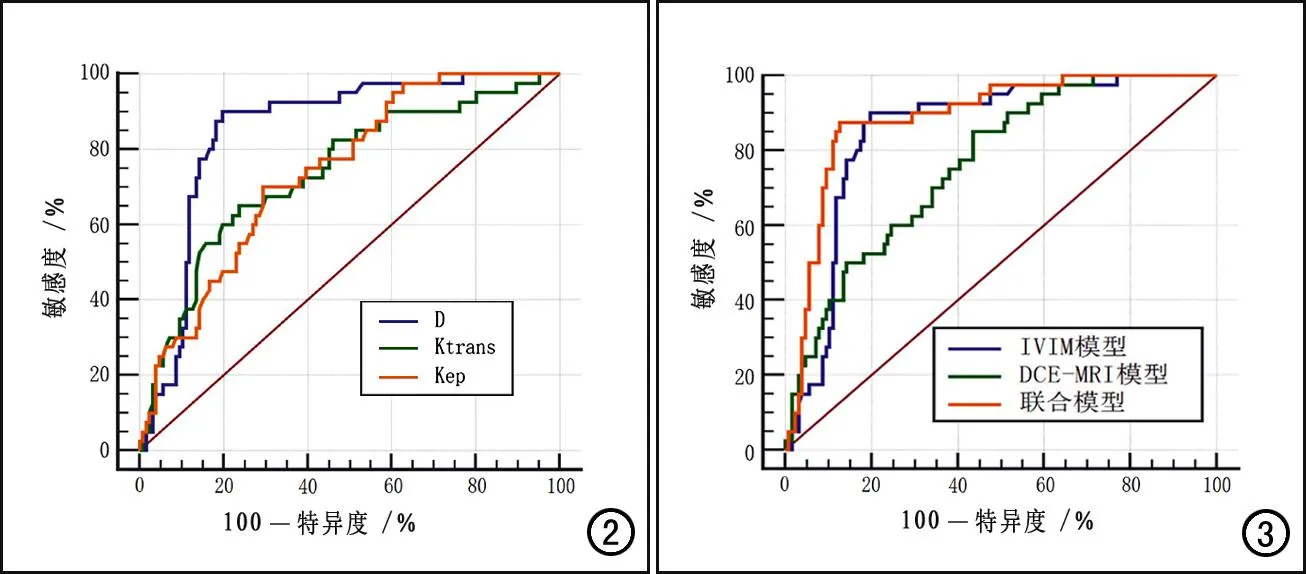
图2 IVIM-DWI和DCE-MRI参数D、Ktrans和Kep的ROC曲线,D值的AUC最大。
讨 论
乳腺癌的免疫组化指标与患者的治疗方案及预后密切相关。本研究中ER阳性组的D*、f和Ktrans值小于阴性组,病理基础为ER阳性表达可通过抑制血管内皮生长因子水平,减少肿瘤的微血供,使D*、f和Ktrans值减小[10]。HER-2可促进细胞分裂,提升肿瘤组织的微血供,可使肿瘤对内分泌治疗不敏感,但对靶向药物如曲妥珠单抗治疗敏感[11]。本研究中HER-2阳性组Ktrans和Ve值大于阴性组,其病理基础是HER-2基因诱导血管内皮生长因子生成,增强了瘤内微灌注和血管通透性[12]。Ki-67是反映肿瘤细胞增殖程度的常用量化指标,本研究发现Ki-67高表达组的D值小于低表达组,而D*、Ktrans及Kep值高于低表达组,与既往的研究结果基本一致[13-14]。其相应的病理生理机制是肿瘤Ki-67的高表达增高了自由水扩散受限程度;此外Ki-67高表达的乳腺癌病灶内微血管密度高,血管壁通透性增加,局部血供丰富。
IVIM-DWI模型的D及DCE-MRI的Ktrans、Kep是评估NPI最有价值的定量参数;将上述参数联合后,诊断效能高于IVIM-DWI及DCE-MRI模型。
NPI作为一项国际公认的乳腺癌综合预后指标,实用性强,对于患者的预后评估、治疗方案的制定及疗效的监测都有重要价值[15]。有文献报道DWI的ADC值、MRS的Cho峰及超声血流信号评分与NPI均具有显著相关性[16,17],但对于IVIM-DWI和DCE-MRI相关参数与NPI的相关性及其对预后的诊断效能的研究较少。肿瘤细胞的异质性、更多的微血管生成、更高的血容量和血管化促进了乳腺癌的增殖和转移,相应NPI值便会增高。NPI值越高,即肿瘤细胞异质性越明显,则D值越低;NPI越高,肿瘤内微灌注程度越高,则相应地Ktrans及Kep值越高。本研究中D、Ktrans及Kep为鉴别NPI预后的独立影响因素,且D的诊断效能最佳,提示其在反映NPI上的优势。ROC曲线分析结果显示,IVIM-DWI与DCE-MRI参数构建联合模型后,诊断效能高于单一模型,特异度及符合率也均能得到大幅提升,更好地弥补了单一模型和单一参数的不足,也证实了IVIM-DWI+DCE-MRI联合模型判断预后因子的可行性。
本研究存在一定的局限性:①纳入患者的样本量较小;②IVIM-DWI模型所选b值个数及大小国内外尚无统一标准;③ROI为手动勾画,具有主观性,且本研究中仅在肿瘤最大层面上进行ROI的勾画,没有基于整个肿瘤进行3D-ROI的勾画,且ROI的选取与病理组织取材部位可能存在一定的差异,可能导致结果的偏倚。
综上所述,联合运用IVIM-DWI和DCE-MRI定量参数可较好地评估乳腺癌的Nottingham指数,在临床实践中可作为常规MRI的补充,有助于乳腺癌患者术前个体化治疗及预后预测。
