非编码RNA在脓毒症发病中的研究进展
2023-12-24肖志辉陈曦吴刚吴登龙
肖志辉,陈曦,吴刚,吴登龙
1. 同济大学医学院,上海 200331; 2. 上海市同济医院泌尿外科,上海 200065
脓毒症是一种由细菌、病毒、真菌感染所引起的全身炎症反应综合征。它是重症监护室(intensive care unit,ICU)中患者死亡的主要原因之一。感染性微生物能通过诱导细胞因子释放来刺激机体产生炎症反应,而炎症反应可能会进一步导致全身多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[1]。除此之外,脓毒症患者并发的全身性低血压和微循环系统的异常灌注也是导致其全身多器官系统衰竭的重要因素。目前尚无预防和治疗脓毒症患者多器官系统衰竭的有效方法。因此,在细胞和生化水平上识别与脓毒症相关的变化,早诊断、早复苏并且及时给予适当的抗生素治疗是非常重要的[2]。
最新的研究表明,发生脓毒症时机体内一些非编码RNA,如长链非编码RNA(long noncoding RNA,lncRNA)、微RNA(microRNA,miRNA)和环状RNA(circular RNA, circRNA)的表达发生了变化;其转录产物也可通过各种不同的机制参与多器官系统衰竭的发病过程。本文阐述了这3类非编码RNA在脓毒症及其相关并发症中起到的作用。
1 LncRNA与脓毒症
LncRNA是一种大小超过200个核苷酸的转录产物。它们可以通过调节染色质构型、控制剪切相关事件、充当其他转录产物的诱饵和构建调控蛋白的募集结构来调节基因的表达[3]。此外,它们还参与了免疫反应的调节和几种免疫相关疾病的发病过程[4]。最经典的例子为Carpenter等[5]的实验:他们证明了lncRNA-Cox2通过与各种蛋白(如hnRNP A/B、hnRNP A2/B1、SWI/SNF等)相互作用调节染色质重塑和晚期原发性炎症反应基因的反式活化。同时,Mumbach等[6]证明了LincRNA-EPS可以抑制免疫相关基因,如白细胞介素(interleukin,IL)6、IL1a和Ccl5的表达。此外,lncRNA在一些自身免疫性疾病,如系统性红斑狼疮、类风湿性关节炎、多发性硬化症、1型糖尿病的发病过程中也起到重要作用[7-8]。
Qiu等[9]所做的急性肺损伤(acute lung injury,ALI)动物模型实验表明,动物模型中牛磺酸上调基因1(taurine up-regulated gene 1,Tug1)表达下调可诱导机体细胞凋亡和炎症反应。此外,在这些动物体中,上调Tug1可以改善与脓毒症相关的肺损伤,减少细胞凋亡,减轻炎症反应。TUG1还能保护肺微血管内皮细胞,使其免受内毒素的损害。TUG1通过海绵化miR-34b-5p和解除对接头蛋白GAB1的抑制作用来抑制脂多糖(lipopolysaccharide,LPS)刺激的微血管内皮细胞的凋亡和炎症反应。总之,TUG1可通过miR-34b-5p/GAB1通路改善与脓毒症相关的炎症反应和细胞凋亡。Li等[10]研究发现,脓毒症患者的血浆样本中的Tug1基因下调、miR-223基因上调,还证明了脓毒症患者TUG1和miR-223的表达呈负相关。此外,TUG1的表达水平与呼吸道感染程度、血肌酐水平、白细胞水平、C反应蛋白水平、APACHE II评分和SOFA评分呈负相关。基于这些结果,TUG1被认为是一种预测脓毒症病程和预后的生物标志物。TUG1也被证明与miR27a存在相互作用[11]:在心肌细胞中,TUG1的过度表达会导致肿瘤坏死因子(tumor necrosis factor,TNF)α下调,而miR-27a的过表达则会增强TNF-α的表达。上调TNF-α和miR-27a可促进LPS诱导的心肌细胞凋亡,上调TUG1则起到相反的作用。
肺腺癌转移相关转录物1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)也是一种lncRNA,其通过影响miR146a/NF-κBP65来调节内毒素诱导的脓毒症大鼠的免疫反应[12]。此外,MALAT1可通过募集EZH2下调BRCA1的水平,从而增加骨骼肌细胞的凋亡,并增强与脓毒症相关的机体免疫反应[13]。在细胞水平,MALAT1可通过miR-150-5p/NF-κB这一通路来调节脓毒症相关心脏炎症反应[14]。乌司他汀通过下调MALAT1对LPS相关的心脏微血管内皮细胞功能障碍发挥保护作用[15]。Le和Shi[16]的研究证明,MALAT1可以通过miR-3b的靶向吸附,上调STAT125和降钙素原(procalcitonin,PCT)的表达。最值得注意的是,MALAT1/miR-125a通路已被证明可以用来预测脓毒症患者疾病的严重程度、器官的损害程度、炎症反应水平和死亡率。与健康对照组相比,脓毒症患者的lnc-MALAT1/miR-125a通路表达增加(P<0.001),其在区分脓毒症组和健康对照组方面具有极好的价值,曲线下面积(area under the cure,AUC)为0.931,95%置信区间为[0.908,0.954][17]。
NEAT1(nuclear paraspeckle assembly transcript 1)也是一种被广泛研究的、参与脓毒症病理生理过程的lncRNA。NEAT1可通过let-7a/TLR4通路促进炎症反应,加重脓毒症相关的肝损伤[18]。此外,NEAT1可通过miR-370-3p/TSP-1通路促进脓毒症的进展[19],还可通过调节miR-17-5p/TLR4通路促进内毒素诱导的巨噬细胞炎症反应[20]。NEAT1下调后可通过miR-125/MCEMP1通路抑制脓毒症小鼠的免疫反应[21]。与健康对照组相比,烧伤导致的脓毒症患者血清中的NEAT1表达量增加,miR-495-3p表达量下降,前者可调节血管生成并激活TGFβ1/SMAD信号通路[22]。最新的研究表明,NEAT1可通过调节miR-9-5p/TFRC和GOT1通路促进铁死亡,导致脓毒症相关性脑病恶化[23]。表1总结了常见的lncRNA (如TUG1、MALAT1和NEAT1)在脓毒症发病过程中所起的作用。
此外,其他几种lncRNA也可通过调节免疫反应来影响脓毒症的进程。Li等[43]研究发现,MEG3-4可调控免疫应答基因的转录水平,从而动态调节肺部炎症反应:MEG3-4以竞争的方式结合到miR-138上,与编码致炎细胞因子IL-1β的mRNA竞争,从而增加IL-1β的丰度,并可加强体外培养的小鼠肺泡巨噬细胞、肺上皮细胞以及肺组织对细菌感染的炎症反应;MEG3-4介导的miR-138在细胞质中的海绵作用增加了IL-1β的自分泌活性,从而诱导了由NF-κB介导的负反馈机制,从而降低MEG3-4的丰度,减少炎性细胞因子的产生。及时降低MEG3-4丰度可缓和肺部感染细菌小鼠体内的促炎反应,防止感染向脓毒症进展。这些发现揭示了MEG3-4通过免疫反应基因的转录调节来动态调节肺部炎症反应,将与lncRNA相关的诱饵和海绵机制延伸到抗菌免疫,从而影响炎症反应和疾病进展。Yang等[44]研究发现,沉默HULC可抑制细胞凋亡和炎症反应。HULC负向调控miR-128-3p的表达,敲低HULC后,miR-128-3p上调,使HMEC-1细胞免受LPS诱导的损伤。RAC1是miR-128-3p的靶点,在LPS刺激的HMEC-1细胞中,提高RAC1可削弱HULC介导的对凋亡和炎症的抑制作用。通过调节miR-128-3p/RAC1轴,HULC敲低后可部分逆转LPS诱导的脓毒症。Wang等[45]研究发现,lncRNA XIST与miR-150-5p通过TXNIP通路调节脓毒症诱导的心肌损伤。XIST影响细胞焦亡,敲低XIST可减轻脂多糖诱导的细胞损伤。Liu等[46]研究提示,ZFAS1通过靶向miR-590-3p/AMPK/mTOR信号介导的心肌细胞自噬和焦亡来加速脓毒症所致心功能障碍的进展。
2 miRNA与脓毒症
miRNA的大小约为22个核苷酸,它们通过与靶mRNA的不同区域尤其是与其3′端非编码区结合来调节基因的表达。它们既可以降解靶基因,也可以抑制其翻译。现已发现几种miRNA可以影响脓毒症的进程。许多研究已经报道了这些转录产物在脓毒症中的表达改变。例如,与健康对照组相比,脓毒症患者血浆miR-494-3p水平降低,与TLR6上调相关。在脂多糖诱导的RAW264.7细胞中,miR-494-3p的表达水平降低,同时TLR6和TNF-a的表达上调。在RAW264.7细胞中强制过表达miR-494-3p可降低TNF-α水平,抑制NF-κB p65的核转位。TLR6已被证明是miR-494-3P的靶点。总之,miR-494-3p可以通过影响TLR6的表达来减轻脓毒症相关的炎症反应[47]。miR-218是另一种参与脓毒症发病过程的miRNA。这种miRNA可以通过JAK/STAT通路降低VOPP1的表达,从而减轻脓毒症的炎症反应[48]。
miR-122是脓毒症中的另一种重要的miRNA,与C反应蛋白(C-reactive protein,CRP)相比,miR-122对脓毒症和伤口感染具有更高的诊断价值。虽然其特异性和准确性较低,但miR-122也被认为是脓毒症的预后标志物[49]。
在脓毒症小鼠模型中,miR-208A-5p水平降低和SOCS2水平升高与超氧化物歧化酶(superoxide dismutase,SOD)活性增强、乳酸脱氢酶(lactate dehydrogenase,LDH)和丙二醛(malondialdehyde,MDA)活性降低相关。此外,在该动物模型中,miR-208A-5p的下调与低水平的TNF-α、IL-6、NF-kB p65和HIF-1α有关。miR-208A-5p的沉默可减轻脓毒症动物模型的心肌细胞线粒体肿胀程度,抑制心肌细胞凋亡。综上所述,抑制miR-208A-5p的表达被认为是减轻脓毒症相关心肌损伤的一种方式。这一功能是通过NF-κB/HIF-1α通路介导的[50]。
miR-21是另一种miRNA,其在脓毒症中的作用已被广泛证实。Xue等[51]的一项研究表明,miR-21的下调可以抑制炎性小体激活、ASC嗜热体、抑制内毒素诱导的细胞焦亡和感染性休克。另一项在脓毒症动物模型中的研究表明,miR-21的上调抑制了炎症反应和细胞凋亡[52]。同样,骨髓间充质干细胞来源的外切体复合物已被证明可以通过上调miR-21来减轻脓毒症小鼠的症状并提高其存活率[53]。
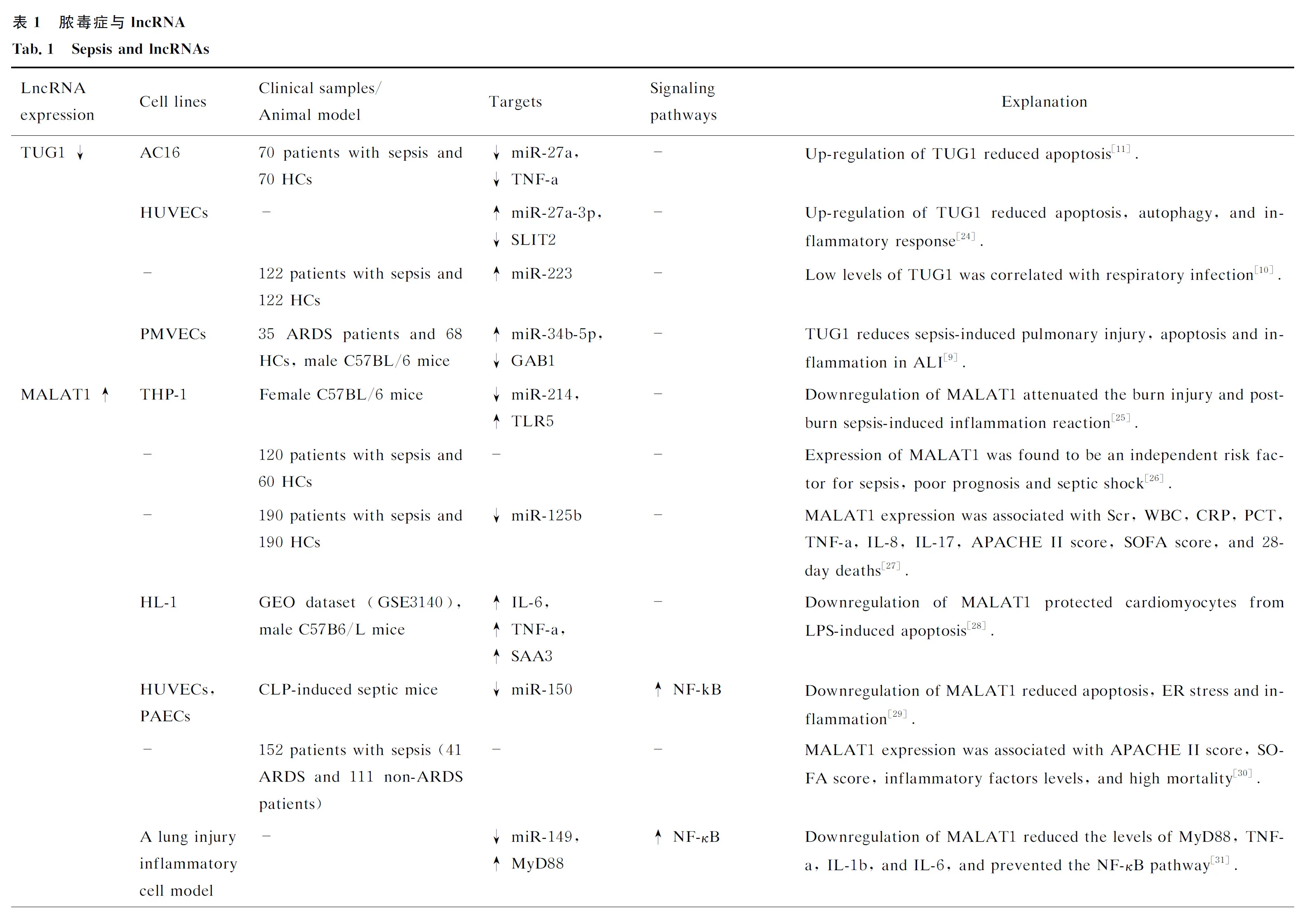
miR-328是另一种在脓毒症患者和脓毒症动物模型中表达失调的miRNA。miR-328的表达与血肌酐、白细胞、CRP、降钙素原水平和APACHE II评分、SOFA评分呈正相关。同时,Sun等[54]通过接受者操作特征 (receiver operating characteristic,ROC)曲线评价了miR-328在脓毒症中的诊断价值,结果显示AUC为0.926,敏感性为87.60%,特异性为86.36%。这一结果提示该miRNA的血清水平可以正确地鉴别脓毒症。因此,miR-328被认为是脓毒症的诊断生物标志物。此外,miR-328的下调可以改善脓毒症相关的心功能障碍和组织炎症反应。miR-452是另一种应用于脓毒症诊断的miRNA。值得注意的是,因为这种miRNA在脓毒症并发急性肾损伤的患者中的表达比其他脓毒症患者更高,所以该miRNA的血清和尿液水平可能是脓毒症并发急性肾损伤的早期诊断的标记物[55]。表2中总结了几种常见的miRNA在脓毒症诊断中的作用。
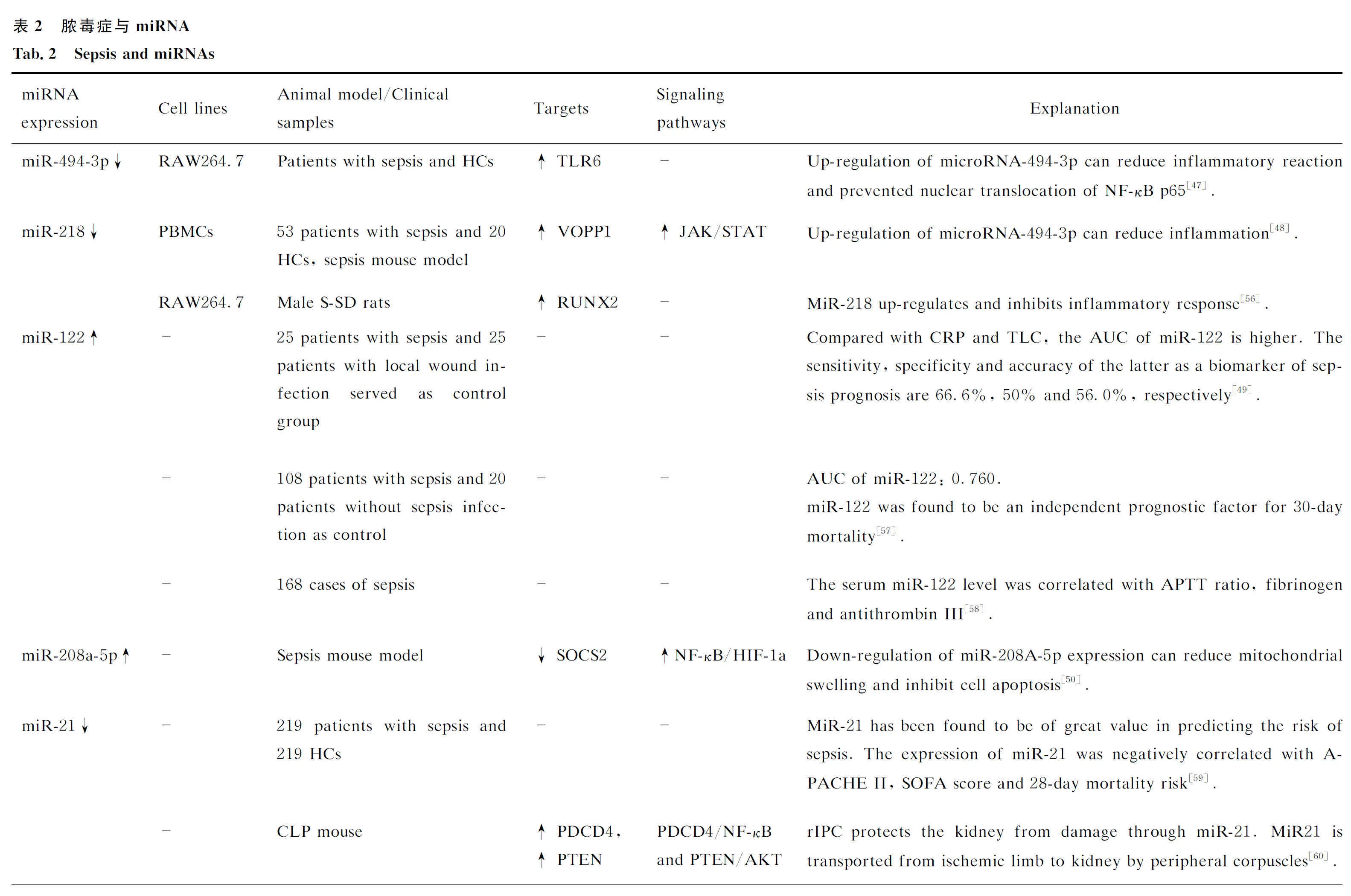
3 circRNA与脓毒症
circRNA是最近发现的一组具有封闭环状构型的非编码RNA,由共价键将线性转录产物的两端连接形成,其在多种疾病的病理过程中发挥着至关重要的作用。大量证据表明,一些转录产物如mRNA可以作为蛋白质生物合成的直接模板在核糖体中翻译产生蛋白质,而circRNA主要在转录中发挥调节功能。许多研究评估了circRNA在脓毒症中的作用[63]。在脓毒症刺激的肺损伤的发展过程中,circRNA可调控基因表达,如circC3P1通过影响miR-21的表达来减少脓毒症相关性急性肺损伤中炎性细胞因子的产生和细胞凋亡[64]。
脓毒症患者与健康个体血清外泌体中circRNA的表达存在差异,这可能与疾病的发生和发展有关。Tian等[65]的研究表明,脓毒症患者和健康对照组之间有132个circRNA的表达存在差异: RT-PCR法提示circRNA_104484和circRNA_104670 在脓毒症患者血清中表达上调;ROC分析表明,这2种circRNA具有作为脓毒症诊断新型生物标志物和分子治疗靶点的潜力。
circSTRN3也是一种被认为可以作为未来治疗脓毒症相关急性肾损伤(acute kidney injury,AKI)靶点的circRNA。RT-PCR法已证实circSTRN3在脓毒症患者的血清中表达上调。在脓毒症诱导的AKI中, STRN3上调,进而通过miR-578/TLR4轴,促进AKI的发病,因此circSTRN3可能成为AKI治疗的未来靶点[66]。
circVMA21能够通过miR-9-3p/SMG1通路调节氧化应激反应和炎症反应,来改善脓毒症相关性AKI[67]。circ_0114428/miR-495-3p/CRBN通路是参与脓毒症相关性AKI发病机制的另一个分子通路[68]。此外,circPRKCI的表达水平与脓毒症的严重程度和28天内的死亡风险相关[69]。
circHIPK3可通过miR-124-3p/KLF6通路加重脓毒症性急性肾损伤(sepsis-induced acute kidney injury,SAKI)的炎症反应,也可通过miR-148b-3p/DNMT1/3a加速SAKI细胞衰老[70]。circHIPK3在SAKI中高表达,circHIPK3沉默可减轻SAKI小鼠的肾脏损伤,并通过减轻炎症反应和抑制细胞衰老来提高SAKI细胞的活力。在机制上,circHIPK3通过竞争性结合miR-124-3p上调KLF6的表达,从而促进KLF6与NLRP3的结合,激活NLRP3/caspase-1介导的细胞焦亡,最终加重SAKI炎症反应。circHIPK3通过竞争性结合miR-148b-3p上调DNMT1/3a的表达,从而提高Klotho启动子的甲基化水平,加速SAKI细胞的衰老。下调miR-124-3p或miR-148B-3p可减弱HIPK3沉默对SAKI的保护作用。
circ_RASGEF1B是环状RNA RasGEF结构域成员。有研究证明, circ_RASGEF1B通过与miR-146a-5p结合,上调miR-146a-5p靶点PDK1的表达,从而促进LPS诱导的肾小管上皮细胞凋亡和炎症反应[71]。Hong等[72]的研究结果提示,circFADS2在脓毒症患者血清中表达上调;其对LPS诱导的炎症反应具有保护作用,可抑制后者诱导的肺细胞凋亡。表3总结了几种常见的circRNA在脓毒症中的作用。
4 讨论
尽早诊断脓毒症对于提高患者生存率极为重要。特征性的诊断标准物有助于对患者进行早期诊断并提供适当的治疗。然而,目前临床常用的生物标志物缺乏特异性。
大量文献指出,lncRNA、miRNA和circRNA与脓毒症的并发症有关。一些lncRNA如NEAT1、XIST、MALAT1、MEG3、ZFAS1、HULC、MIAT和TUG1在脓毒症发生发展和诊断中已经显示出较大的潜力[16,43-46,93-95]。作为这一方向被研究最多的lncRNA,NEAT1已被证明是let-7a、let-7b-5p、miR-330-5p、miR-370-3p、miR-124、miR-125、miR-17-5p、miR-165p、miR-93-5p、miR-370-3p、miR-144-3p、miR-944、miR495-3p、miR-22-3p、miR-31-5p和miR-590-3p的分子海绵[22,96-97]。通过阻断这些miRNA, NEAT1可以影响脓毒症发病过程中的几个分子通路。它可通过增强免疫反应和靶器官的相关损伤参与脓毒症相关的多器官损伤过程。lncRNA 和miRNA可以改善脓毒症时靶器官的不良病理事件,特别是心脏和肾脏[45,98-101]。它们似乎有潜力成为脓毒症早期诊断和治疗的靶点。然而,这一领域尚未成熟,需要在更多的动物模型和细胞系中进行验证。
脓毒症具有早期表现出免疫过度激活、晚期表现出免疫抑制的特点。因此,本文认为,具有抗炎活性的miRNA在脓毒症早期可能对机体是有益的,但在脓毒症晚期时其可能是有害的。然而,具有促炎活性的miRNA在早期脓毒症中可能是有害的,但在晚期脓毒症中可能是有益的[102]。
circRNA作为新发现的非编码RNA,与炎症、免疫抑制和内皮功能等各种分子反应有关,并且在脓毒症的进展过程中发生显著的改变。circRNA对核酸外切酶具有很强的抵抗力并且在血液中有较高的稳定性,故其显示出作为生物标志物的优秀潜力。circRNA的血清水平升高后,其平均半衰期为 48 h,而血清中其他线性非编码RNA的半衰期约为10 h。此外,circRNA还具有组织特异性和发育阶段特异性。circRNA/miRNA/mRNA轴在多种疾病中的调控功能已经得到证实,其中包括脓毒症。circRNA已被证实可通过海绵化miRNA来调节脓毒症的进展。然而,对circRNA参与调节的脓毒症诱导的器官衰竭的理解仍处于较早期的阶段,尚未在临床中广泛应用。因此,迫切需要进一步的研究来证实circRNA在不同疾病进展中的调节作用,并确定某种疾病存在的特定circRNA[103]。
脓毒症是一种危急重症,任何一种治疗方案都应兼顾有效性和及时性,尽可能地减少脓毒症所带来的严重并发症。由于脓毒症相关并发症的病因还不完全清楚,因此须对不同类别的非编码RNA进行高通量测序来发现脓毒症背景下这些转录产物之间的复杂网络。