金属有机骨架材料的超级电容性能研究
2023-12-23汤继俊高贵成
汤继俊,高贵成
(江苏科技大学 材料科学与工程学院,镇江 212100)
化石燃料是保障当代社会经济和技术快速发展的重要能源.但是,近几十年来,随着经济和人口的快速增长,巨大的全球性能源消耗与使用,使得化石燃料一度难以维持.此外,对传统化石燃料的过度使用,也引发了一系列的较为严重的环境问题.在这种能源和环境的双重危机压力之下,亟需一次技术革命来减少和达到循环利用的目的,或者取代化石燃料的使用.而高效的能源转换和能源储存是此次技术革命的关键,这极其依赖于电化学反应的能源转换和储存.高效的电催化可以减少二氧化碳的排放,以及用于储能的电池和超级电容器中的离子循环[1-3].近几十年来,一种新型的功能性多孔材料——金属有机骨架(Metal-Organic)有机配体杂化而形成,又称金属有机配位聚合物,具有周期性的网状结构,在配位化学领域中发展十分迅速.
金属有机骨架(MOFs)材料,它是由过渡金属离子和有机配体通过自行组装形成的多孔晶状结构材料,除了周期性的网络状结构,MOFs材料还具有非常多的特性,诸如:较高的孔隙率、较低密度、大比表面积、孔径可调、种类丰富的拓扑结构、可裁剪性、化学可修饰[4]等.与常见的无机有机材料相比,MOFs 材料具有合成条件易控[5-10]、合成条件多样和配位聚合物发展迅速[11]等特性.
超级电容器[12](SCs)是近年来受到关注的能源器件,储能方面优于传统的电容但差于二次电池,但是它的优势在于比电容、功率密度和稳定性等都远远高于传统的电容器件,同时还有使用寿命长、可逆性好、环境友好等优势[13],在电子联络、能源化工、航空航天等方面应用广泛[14].
研究表明MOF材料制备超级电容器主要有3种方法:① 单体MOF材料直接制备电极材料.单体MOF制备的电极材料的稳定性和电化学性能往往不够理想[15].② MOF复合材料制备的电极.将MOF材料和碳颗粒或者其他导电化合物掺杂在一起制备复合材料,碳基的加入有利于导电性能的改善.③ MOF衍生物.MOF的衍生物种类很多,如衍生碳材料,衍生金属纳米杂化物[16].
文中采用热溶法制备Co-MOF、Ni-MOF、Co-Ni-MOF材料,在了解各反应物的性能与特点后,通过对制备出的MOF材料进行XRD、红外等测试对其进行定性定量分析;然后将制备的MOF材料碳化处理后制作成电极材料,进行超级电容器的CV、GCD、EIS等电化学性能测试,来检验 MOFs 系列材料应用于超级电容的可能性.
1 实验
1.1 实验药品及实验仪器
1.1.1 实验药品
对苯二甲酸(PTA),分析纯(99.0%);六水合硝酸钴(Co(NO3)2·6H2O),分析纯(99.0%);N,N-二甲基酰胺(DMF),分析纯(99.0%),均购自于国药集团化学试剂有限公司;溴化钾(KBr),分析能(99.9%),国药集团化学试剂有限公司;六水合硝酸镍(Ni(NO3)2·6H2O),分析纯(99.0%),购自于南京集团化学试剂有限公司;N-甲基吡咯烷酮(C5H9NO),AR分析纯(99.6%),购自于济南智鼎商贸有限公司;氢氧化钾(KOH),光谱纯(≥95.0%),购自于河南华硕化工产品有限公司;无水硫酸钠(Na2SO4),分析纯(99.0%),购自于眉山市金利化工有限公司:盐酸(HCl),分析纯(38.0%),购自于上海苏懿化学试剂有限公司;无水乙醇(CH3CH2OH),分析纯(99.7%),购自于成都市科隆化学品有限公司.
1.1.2 实验仪器
真空干燥箱(DZF)购自于在上海雷韵实验仪器制造有限公司;超声波清洗器(KQ3200V)购自于昆山超声仪器有限公司;傅里叶变换红外光谱仪(FTIR,Nicolet IS10)购自于美国Thermmo Fisher有限公司;X射线衍射仪(XRD,XRD-6000)购自于日本岛津公司;马沸炉(KSG-12-12)在上海实焰电炉厂使用;蓝电电池测试系统(CT2001A)使用的是武汉市蓝电电子股份有限公司的产品;离心机(TG16)使用的为上海卢湘仪离心机仪器有限公司的仪器.
1.2 实验方法及步骤
1.2.1 MOFs材料的制备
(1) Ni-MOF的制备
分别称量2.33 g(8 mmol)Ni(NO3)2·6H2O和0.665 g(4 mmol)对苯二甲酸(H2BDC)于烧杯,用专用量筒量取30 ml DMF溶液,置于另一烧杯中,用一次性塑料滴管吸取0.5 ml盐酸溶液,置于DMF溶液中,混合均匀后转移至盛放反应物的烧杯中,超声混合,最后得到深绿色溶液.把得到的溶液转移至50 ml的反应釜中,要保证溶液含量不超过其2/3,设置烘箱温度为180 ℃,静至时间为24 h,反应后自然冷却至室温,将反应釜中生成物转移至离心管中,先用DMF溶液洗涤,再换成无水乙醇洗涤3次,离心3次,60 ℃ 温度下真空干燥10 h以后得到浅绿色固体.
(2) Co-MOF的制备
分别称量2.34 g(8 mmol)Co(NO3)2·6H2O和0.665 g(4 mmol)对苯二甲酸(H2BDC)于烧杯,用专用量筒量取30 ml DMF溶液,置于另一烧杯中,用一次性塑料底管吸取0.5 ml盐酸溶液,置于DMF溶液中,混合均匀后转移至盛放反应物的烧杯中,超声混合,最后得到紫红色溶液.把得到的溶液转移至50 ml的反应釜中,要保证溶液含量不超过其2/3,设置烘箱温度为185 ℃,静至时间为20 h,反应后自然冷却至室温,将反应釜中生成物转移至离心管中,先用DMF溶液洗涤,再换成无水乙醇洗涤3次,离心3次,60 ℃温度下真空干燥10 h以后得到浅紫色固体.
(3) Co-Ni-MOF的制备
分别称量1.66 g(4 mmol)Co(NO3)2·6H2O和1.16 g(4 mmol)Ni(NO3)2·6H2O及0.665 g(4 mmol)对苯二甲酸(H2BDC)于烧杯,用专用量筒量取30 ml DMF溶液,置于另一烧杯中,用一次性塑料底管吸取0.5 ml盐酸溶液,置于DMF溶液中,混合均匀后转移至盛放反应物的烧杯中,超声混合,最后得到浅灰色溶液.把得到的溶液转移至50 ml的反应釜中,要保证溶液含量不超过其2/3,设置烘箱温度为180 ℃,静至时间为24 h,反应后自然冷却至室温,将反应釜中生成物转移至离心管中,先用DMF溶液洗涤,再换成无水乙醇洗涤3次,离心3次,60 ℃温度下真空干燥10 h以后得到土黄色固体.
1.2.2 MOF衍生碳材料的制备
准备3个坩埚,用酒精擦洗干净,将制备干燥的3种MOF材料转移到坩埚之中,封装好后转移到管式炉之中,设置升温程序为:① 升温到30 ℃,用时10 min;② 升温到800 ℃,升温速率为5 ℃/min;③ 在500 ℃保持3 h;④ 从该温度开始下降至30 ℃,降温速率为3 ℃/min;⑤ 当温度到达30 ℃以后关闭管式炉,冷却至室温后取出样品,即得到3种MOF的碳化物.
1.2.3 电极材料的制作
裁剪出3块2 cm×1 cm的泡沫镍备用,将碳化物∶乙烯乳液(PVDF)∶碳黑按照8∶1∶1的质量百分比依次称取,于研钵中研磨混合均匀后,滴加N-甲基吡咯烷酮(NMP)形成糊状液体,当其在研钵中不会滑动即为合格,这时就可以把糊状物均匀涂覆在准备好的泡沫镍表面,每片泡沫镍上的涂覆物的量保持在1 mg左右,放置在烘箱中,抽真空60 ℃下干燥8 h,待彻底干燥后用压片机制成0.1 mm左右的片层.
1.3 材料结构表征及电化学性能测试
1.3.1 样品的结构表征
采用X射线衍射(XRD) 分析MOFs的结晶情况、结晶种类和性能鉴定,还可以测定结晶度和取向情况,其中辐射源CuKα(λ=0.154 18),设置扫描范围为5°~80°,扫描速度为5 °/min.采用红外光谱(FTIR)来分析所制备MOFs材料的官能团和化学键的种类,按ASTMO法测定,能量比为E4000/Emax>70%,设置扫描范围:4 000~500 cm-1,设置光谱分辨率:优于0.5 cm-1、波长精度:0.01 cm-1、波长准确度:0.1 cm-1.
1.3.2 电化学性能测试
在 CHI670D电化学工作站上通过三电极体系测试电化学性能.通过循环伏安法(CV),恒流充放电(GCD),交流阻抗(EIS),蓝电等检测技术来检验制备电极的电化学性能.其中CV和GCD 实验的电位窗口设定成 -0.4~0.5 V,扫描速率设置为5~50 mV/s.交流阻抗测试的频率为0.01~100 kHz,交流信号振幅设定为5 mV.在电容性能测试中,参比电极为Hg/HgO电极、对电极为铂丝电极,电解液分别采用0.1 mol/L 的KOH溶液和0.1 mol/L的硫酸钠溶液,工作电极为利用热溶剂热法制备的Co-MOF、Ni-MOF、Co-Ni-MOF的电极材料.
2 结果与分析
2.1 化学结构分析
2.1.1 XRD图谱分析
为了检测MOF样品制备是否正确,通过XRD衍射测试来检验样品的结晶程度.
观察图1(a)可以发现,3组MOF样品的谱图都有尖锐峰,且被隆拱起,隆峰之上还有突出峰的存在,说明制备的样品为晶态与非晶态两相共存的结构,将实验制备的MOF材料的谱图与文献提供的标准谱图比较之后可以看到,两者的几个特征峰的位置基本上是相似的,只是样品的杂峰较多,说明在制备过程中杂质的残留较多.图1(a)的衍射峰也相对来说更加尖锐明显,2θ的值大约为8°的位置的特征峰非常明显,强度较大,说明有一定的晶体合成,但不够完善;值得注意的是双金属的尖锐峰的高度明显高于两个单金属的最强峰,由此可以推断合成的双金属MOF的结晶度优于另外两个单金属.但是特征峰后的基线不够平缓,以及较多细小杂峰的存在表明,双金属合成物中依旧有非晶态结构的存在.

图1 3组MOF材料的实际XRD图谱和标准XRD图谱
2.1.2 红外光谱分析
为了进一步分析制备的3种MOF样品中的官能团种类,故而进行红外分析.
观察图2中可知,3组MOF样品的红外谱图吸收峰大部分分布在官能团区,有为数不多且不是很明显的吸收峰在指纹区.图2(a)中在官能团区,C-O键的两个吸收峰分别位于1 384 cm-1和1 405 cm-1处,可以合理推测这是试验的原料H2BDC中的羧基,验证了有机配体的存在;在指纹区与官能团区的交接范围的688 cm-1处是对苯二甲酸的酯基C=O双键的振动吸收峰;而在指纹区的583 cm-1处对应的应该是Ni-O键的振动,说明此试验过程中羧基中的氧原子和Ni+结合,这也就验证了Ni-MOF样品成功合成材料.图2(b)中,在3 440 cm-1处的吸收峰表示的是O-H键的伸缩振动,说明样品中有水分子的存在;在1 665、1 625和1 408、1 406 cm-1处的峰的图像都十分尖锐,分别对应芳环的C=C键和羧酸盐,所以可以合理推测此样品中有实验样品的H2BDC中的苯环的C=C键和羧基的存在,说明有机配体以及链接到金属中心;1 665、1 625和1 408、1 406 cm-1处着对应C=O伸缩振动;另外,590 cm-1处的特征峰对应的是C-H键的弯曲振动.

图2 3组MOF材料的傅里叶红外光图谱
观察图2(c)可知,在748 cm-1处对应的为对苯二甲酸酯的特征峰;在823 cm-1处的特征振动吸收峰对应的是芳香族酯键;需要注意的是,在979~1 600 cm-1范围内谱图上的峰的个数较多,可以合理地推测在此范围内有官能团或化学键较多,979 cm-1和1 015 cm-1处的吸收峰对应的是酰胺的O=C-N键的双峰;1 093 cm-1和1 145 cm-1处为芳香族的酯的C-O键;1 356 cm-1处为其他未共轭的酯的C-O键;1 420 cm-1处对应的是-CH3的振动吸收;1 496 cm-1处为羧基结构,样品中有对苯二甲酸中的羧基存在;1 600 cm-1处的特征峰是芳环上的C=C双键的振动吸收;峰值为1 692 cm-1的波动为酯基的C=O键的振动吸收;在3 605 cm-1处的吸收峰较为微弱,对应的是-OH的振动吸收.
2.2 电化学性能测试结果分析
2.2.1 循环伏安法(CV)测试
如图3,将3组MOF衍生碳材料在碱溶液(KOH)和盐溶液(Na2SO4)中的CV曲线进行对比,首先可以直观地看到,3组材料的曲线有着相同的规律,即在盐溶液中的曲线不够对称,且与矩形形状也有一些偏差,但循环伏安闭合曲线围成的面积越大,表明电极储存电容的性能更好.
而在碱性溶液中,CV闭合曲线呈现的对称性能更好说明该反应有良好的可逆性.但是当电解液是盐溶液时,材料的氧化电位和还原电位更好,电极可逆性也就一目了然,此时的电极可逆性能更优良.需要注意的是,氧化还原峰在不同的电解液中都有所体现.
如图4,将3组材料的循环伏安曲线进行对比就会发现,无论是在KOH溶液还是Na2SO4溶液中,Ni-MOF的电容储存性能都是最好的.盐溶液中,3类材料都表现出了氧化还原峰,但是Ni-MOF的特征电位更加符合要求,氧化还原峰所覆盖的面积更大,此电极的电化学可逆性更好.KOH溶液中,Ni-MOF围成的闭合曲线面积更大一些,氧化还原峰也更明显,可以判断出Ni-MOF中独具特色的多孔结构有利于减缓放电容量的下降速度.结合图3可知,Ni-MOF的衍生碳材料在Na2SO4溶液中的电容储存能力最好.
2.2.2 恒流充放电(GCD)测试
图5将3组MOF的衍生碳材料在电流密度为1 A/g时的充放电曲线进行对比,图5(a~c)分别是3种MOF衍生碳材料在电解液是KOH溶液和Na2SO4溶液进行比较,可以清楚地看出在盐溶液中的充放电时间均大于KOH溶液,但是碱性溶液的GCD曲线的对称性仍旧是完好的,其内阻和储电容能力都还是理想的,只是如果是做对比的话,就没有在盐溶液中表现出来的电容性好.图5(d)将6条曲线进行对比,碱溶液中的Co-MOF碳化物电极的电容性最不理想,它的充放电时间最短,而且有充电平台的存在,与对应的CV曲线中的氧化还原反应电位一致,说明充放电过程总体来说是稳定的.其次就是碱溶液中的Co-Ni-MOF和Ni-MOF的碳材料制备的电极,两者的电容性能相近.之后就是盐溶液做电解液的Co-MOF和Co-Ni-MOF碳化物的电极材料,两者的曲线十分相似,具有理想的对称性和线性关系.综上所述,以Na2SO4溶液为电解液的Ni-MOF碳化物制备的电极材料的电容性能最好,它的放电时间是同样以盐溶液作电解液的Co-MOF和Co-Ni-MOF的电极材料的3倍,不过也要注意到此时的GCD曲线的对称性有些许的不完美.
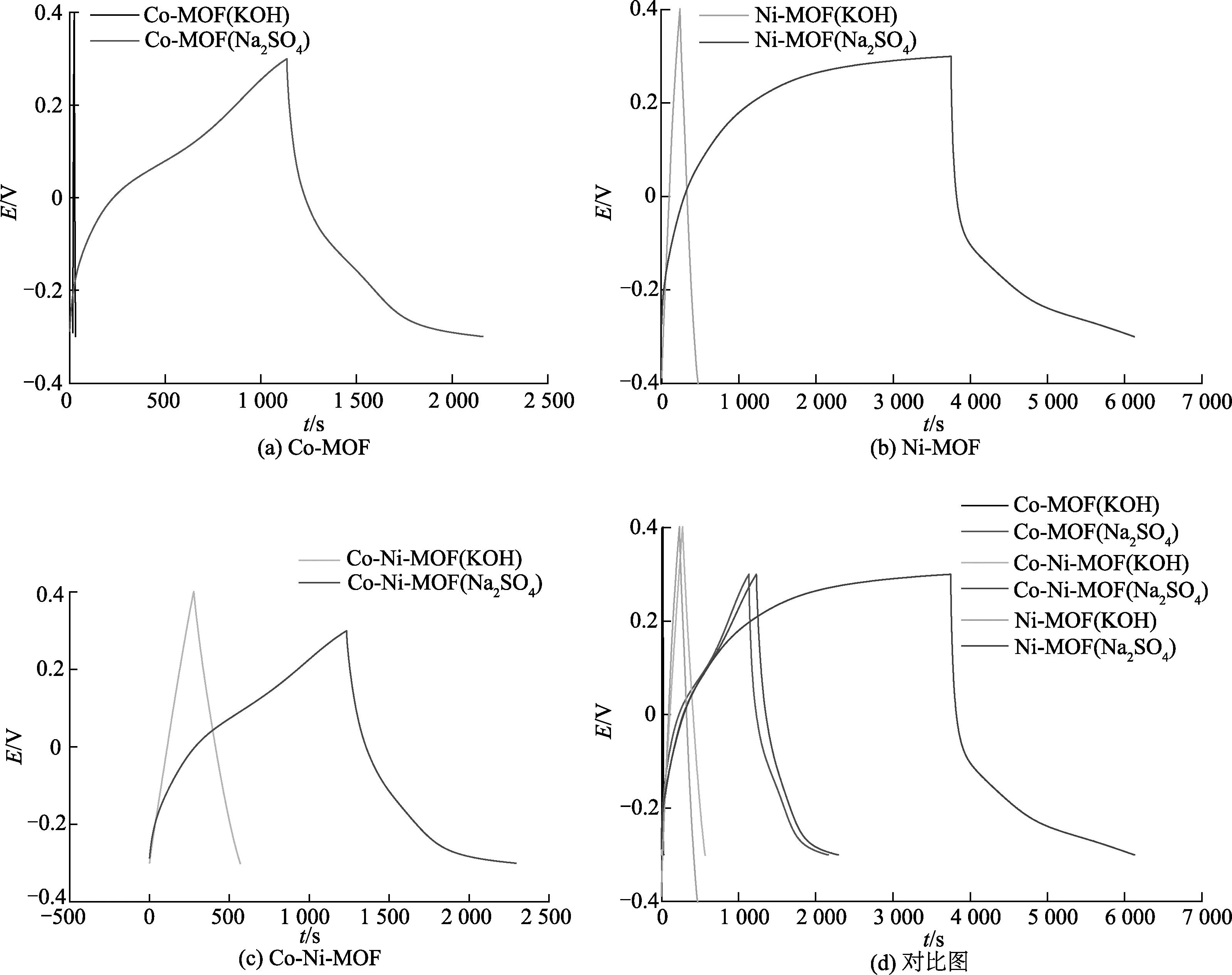
图5 3组MOF衍生碳材料在不同电解液中的恒流充放电曲线
2.2.3 交流阻抗测定
如图6,不同电解液中电极材料的交流阻抗也有所不同.观察图6(a,c,e),不同的电极材料在高频区,Na2SO4溶液中的电极的电子转移电阻更小,而且盐溶液中的曲线图都有一个半圆弧,这充分说明电子在盐溶液作电解液时,电极表面的电荷传递速率更快.观察图6(b,d,f),虽然是不同的电极,但是在低频区,都是盐溶液中的曲线斜率更接近于90°,如果可以达到90°,那么此时制作的电极就达到了完美的离子扩散,但实际上往往由于“弥散效应”的存在,斜线的角度会沿着小于90°的方向急剧增加[17-18].而在KOH溶液中的曲线图更近似于一条直线,这说明电荷从Na2SO4溶液中电极表面的扩散电阻小于KOH溶液中的电阻.需要注意到的是Co-MOF的衍生电极材料的阻抗在低频区时是盐溶液的阻抗更小,在高频区是碱溶液的阻抗更小.但是从整体图来看的话,还是盐溶液的图像更加符合要求.
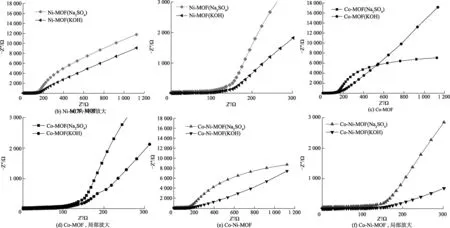
图6 3组MOF衍生碳材料在不同电解液中的交流阻抗和局部放大图
如图7,将相同电解液中的电极材料进行对比可以看到,在Na2SO4溶液中3种材料的曲线都有经典的扩散半圆弧和直线,这可能是MOF材料的多孔结构引起的,并且7(a)图中Ni-MOF和Co-Ni-MOF碳材料的电极形成的半圆半径基本一致且小于Co-MOF,说明前两者的电荷转移电阻小于后者,电极电化学反应的电流密度更大.这说明Co-Ni合金的MOF的材料电容性优于单金属的Co-MOF,不可否认,双金属MOF有助于提高材料对电荷的电导率,可以加快离子的迁移速率.图7(b)中,就KOH溶液中的3条曲线在低频区也有不是很明显的圆弧,高频区的图像都近似于直线,故而变现出来的电容性能也就不够理想.综合以上分析,通过交流阻抗的分析,以Na2SO4溶液为电解液的Ni-MOF碳化物制备的电极材料有最小的内阻和较高的电荷电导率,展现出最好的电化学性能.

图7 3组MOF衍生碳材料在相同电解液中的交流阻抗对比图
2.2.4 蓝电测试
为了更直观地比较3组电极材料的电化学性能,进行蓝电测试,从图8可以看到,碳化钴的第一次的充放电后放电比容量是47.6 (mA·h)/g,而Ni-MOF和Co-Ni-MOF碳化物首次充放电后放电比容量却达到了63.3、62.2 (mA·h)/g,与前两者有很明显的一段差距,可见Ni-MOF碳化物材料的放电比容量最好.
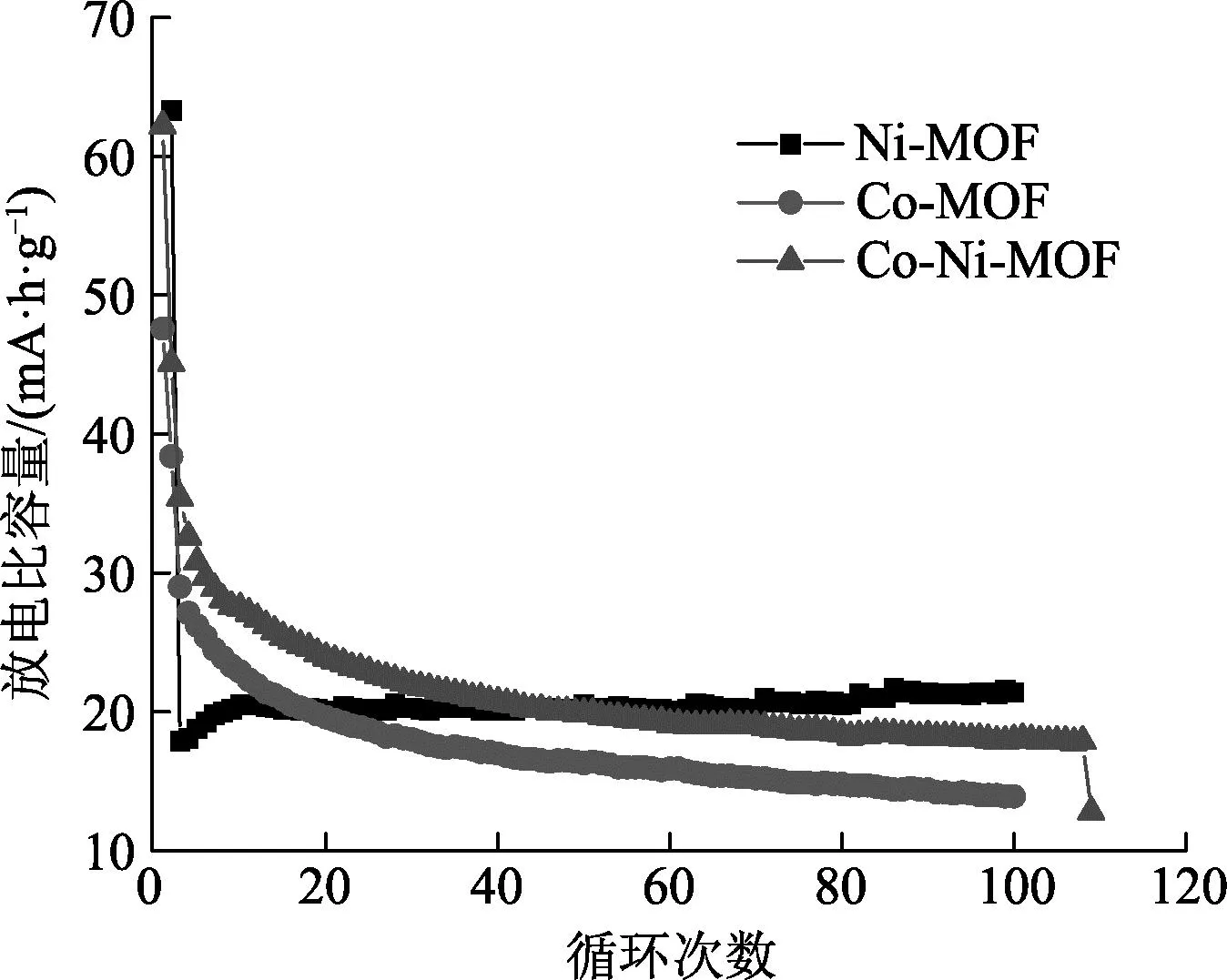
图8 3组MOF衍生碳材料对应的放电比容量示意图
3组材料在刚开始的循环中,比容量迅速下降,可能是因为在进行了太多次实验后,碳化物和泡沫镍之间的粘结开始松散,在进行测试的时候碳化物脱落.当电极表面与电解液反应形成钝化膜以后,进而使输出电压降低,这可以阻隔电极表面的反应的进一步发生,所以在一定循环次数以后,材料的放电比容量才会接近平缓.
3 结论
本实验利用热溶法成功制备了Co-MOF、Ni-MOF、Co-Ni-MOF 3组材料,通过对产物进行 XRD 测试和红外光谱测试来检测其合成情况,对其微观结构和化学性质进行定性定量分析,证实其结晶效果理想、粒径小、比表面积大.
对其衍生碳材料进行电化学测试的结果为:在CV测试中盐溶液中的Ni-MOF的曲线表示的电容量最大,GCD测试中以Na2SO4溶液作电解液的Ni-MOF材料的充放电时间最久,EIS测试结果表明Ni-MOF在盐溶液中的阻抗最小,曲线斜率更符合要求,而蓝电测试的结果直接展示出盐溶液中的Ni-MOF的放电比容量最高.综合各项测试结果,3组材料在Na2SO4溶液作电解液时电化学性能均优于KOH溶液,在Na2SO4溶液作电解液时各衍生碳材料的电化学性能为Ni-MOF>Co-Ni-MOF>Co-MOF.
