泉州湾桐花树和老鼠簕根际土壤细菌和真菌群落特征比较
2023-12-22郑智胜黄卫红陈小尘黄兆斌薛喜枚陈锦江张秋芳
郑智胜,黄卫红,陈小尘,黄兆斌,薛喜枚,陈锦江,张秋芳*
(1.泉州师范学院海洋与食品学院,福建 泉州 362000; 2.中国科学院城市环境研究所,福建 厦门 361021; 3.泉州桐青红树林技术有限公司,福建 泉州 362000)
根际土壤微生物是植物与土壤之间最重要的联接者,对土壤元素循环和植物营养、植物健康及其对环境适应性等至关重要[1]。受植物影响,所形成的“根际效应”可以招募适合该生境下的土壤微生物群体[2],在植物地上部、根际分泌物、土壤理化性质等因素共同作用下,不同植物物种可以形成独特的根际土壤微生物群落[3-4]。细菌和真菌是组成根际土壤微生物的最主要类群,两者在生态系统中的功能不同,细菌拥有更广泛的代谢类型,通过自养方式固定大气中的碳和氮,而真菌大多数为异养生物,更为依赖现有的环境资源,且两者对植物和土壤的变化响应也存在明显差异[5-7]。
红树林分布于潮间带,具有防风消浪、降解污染和维护生物多样性等功能[8]。近年来,红树林湿地生态系统正在遭受严重威胁[9-10],而红树植物与根际土壤微生物之间互作对于维持红树林生态平衡尤为重要[11],对调节近海污染环境恢复和生态功能等发挥着关键作用[12],红树林微生物组学的研究是红树林生态功能研究的热点和难点[13]。紫金牛科(Myrsinaceae)的桐花树(Aegicerascorniculatum)和爵床科(Acanthaceae)的老鼠簕(Acanthusilicifolius)是滨海地区两种具有重要生态功能的红树物种,且皆为重要海洋药用植物,桐花树根部富含多糖类物质[14],老鼠簕根部则以生物碱为主[15],两者根部活性物质成分的差异可能会影响其根际土壤微生物群落组成。目前已明确了几种红树植物根际土壤微生物特征,但研究中多聚焦于细菌群落[16-19],对具有重要生态功能的真菌研究还较少见,对桐花树和老鼠簕根际土壤细菌和真菌多样性及其与环境因子之间的关系还有待进一步研究。
本研究以细菌16S rRNA基因和真菌ITS基因为分子标记,借助高通量测序技术分别对桐花树和老鼠簕根际土壤细菌和真菌群落组成进行分析,明确两者根际土壤微生物群落结构特征及其与土壤理化性质之间的关系,进而为探明两者对近海微生物生态功能影响以及相关功能微生物资源的挖掘和利用提供科学依据。
1 材料与方法
1.1 样品采集和前处理
采样区域位于福建泉州湾河口湿地自然保护区的红树林湿地(24.949°N,118.686°E),属亚热带海洋性季风气候,年平均气温20.4 ℃,年平均降水量1 095.4 mm,土壤类型以海滨盐土为主,拥有丰富的红树植物物种类型,是重要的湿地资源。分别选取该地区具有代表性且长势均匀的红树植物桐花树和老鼠簕为研究对象(采样区域为人工林,两物种分片区生长,桐花树树龄为21 a,植株高约3~4 m;老鼠簕树龄为12 a,植株高约1.5 m)。为降低不同海岸线退潮时间差异的影响,在完全退潮时,垂直于海岸,从岸边向海(由近到远)方向,每个区域以每10 m为间隔,分别选取4排平行线,每排平行线取4棵长势相同红树植株,挖取每株3条健壮根系,清除易脱落根部土壤,只有粘附在根系上的土壤才被认为是根际土壤[20],之后将带有根际土壤的根系装入无菌自封袋低温保存,及时运回实验室后,用无菌水振荡离心后收集根际土壤,将采集到的同一平行线上根系泥土混匀后做为一个样品。桐花树根际土壤的4个重复样品命名为AC组(从岸边向海依次为AC1、AC2、AC3和AC4);老鼠簕根际土壤样品为AI组(从岸边向海依次为AI1、AI2、AI3和AI4)。振荡离心后将收集的8份根际土壤各分为两份:一份经过低温冻干研磨过2 mm筛后用于土壤总DNA提取;另外一份风干后用于土壤地球化学分析[21]。
1.2 根际土壤微生物DNA提取和PCR扩增
称取低温冻干的土壤样品0.5 g,采用FastDNA Spin Kit (美国MP Biomedicals公司)试剂盒提取总DNA,提取步骤根据试剂盒说明书进行。QubitTM4 Fluorometer (美国Thermo Fisher公司)用于检测DNA的含量和质量。用带Barcode条形码的引物扩增细菌16S rRNA基因的V5—V8序列,第一轮引物为799F(5′-AACMGGATTAGATACCCKG-3′)和1392R(5′-ACGGGCGGTGTGTRC-3′),第二轮引物为799F(5′-AACMGGATTAGATACCCKG-3′)和1193R(5′-ACGTCATCCCCACCTTCC-3′)[22]; 扩增真菌ITS基因是带Barcode条形码的引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)[23]。16S rRNA基因PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s(第一轮27个循环,第二轮13个循环),72 ℃ 10 min;ITS基因PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s(30个循环),72 ℃ 10 min。最后将通过琼脂糖凝胶电泳检测得到明亮条带的PCR产物,在MiSeq PE300测序仪(美国llumina公司)上进行高通量测序(由上海美吉生物医药科技有限公司完成)。
1.3 土壤理化测定
称取风干土壤10.0 g,溶于25 mL 1 mol/L KCl 溶液,振荡30 min后用pH计测定土壤pH[21];有效磷(available phosphorous, AP)含量采用碳酸氢钠溶液浸提后利用钼锑抗比色法进行测定[21];速效钾(available potassium, AK)含量采用乙酰胺溶液浸提后使用原子吸收分光光度计A3(北京普析通用仪器有限责任公司)进行测定[21];铵态氮(ammonium nitrogen, NH3-N)含量采用氯化钾溶液浸提后利用靛酚蓝比色法测定[21];总酚(total polyphenol, TPP)含量采用焦磷酸钠溶液浸提后利用福林酚法测定[24];利用Elementar元素分析仪(德国Vario MAX公司)对土壤总碳(total carbon, TC)、总氮(total nitrogen, TN)、总硫(total sulfur, TS)含量进行测定。
1.4 数据分析
在上海美吉生物医药科技有限公司提供的云平台(https://cloud.majorbio.com/)上进行数据分析。将测得的DNA序列经过FLASH v 1.2.11软件进行去杂拼接、去除嵌合体等过滤处理,得到优化序列[22-23]。在Uparse v 11软件平台上将相似性超过97%的序列聚为一个操作分类单位(operational taxonomic units, OTU);采用RDP Classifier v 2.13软件对每一条序列进行物种分类注释,对比SILVA数据库(silva138/16s_bacteria)和UNITE数据库(unite8.0/its_fungi),设置对比阈值为0.7[22-23]。在属水平,利用Mothur v 1.30.2软件计算不同随机抽样下的α多样性指数(Sobs和Ace指数表示群落丰富度,Shannon和Simpson指数表示群落多样性,Coverage指数为文库的覆盖度)。在OTU水平,利用QⅡME v 1.9.1 软件进行β多样性的主坐标分析(principal coordinates analysis, PCoA)[22-23]。物种稀释曲线、物种Venn图分析、物种组成分析和置换多因素方差分析(permutational multivariate analysis of variance, PERMANOVA)、土壤理化性质与微生物群落组成的冗余分析(redundancy analysis, RDA)均由R语言v 4.2.0实现[22-23]。此外,使用R 语言v 4.2.0的vegan和igraph包通过Spearman’s相关系数构建了土壤理化性质与微生物物种的相关网络,并认为Spearman’s相关系数大于 0.6具有统计学意义(P<0.05)[25]。线性判别分析(linear discriminant analysis, LDA)效应大小(LDA effect size, LEfSe)方法用于确定不同样品之间不同分类水平存在显著差异的微生物类群。利用SPSS 25.0 软件的单因素方差分析(One-way ANOVA)的Duncan检验法对不同红树植物根际土壤理化性质、微生物α多样性指数及相关优势菌门和属的相对丰度进行差异性分析。除了微生物物种组成饼图和相关性网络图分别由Origin Pro v 2021和Gephi v 0.9.4 软件进行可视化外,本研究中微生物α多样性箱型图、Venn图、PCoA图和RDA图均由R 语言v 4.2.0进行可视化。
2 结果与分析
2.1 根际土壤理化性质
如图1所示,两种红树植物根际土壤的各理化性质有差异,其中,桐花树(AC组)根际土壤的 pH、总碳和总酚含量皆显著高于老鼠簕(AI组)根际土壤(P<0.05);除此之外,总氮、总硫及有效磷的含量AC组也皆高于AI组,但差异未达到显著水平;AC组的pH趋于中性,AI组的则呈弱酸性;而AC组的速效钾和铵态氮含量低于AI组,同样差异未达显著水平。土壤理化性质的差异可能是由两种红树植物产生的根系分泌物以及根际土壤微生物群落组成结构的差异所造成的。
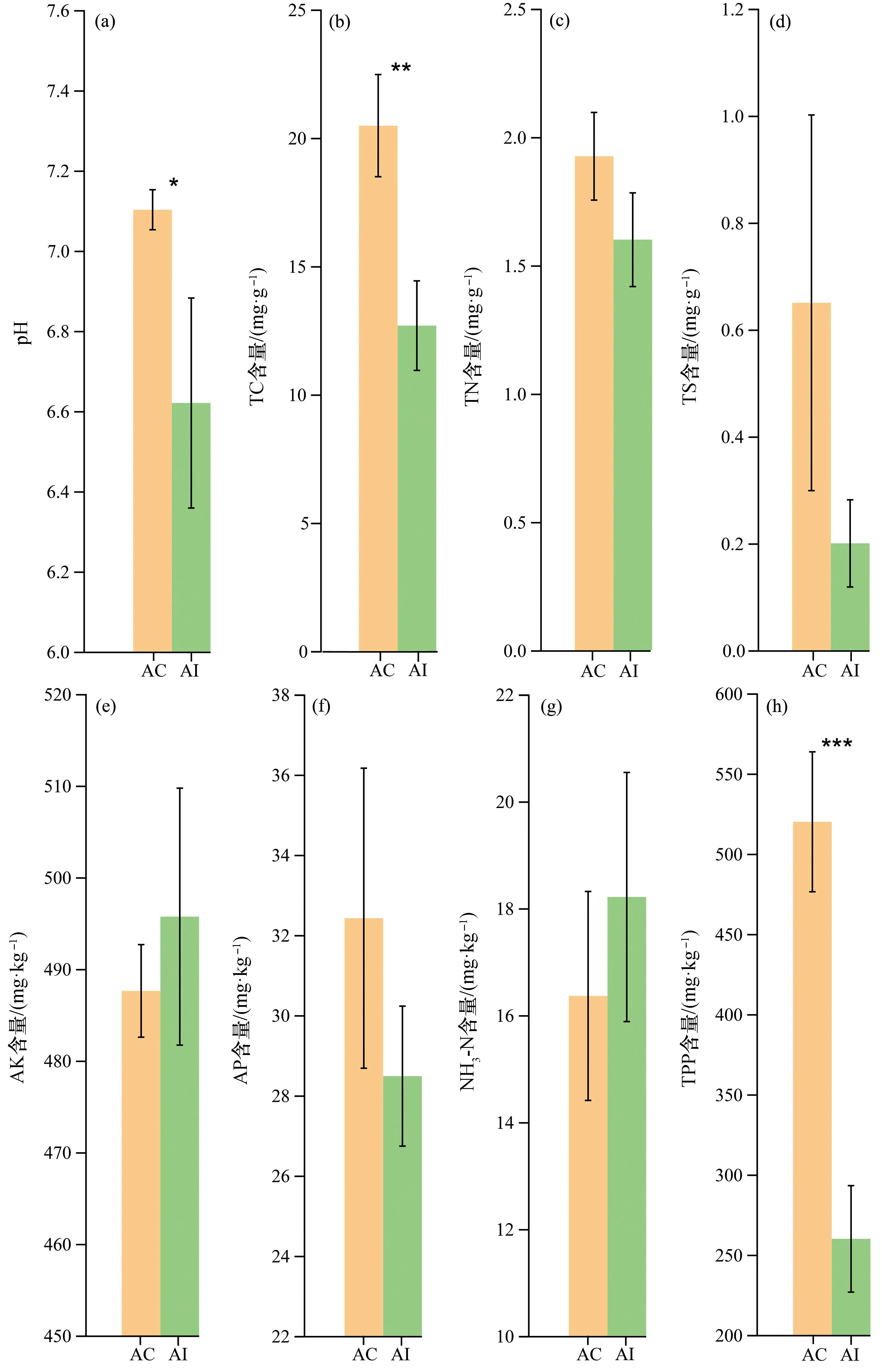
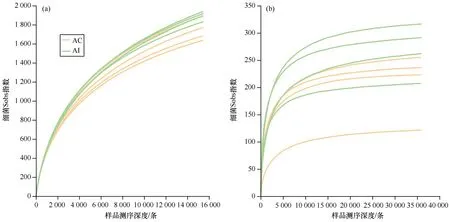
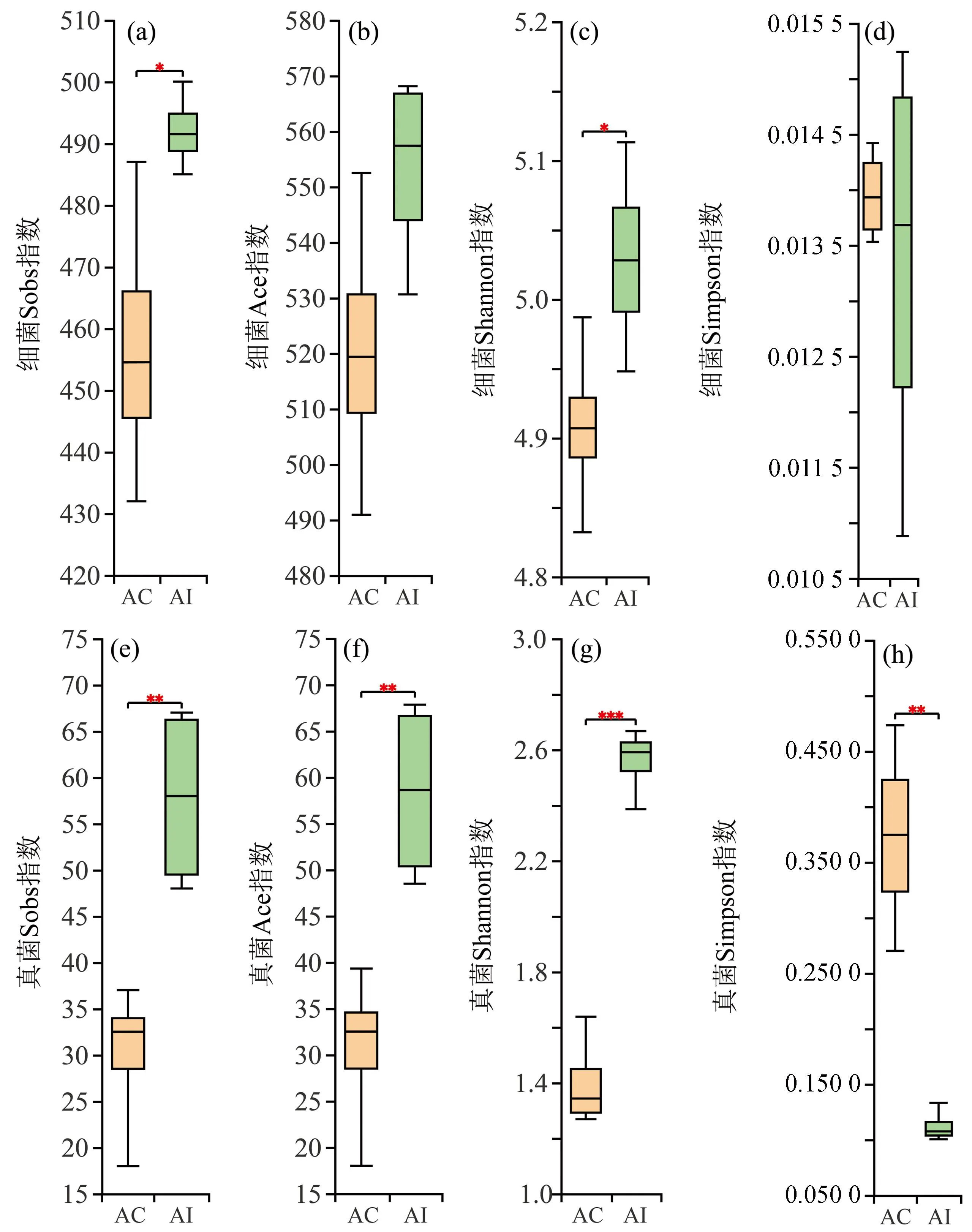
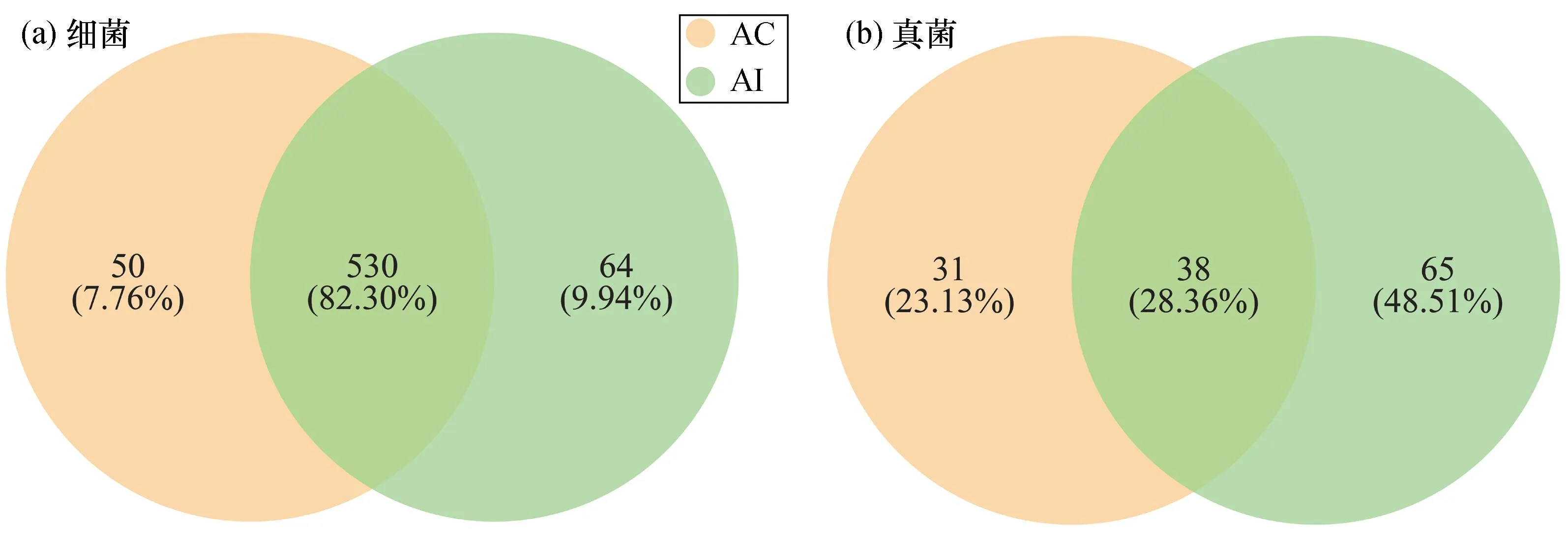
图1 桐花树和老鼠簕根际土壤理化性质比较Fig. 1 Comparison of physicochemical properties in rhizosphere soils of Aegiceras corniculatum and Acanthus ilicifoliusAC:桐花树根际土壤,AI:老鼠簕根际土壤,TC:总碳,TN:总氮,TS:总硫,AP:有效磷,AK:速效钾,NH3-N:铵态氮,TPP:总酚;“*”表示0.01 所有样品中细菌和真菌的最小原始序列数分别为46 559条和36 194条,将细菌和真菌的最小原始序列数应用于同一测序水平下所有样品的比较。如图2所示,所有样品的稀释曲线在急剧上升后皆变为平缓状态,细菌和真菌Coverage指数都大于0.99,说明所有样品的测序深度合理。经分析,所有样品中共含有细菌49个门、123个纲、266个目、414个科、644个属和3 175个OTU,真菌中共含有6个门、20个纲、49个目、93个科、134个属和834个OTU。由图3可知,AI组细菌Sobs、Ace和Shannon指数均高于AC组,而Simpson指数低于AC组,其中两者Sobs和Shannon指数均存在显著差异(P<0.05);对于真菌,AI组的Sobs、Ace和Shannon指数也皆显著高于AC组(P<0.05),但Simpson指数相反(P<0.05)。因此,老鼠簕根际土壤的细菌和真菌群落丰富度和多样性显著高于桐花树根际土壤的;此外,两种红树植物根际土壤细菌群落的丰富度和多样性也皆高于真菌群落的。 图2 桐花树和老鼠簕根际土壤细菌和真菌的稀释性曲线Fig. 2 Rarefaction curves of bacterial and fungal community composition in the rhizosphere soils of Aegiceras corniculatum and Acanthus ilicifolius 图3 属水平下桐花树和老鼠簕根际土壤细菌和真菌α多样性指数比较Fig. 3 Comparison of α diversity indices of bacteria and fungi in the rhizosphere soil of Aegiceras corniculatum and Acanthus ilicifolius at the genus level Venn图可以直观地体现不同样品之间物种组成的特异性和重叠情况。如图4所示,属水平下,共检测到两红树物种根际土壤细菌和真菌物种数量分别为644个和134个。如图4(a)两者根际土壤中共有细菌物种数量530个,占总物种的82.30%;而 AC组和AI组各自特有细菌物种的数量分别为50个(7.76%)和64个(9.94%);如图4(b)两者共有的真菌物种38个,仅占真菌总数量的28.36%,AC组和AI组各自单独存在的真菌物种数量分别为31个(23.13%)和65个(48.51%)。由此可见,红树根际土壤中细菌物种组成比真菌更稳定,两者间真菌物种组成差异大于细菌,且老鼠簕根际土壤真菌物种组成比桐花树根际土壤具更强变异性。 图4 属水平下桐花树和老鼠簕根际土壤细菌和真菌物种Venn图Fig. 4 Venn diagram of bacterial and fungal communities in the rhizosphere soils of Aegiceras corniculatum and Acanthus ilicifolius at genus level 对细菌和真菌群落组成进行分析,选择相对丰度大于1%的物种进行分类,丰度小于1%的物种归为其他(Others)。如图5所示,门水平下,AC组和AI组的细菌被归类到了14个相同优势门,变形菌门(Proteobacteria)皆为第一优势菌,相对丰度分别为44.75%和36.12%,其次是拟杆菌门(Bacteroidota),AC组和AI组的相对丰度分别为14.41%和21.21%,以及脱硫杆菌门(Desulfobacterota),AC组和AI组的相对丰度分别为8.27%和14.64%,而其他优势菌的均低于5.00%。AC组和AI组的真菌都被归类为6个相同优势门,真菌界未分类门(unclassified_k_Fungi, 51.13%)为AC组的第一优势门,而子囊菌门(Ascomycota, 51.04%)是AI组的第一优势门。此外,两者的担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、罗兹菌门(Rozellomycota)和球囊菌门(Glomeromycota)相对丰度皆存在显著差异。表明尽管两者的细菌优势物种的组成和丰度相似性较高,但两者相对丰度存在明显差异。表明两者的细菌优势物种的组成和丰度相似性较高;而真菌优势物种组成种类虽然相同,但两者相对丰度存在明显差异。 图5 门水平下桐花树和老鼠簕根际土壤细菌与真菌群落组成Fig. 5 Bacterial and fungal community composition in the rhizosphere soils of Aegiceras corniculatum and Acanthus ilicifolius in phylum level(a)和(c)分别为桐花树根际土壤细菌和真菌群落组成;(b)和(d)分别为老鼠簕根际土壤细菌和真菌群落组成。 如图6所示, 属水平下,AC组和AI组细菌分别被归类为22个和21个优势菌,其中,AC组中已鉴定的优势属有伍斯菌属(Woeseia,3.48%)、Limibaculum属(1.92%)、硝化螺菌属(Nitrospira,1.50%)、Sva0081_sediment_group属(1.09%)和Denitromonas属(1.73%),AI组中已鉴定的优势属只有伍斯菌属(Woeseia,2.44%)和Sva0081_sediment_group属(1.22%),但两者未鉴定到的物种皆超过了总量的35.00%。对真菌而言,AC组和AI组分别被归类为6个和14个的优势属,AC组中含有的已知优势物种有曲霉属(Aspergillus,7.06%)和小脆柄菇属(Psathyrella,4.86%),AI组中有曲霉属(Aspergillus,9.99%)、小脆柄菇属(Psathyrella,11.41%)、枝孢菌属(Cladosporium,4.28%)、交链孢属(Alternaria,3.98%)、囊状担子菌属(Cystofilobasidium,3.31%)、Lulwoana属(2.38%)和Neodevriesia属(1.04%),另外,未知真菌unclassified_k_Fungi物种和粪壳菌纲未分类的unclassified_c_sordariomycetes属在AC组中相对丰度分别高达51.13%和22.50%,AI组中也达到了15.79%和10.47%,相对丰度均超过10.00%,值得今后进一步研究。以上结果说明,两者根际土壤中,除了存在已被鉴定到的物种外,还含有大量未知细菌和真菌物种需要进一步去挖掘鉴定。 图6 属水平下桐花树和老鼠簕根际土壤细菌与真菌群落组成Fig. 6 Bacterial and fungal community composition in the rhizosphere soils of Aegiceras corniculatum and Acanthus ilicifolius in genus level(a)和(c)分别为桐花树根际土壤细菌和真菌群落组成;(b)和(d)分别为老鼠簕根际土壤细菌和真菌群落组成。 对两红树物种的根际土壤细菌和真菌分别进行PCoA和置换多元方差PERMANOVA分析。基于Bray-Curtis距离算法的PCoA结果表明,细菌的第一和第二轴解释度分别为54.60%和12.32%,总和为66.92%[图7(a)];真菌的第一和第二轴解释度分别为47.10%和18.62%,总和为65.72%[图7(b)]。PERMANOVA分析结果显示细菌(R2=0.499,P=0.036)和真菌(R2=0.464,P=0.030)群落组成差异皆达到显著水平。说明了根际土壤细菌和真菌群落组成因红树植物物种影响而产生了显著差异。 图7 属水平下桐花树和老鼠簕根际土壤细菌和真菌群落PCoA分析Fig. 7 PCoA analysis of bacterial and fungal community in genus level in rhizosphere soils of Aegiceras corniculatum and Acanthus ilicifolius 采用LEfSe方法分析两红树植物之间根际土壤微生物在不同分类水平上的相对丰度在统计学上达显著差异的菌群。如图8(a)所示,与AI组相比,AC组有5个细菌谱系物种显著富集,如变形菌门中的γ-变形菌纲(Gammaproteobacteria)、伯克氏菌目(Burkholderiales)和Denitromonas属;硝化螺菌门的硝化螺菌目(Nitrospirales)和硝化螺菌属等。与AC组相比,AI组有4个谱系物种显著富集,如脱硫杆菌门的脱硫杆菌纲(Desulfobulbia)、脱硫杆菌目(Desulfobulbales)和脱硫杆菌科未分类属(norank_f_Desulfobulbaceae);拟杆菌门的Labilibacter属、Flavobacterium属和Gramella属等。如图8(b)真菌中,AC组只有1个谱系即unclassified_k_Fungi门下未分类的菌群含量显著高于AI组,而AI组有8个谱系物种显著富集,包括子囊菌门的座囊菌纲(Dothideomycetes)、煤炱目(Capnodiales)、枝孢菌科(Cladosporiaceae)、枝孢菌属、Lulwoana属和Colletotrichum属等;担子菌门中的银耳纲(Tremellomycetes)、银耳目(Tremellales)和囊状担子菌属等。 图8 根际土壤细菌和真菌LEfSe分析的进化分支图Fig. 8 Linear discriminant analysis (LDA) effect size taxonomic cladogram of the discriminants comparing bacteria and fungi in the rhizosphere soils 图中LDA值>3.5。 微生物群落组成与土壤理化性质关系的RDA冗余分析结果表明,细菌和真菌的RDA前两轴累计方差解释比分别为75.21%[图9(a)]和68.82%[图9(b)]。其中,pH(P=0.033)和TPP含量(P=0.041)显著影响细菌群落组成,而TC含量(P=0.045)和TS含量(P=0.017)则显著影响真菌群落组成。 图9 根际土壤细菌和真菌群落组成与土壤理化性质的冗余分析Fig. 9 RDA analysis between soil bacterial and fungal community composition and environmental factors 属水平上,土壤理化性质分别与相对丰度在前50的细菌和真菌物种进行相关性网络分析。结果表明:对细菌[图10(a)]而言,pH对最多数量细菌物种产生显著影响,其次依次为TC、TN、TS、TPP、AP、NH3-N和AK,其中,土壤理化性质与硝化螺菌属、Denitromonas属和Limibaculum属呈显著正相关,与脱硫杆菌属、Labilibacter属和Draconibacteriu属呈显著负相关;对真菌而言[图10(b)],TPP是对最多真菌物种产生显著影响的因子,其次依次是pH、TC、TN、TS、AK、AP和NH3-N,枝孢菌属、囊状担子菌属、Lulwoana属、Kluyveromyces属和Colletotrichum属等真菌属与土壤理化性质呈显著负相关。总的来说,细菌中受土壤理化性质显著影响的物种数量低于真菌,但与细菌产生正相关的物种数量多于负相关的,而真菌则相反。 图10 根际土壤细菌和真菌物种与土壤理化性质相关性网络分析Fig. 10 Correlation network analysis between the relative abundance of the bacterial and fungal taxa with environmental factors in the rhizosphere soils图中默认显示P<0.05的物种,节点大小表示物种相关性大小,同一颜色的节点隶属于同一个菌门;连线的颜色代表正负相关性,红色代表正相关,蓝色代表负相关。 红树植物桐花树和老鼠簕不仅具有重要生态功能,还可作为重要海洋药用植物资源,根际土壤微生物是联接植物地上和地下土壤重要桥梁,且受植物类型和土壤性质的共同作用,被认为是植物的第二基因组[26]。 本研究发现两种红树植物之间根际土壤细菌和真菌多样性皆存在显著差异,可能与不同红树物种在生长过程中所形成的不同土壤微生态环境有关[27-28],如酸碱度、酚类物质和总碳等在两红树物种根际土壤之间均存在显著差异(图1),Gomes等[19]对白骨壤(Avicenniaschaueriana)和对叶榄李(Lagunculariaracemosa)两种红树植物根际土壤细菌的研究也发现不同红树物种能够对其根际微生物群落组成产生选择性。本研究中桐花树和老鼠簕的根际土壤细菌多样性(Shannon指数为1.0~5.2)低于秋茄(Kandeliacandel)、拟海桑(Sonneratiagulngai)和白骨壤等其他红树物种(Shannon指数为5.6~11.0)[17-18],老鼠簕根际土壤细菌和真菌的多样性和丰富度皆高于桐花树的(图3、4)。通常认为真菌能优先降解大分子有机物质,从而生成可为细菌提供所需养分的小分子化合物[5-7];老鼠簕根部富含小分子生物碱,桐花树则富含多糖类大分子物质[14-15];可以推测老鼠簕根际富集着更多的与降解大分子相关的真菌群落,为细菌群落生长提供更多的小分子化合物,这可能是老鼠簕根际土壤细菌和真菌的丰富度和多样性高于桐花树的重要原因。 根际微生物在生物地球化学元素循环中起着重要作用。桐花树和老鼠簕的根际土壤微生物有着共同的优势菌门和属(图5、6),但相对丰度有所差异,这与之前对其他红树物种的研究结果非常相似[16-19]。土壤pH、TPP、TC、TN和TS是主要影响细菌和真菌物种的环境因子,大多数细菌物种与其呈显著正相关,而真菌则刚好相反(图10)。细菌中,pH是影响细菌物种最主要的环境因子,这与珠江口岸红树林土壤理化因子对细菌影响的结果一致[29]。变形菌门在桐花树和老鼠簕根际土壤中皆为第一优势菌门(图5),在土壤碳、氮和硫循环中发挥着关键作用[30],氮增加会降低土壤细菌多样性从而导致富营养类群变形菌门菌群丰度的提高[31],桐花树根际土壤微生物多样性低于老鼠簕的原因可能与桐花树根际土壤TN的含量高于老鼠簕有关。桐花树根际富集着在氮循环过程中起着重要作用的反硝化菌Denitromonas属和硝化螺菌属[32-33],而老鼠簕根际土壤中富含的拟杆菌门和脱硫杆菌门,能分别促进钾吸收[2]和硫还原[34],由此推测,桐花树根际微生物促氮循环作用可能高于老鼠簕,而老鼠簕根际土壤微细菌与红树植物白骨壤和对叶榄李更有相似性[19],都富集了硫还原的菌群。多酚是影响真菌物种最主要的环境因子,其含量与两红树植物根际土壤的真菌物种呈显著负相关,Sasse等[28]认为在根系分泌物中高含量的酚酸物质可能是导致相关抗真菌物质产生的关键因素,从而推测桐花树根际土壤中高含量酚类物质是导致子囊菌门和担子菌门丰度显著低于老鼠簕的原因。富集的子囊菌门和担子菌门在土壤物质转化和能量传递过程中起着重要作用,子囊菌门多为对降解土壤有机质等大分子物质有着重要作用的腐生菌,而担子菌门常与植物共生形成菌根可促进植物对钾等的吸收和利用[35-36],从图10(b)中也可以看出子囊菌门和担子菌门与速效钾呈显著正相关。由此可见,桐花树和老鼠簕根际土壤中富集着不同功能微生物菌群分别起着不同生态作用。因此,在红树林生态系统应用于生态工程修复建设的过程中,可以参考和结合不同物种红树林所具备的功能微生物组特征对近海区域应用红树植物进行环境修复种植时应因地制宜,对不同物种进行合理配置。 此外,两种红树植物根际土壤中可能含有丰富的微生物药物资源,如共同富含的伍斯菌属,能够在高盐海洋环境下生长且可产生多种抗生素[37],在其他红树植物中也是主要优势菌属[17-18]。老鼠簕根际土壤富集的优势菌属枝孢菌属可作为抗肿瘤药物资源[38]。此外,桐花树根际土壤中富集着大量(大于50%)还未被确定分类的真菌物种(图6),今后可结合其根部高含量多糖等特点[14],进一步探讨该未知真菌物种在多糖物质合成中的作用。因此,桐花树和老鼠簕根际土壤微生物资源可能具有很高应用和开发潜力。 本研究利用高通量测序技术获得的两红树物种根际土壤微生物群落组成相关信息,并结合土壤理化指标进行对比分析,但根际土壤微生物群落组成可能还受到植物的根系分泌物、叶片凋落物、生长发育阶段及基因型等因素影响[39],因此在今后探讨红树根际土壤细菌和真菌群落特征中,可以此为基础结合更多因素进行分析。 本研究利用高通量测序技术获得桐花树和老鼠簕根际土壤微生物群落组成,发现两者之间根际土壤细菌和真菌组成皆存在显著差异(P<0.05),老鼠簕的微生物多样性和丰富度均显著高于桐花树(P<0.05);桐花树根际土壤pH、总碳和总酚含量皆显著高于老鼠簕,pH值和总酚显著影响细菌群落组成,总碳和总硫则显著影响真菌群落组成;细菌物种主要受到pH、总碳和总氮的显著影响,而真菌物种则主要受到总酚、pH和总碳的显著影响。2.2 序列统计及α多样性分析
2.3 物种Venn图分析
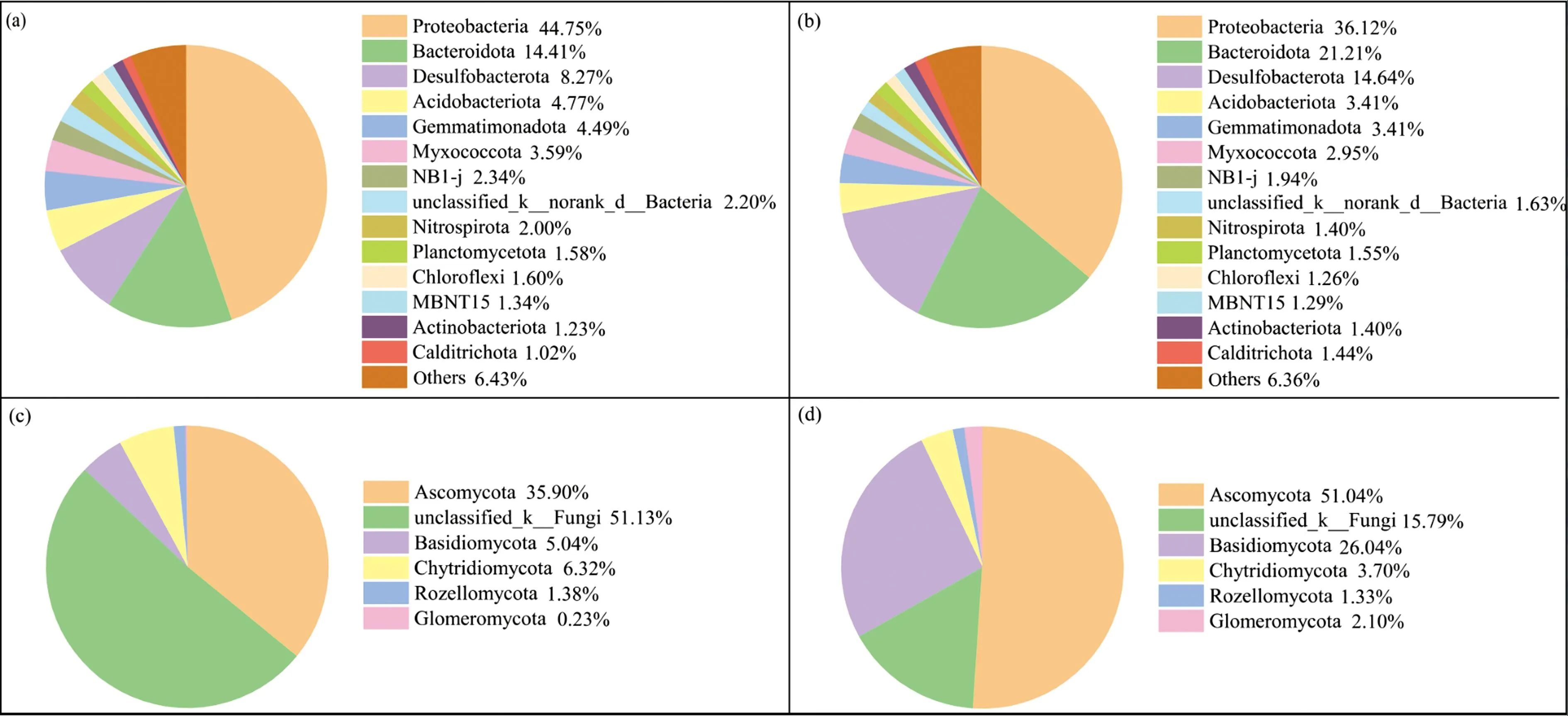
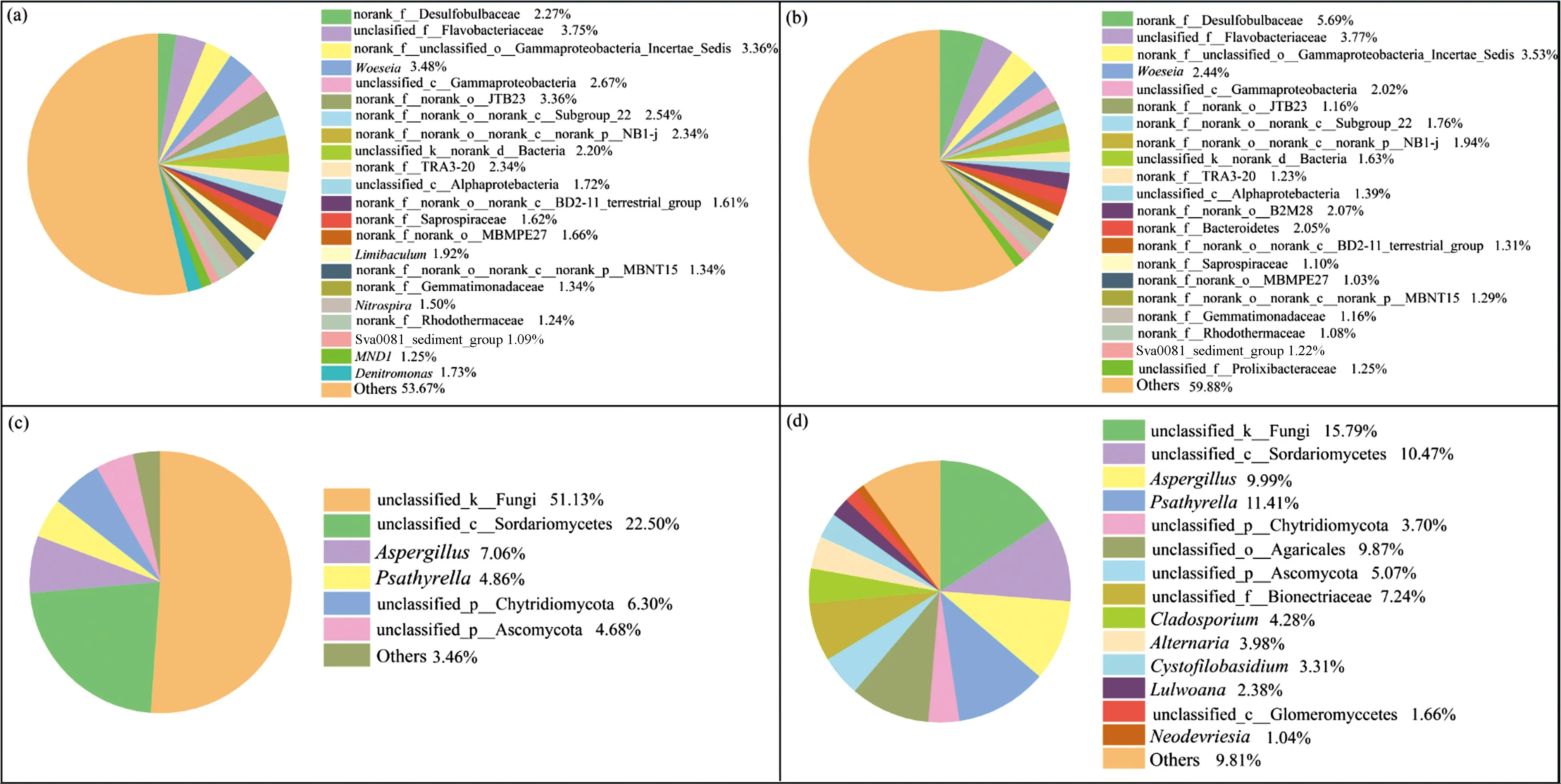
2.4 微生物群落组成分析
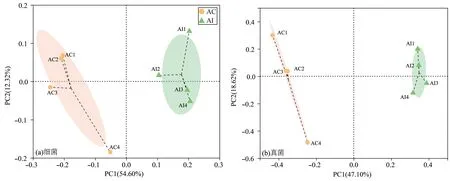
2.5 β多样性分析
2.6 细菌和真菌物种差异比较

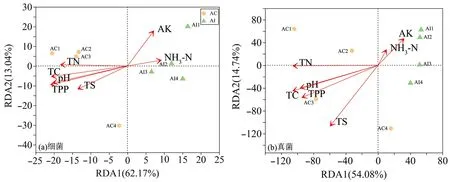
2.7 土壤理化性质对微生物的影响

3 讨论
4 结论
