镍源对Ni/Al2O3结构及其1,4-丁炔二醇加氢催化性能构效关系的影响
2023-12-22陈隽柴文燕史云晶马风云丁灏江堋武洪丽
*陈隽 柴文燕 史云晶 马风云 丁灏 江堋 武洪丽*
(1.新疆美克化工股份有限公司 新疆 830000 2.新疆农业大学 新疆 830000 3.新疆乌鲁木齐自治区石油和化学工业协会 新疆 830000)
1,4-丁炔二醇(BYD)加氢是工业上常用的反应,其加氢产品1,4-丁烯二醇(BED)和二段加氢产品1,4-丁二醇(BDO),是工业上常用的有机和精细化工产[1]。1,4-丁二醇在纺织,医药和化妆品领域应用广泛,可进一步生产γ-丁内酯(GBL),四氢呋喃(THF)和聚氨酯(PU)等高附加值化学品。1,4-丁烯二醇是医药上合成呋喃的重要中间体;是制备杀虫剂(硫丹)、维生素A和B6的原料;在造纸、纺织和树脂工业上,可用于生产聚酯纤维、乙烯基酯共聚物和聚氨酯,用作合成马来酸(顺丁烯二酸)等精细化工原料的中间体,还可作为合成树脂的交联剂和杀菌剂。普遍运用于医药、农药、造纸、电镀添加剂和增塑剂等行业的各个领域[2]。因此,研究BYD加氢反应,高效精准地合成BED和BDO,对工业生产应用具有重要的意义。根据BYD加氢催化剂的金属活性组分不同,可以分为贵金属催化剂和非贵金属催化剂。虽然贵金属催化剂具有良好的加氢活性,但因资源储量有限和价格昂贵,限制了贵金属催化剂在工业催化中的应用[3-4]。而Ni基催化剂因具有较高的加氢活性,广泛应用在催化加氢反应中。工业中,Ni/Al2O3催化剂具有成本较低、催化活性和稳定性好等优点,常被广泛应用于加氢、脱氢、重整、甲烷化、脱硫等反应[5-8]。
根据文献[1-3],制备BYD加氢负载Ni催化剂的方法包括浸渍法、共沉淀法和溶胶凝胶法等。浸渍法制备催化剂的技术已较成熟,其优点是载体表面利用率高、成本低;缺点是需经过多次浸渍才能制备出活性组分高度分散的催化剂。共沉淀法的优点是一次可同时得到多个组分,分布较均匀,较易制备出活性组分含量较高的催化剂;缺点是制备工艺繁琐,存在污水排放等问题。Urasaki等[9]以Ni(NO3)2、NiSO4、Ni(CH3COO)2、NiCl2和Ni(HCOO)2五种镍盐为镍源,采用等体积浸渍法制得负载型Ni/TiO2催化剂,应用于合成气甲烷化反应。研究结果表明,五种镍盐制备的催化剂的活性排序Ni(Ni(CH3COO)2)/TiO2>Ni(Ni(NO3)2)/TiO2>Ni(Ni(HCOO)2)/TiO2>Ni(NiCl2)/TiO2>Ni(NiSO4)/TiO2。不同镍源合成的催化剂比表面积大小、活性组分的晶粒尺寸大小及NiO形态存在差异,从而表现出不同的催化活性[10-12]。在BYD加氢反应中,考察不同镍源、铝源制备Ni/Al2O3催化剂及其对Ni活性组分在载体表面的存在形式、结构状态及催化性能影响却鲜有报道。
本文通过溶液燃烧法,分别以常用的Ni(CH3COO)2·4H2O、Ni(NO3)2·6H2O、NiCl2·6H2O和NiSO4·6H2O为镍源合成Ni/Al2O3催化剂,考察镍源对Ni/Al2O3催化BYD加氢性能的影响,并筛选出最佳镍源。结合XRD、SEM、N2吸附-脱附、H2-TPR等表征手段,进一步揭示了镍源对合成Ni/Al2O3催化剂结构与其催化加氢性能间构效关系的影响。
1.实验部分和表征手段
本文介绍了实验所用化学试剂、催化剂评价方法、产物分析等,详细介绍了所用仪器操作的条件。
(1)化学试剂与实验仪器
①化学试剂
硝酸镍,分析纯,上海山浦化工有限公司;硫酸镍、硝酸铝,分析纯,天津市致远化学试剂有限公司;氯化镍,分析纯,天津市盛奥化学试剂有限公司;乙酸镍,分析纯,上海麦克林生化科技有限公司;商业Raney-Ni,Ni/Al=4.1,BASF公司;1,4-丁炔二醇≥98.00,上海麦克林生化科技有限公司;乙二醇、无水乙醇,分析纯,天津市北联精细化学品开发有限公司;氢气,99.90%,新疆鑫天意矿业有限公司;氦气,100%,北京北氧特种气体研究所有限公司;H2/Ar混合气,5vol%,新疆鑫天意矿业有限公司。
②实验仪器和设备
鼓风干燥箱(DHG-9070A)、真空干燥箱(DZF-6050),上海一恒科技仪器有限公司;箱式高温炉(MXX1200-30),上海微行炉业有限公司;马弗炉(MXX2500-120),上海微行机械设备有限公司;管式炉(T1125S),河南成仪实验室设备有限公司;磁力加热搅拌器(78-1),河南成仪实验室设备有限公司;超声波清洗器(KQ5200E),昆山市超声仪器有限公司;浆态床反应釜(GSHA-1(100mL)),大连通达反应釜厂;分析天平(ME204/02(万分之一)),梅特勒-托利多仪器(上海)有限公司;气相色谱(GC-2014C)、气相色谱(6890A),日本岛津;压力表(0~10MPa),杭州富丽华仪仪表有限公司。
(2)催化剂制备
以A l(N O3)3·9 H2O 为铝源,镍源分别选取Ni(CH3COO)2·4H2O、Ni(NO3)2·6H2O、NiCl2·6H2O和NiSO4·6H2O,分别称取一定量的镍盐和铝盐置于烧杯中,加入100mL水+乙二醇+乙醇(体积比为1:2:1)混合溶液,磁力搅拌6h,得到前驱体试样,将前驱体试样放入马弗炉中,以5℃·min-1升温速率由室温升温至650℃,恒温3h,得到燃烧体试样。称取一定量燃烧体试样,将其加入石英还原管中,H2流量60mL·min-1,700℃还原3h,H2气氛下自然降至室温,制得催化剂(Ni负载量为30wt%),按照上述方法制得四个试样,分别命名为Ni-AC、Ni-N、Ni-C和Ni-S。
(3)催化剂表征
①X射线衍射分析
采用日本Rigaku D/max2500型X射线衍射仪(XRD)测得试样的晶相结构。测试条件:Cu靶Kα射线(λ=1.54Å),Ni滤波,扫描速度为8°·min-1,管压为40kV,管流为100mA,步长0.01°,扫描范围为10°~80°。
②N2物理吸附-脱附
采用ASAP2020型物理吸附仪(美国麦克默瑞提克仪器有限公司)测定试样的比表面积与孔径分布。采用Brunauer-Emmett-Teller(BET)方程和Berrett-Joyner-Halenda(BJH)方程分别计算试样的比表面积和孔体积。
③扫描电子显微镜
采用LEO公司LEO1530VP型扫描电子显微镜(SEM)和能谱仪(EDS)测试待测样品的微观形貌和元素分布。测试EDS和Mapping前不喷金。
④透射电子显微镜-能谱图
在Hitachi S-4800和TEM上使用场发射SEM,在200kV的JEM-2100F电子显微镜上,使用高分辨率TEM和EDX,分析试样的形貌信息。
⑤程序升温还原
采用ChemBET型TPR/TPD化学吸附仪(美国康塔仪器公司)对试样进行程序升温还原测试(H2-TPR)和(H2-TPH)测试。
⑥氨气程序升温脱附
采用ChemBET型号化学吸附仪(美国康塔仪器公司)对试样进行NH3程序升温脱附测试(NH3-TPD)。
⑦氢气程序升温脱附
采用AutoChem-2950型号化学吸附仪(美国麦克公司)对试样进行H2程序升温脱附测试(H2-TPD)。用氩气吹扫至基线平稳,以氩气为载气进行程序升温脱附,载气中H2变化量,其峰面积由Ag2O还原标定。
⑧Ni的分散度和表面积
采用H2-化学吸附测定试样中金属Ni的分散度和表面积。根据H2吸附量分别计算金属Ni的分散度和表面积。
⑨傅立叶变换红外光谱仪
采用溴化钾(K B r)球团技术,在B r u k e r EQUINOX-55进行了FT-IR分析。光谱经过32次扫描,分辨率为4cm-1,范围为400~4000cm-1。
⑩电感耦合等离子原子发射光谱
采用美国Leeman Labs公司Plasma-Spec-I型电感耦合等离子体原子发射光谱(ICP-AES)来测定样品中各元素的含量。配制的溶液用于测定催化剂的元素组成。
11 X射线光电子能谱
采用ESCALAB(美国Thermo Fisher Scientific公司)X射线光电子能谱(XPS)测定试样中各元素的化合价。
(4)催化剂活性评价
在高压反应釜内进行BYD加氢反应,采用离线方式在气相色谱仪上分析加氢产物,加氢反应装置,如图1所示。
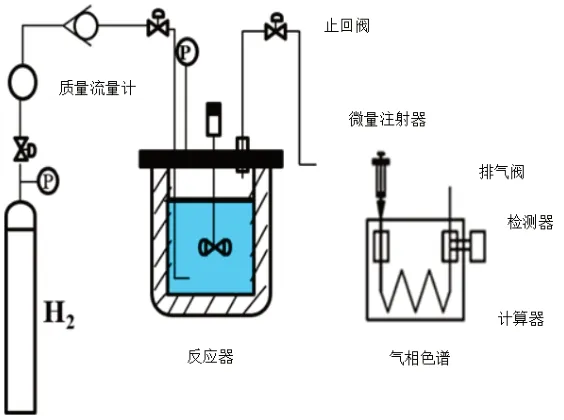
图1 浆态床BYD加氢反应装置示意图
将20mL BYD水溶液(2.0mol·L-1),催化剂用量0.03g·mL-1置于高压反应釜中,先通H2置换釜中空气,再通过减压阀调节H2压力至4.0MPa,搅拌(转速1200r·min-1),升温至120℃,计时,进行加氢反应,待反应结束后关闭H2,打开排气阀,冷却至室温后,停止搅拌,取出液相产物待测。
(5)产物分析方法
产物取样:准确称取2.0000g的BYD加氢液相产物置于25mL容量瓶内,无水乙醇定容,超声震荡5min,使用微量进样器,准确移取2.0μL试样,注入气相色谱仪进样口。
气相色谱仪(GC)分析:打开气相色谱仪及配置设备,待汽化室温度升至240℃,检测器温度升至260℃后,打开氢气和空气,FID点火,采用面积归一法计算反应物BYD的转化率和各产物的选择性。
该文中BYD反应所涉及的反应物、主产物和副产物包括cis-BED、trans-BED、HTHF、HALD、CROL和HBOTHF。以BYD的转化率(X)、产物的选择性(S)和收率(Y)评价加氢反应催化剂的性能。
BYD的转化率(X)、产物的选择性(S)和收率(Y)的计算公式见式(1)~(3)。
式中,xi表示组分i的摩尔分数,%,其中,i=1,2,3,4,5,6,7分别代表组分BYD、cis-BED、trans-BED、HTHF、HALD、CROL和HBOTHF。
2.结果与分析
(1)催化剂的表征与性能评价
本章采用了N2物理吸附,XRD,H2-TPR,NH3-TPD,H2-TPH等手段对制备的Ni/Al2O3催化剂进行表征。
(2)镍源对Ni/Al2O3催化BYD加氢性能的影响
①比表面积及孔径分布
图2给出了四个催化剂的N2吸附-脱附等温线和孔径分布曲线。由图2(a)可见,四个试样的吸附-脱附等温线均有滞后环出现。依据国际理论与应用化学联合会(IUPAC)分类法,均为典型的IV型等温线,存在明显的H2型滞后环,表明试样所含孔结构是管状孔,p/p0均在0.40~1.0范围内,最大吸附量即为饱和吸附量。这表明四个试样的孔道结构均以介孔为主。Ni-S试样回滞环饱和吸附平台不明显,表明其孔结构不够规整,回滞环相对压力高为0.52,表明其介孔中有毛细管凝聚现象发生,其余三种镍源合成试样的回滞环饱和吸附平台明显,表明孔结构规整。由图2(b)可知,四个试样孔径主要集中于2~15nm。
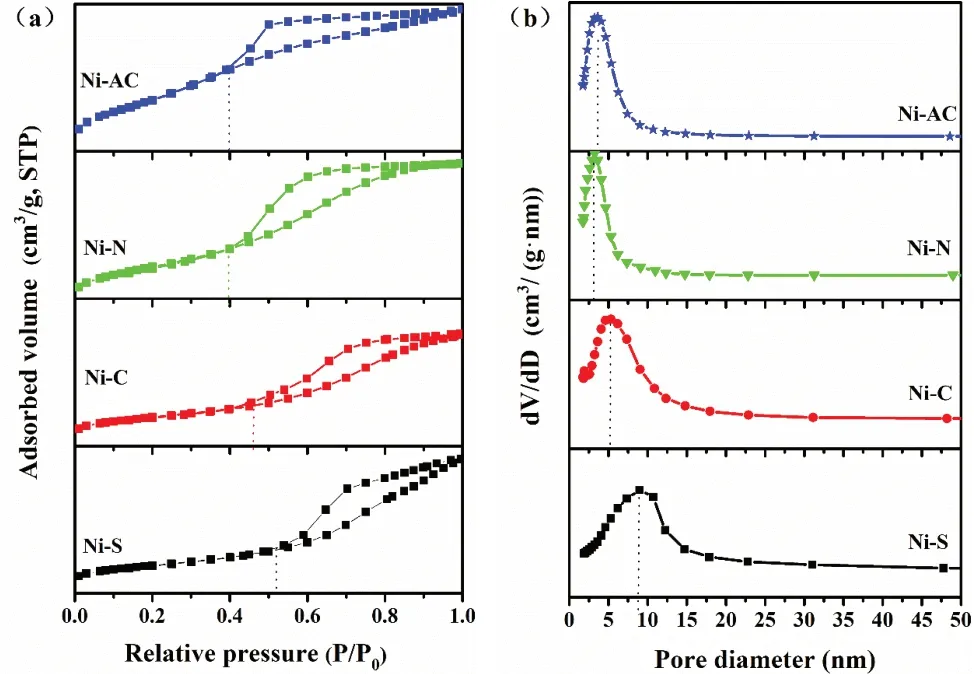
图2 (a)催化剂的N2吸附-脱附等温线;(b)孔径分布曲线
图3给出了四个催化剂孔结构参数。由图3可知,不同镍源制备的催化剂比表面积在166~225m2·g-1之间,孔容在0.29~0.39cm3·g-1范围,孔径在5.1~6.2nm之间,属于典型的介孔催化剂。其中,Ni-AC试样比表面积最大,达到225m2·g-1,最大孔容0.39cm3·g-1和最小孔径5.1nm。四个试样比表面积排序:Ni-AC(225m2·g-1)>Ni-N(220m2·g-1)>Ni-C(190 m2·g-1)>Ni-S(166m2·g-1)。从各镍盐制备催化剂反应的方程式可知,相同物质的量的镍盐受热分解释放出气体的量的顺序为Ni-AC>Ni-N>Ni-C>Ni-S,与试样比表面积排序一致,这是因为释放出气体越多,得到催化剂的孔道越多,从而使得催化剂比表面积越大。
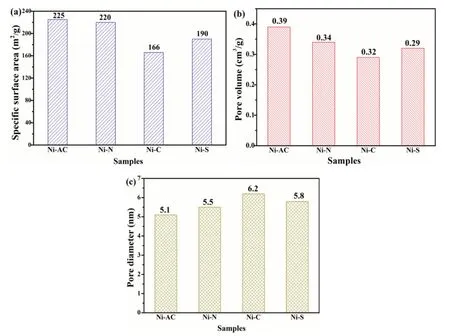
图3 (a)催化剂的比表面积;(b)孔体积;(c)平均孔径
②晶相结构分析
图4(a)为燃烧体试样的XRD图。由图4(a)可知,四个燃烧体试样均在2θ=44.9°和2θ=65.8°均出现NiAl2O4的特征峰,在2θ=37.2°、45.5°和66.4°处均出现Al2O3特征峰。在2θ=37.2°、43.2°、62.9°和75.3°处均出现了立方晶相NiO的特征峰(JPCDS 73-1519)[9-12],但峰形和强度有所不同。Ni-AC、Ni-N和Ni-C试样的NiO峰形尖锐,表明NiO晶型完整,晶粒尺寸较大,且在燃烧过程中部分Al2O3与NiO反应生成NiAl2O4。图4(b)为四个还原体试样的XRD图。由图可知,还原后,试样在2θ=44.5°、51.8°和76.3°出现了Ni的特征峰(JPCDS 04-0850)[10-11],NiO的特征峰均消失,表明Ni物种被还原成NiO。由44.5°处Ni(111)晶面衍射峰,通过Scherrer公式(D=0.89λ/(βcosθ))计算得到四个催化剂中Ni晶粒的平均尺寸,按照Ni-AC、Ni-N、Ni-C和Ni-S的顺序依次为18.7nm、23.6nm、27.4nm和19.9nm。
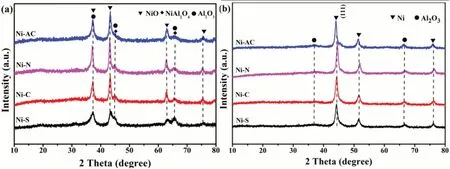
图4 (a)燃烧体试样的XRD;(b)还原体试样的XRD
③NiO存在形态和还原性能分析
借助H2-TPR分析四个试样的还原性能、NiO存在形态及活性组分与载体间的相互作用。图5为不同镍源合成燃烧体试样的H2-TPR图。由图可见,四个试样还原峰峰温及形状差异颇大。研究表明,在200~400℃低温段,其还原峰归属于游离态α-NiO的还原,α-NiO与载体Al2O3相互作用弱,邹梦等[13]报道,α-NiO具有较高流动性,容易在燃烧、还原等高温处理过程中发生烧结,对催化剂的催化活性贡献不大;400~750℃中温段的还原峰,归属于结合态β-NiO的还原。β峰可细分为β1(400~600℃)和β2(600~750℃),β1为与Al2O3作用较弱NiO的还原峰,β2为与Al2O3相互作用较强NiO的还原峰,β1-NiO和β2-NiO与载体的作用适中,活性最强;高温段的750~900℃还原峰归属于NiAl2O4还原,即化合态γ-NiO,尖晶石态NiAl2O4,文献[13-14]报道,NiAl2O4中Ni物种难以被还原,表面NiO活性位数目将大大降低。由图5和表1分析可知,β1-NiO+β2-NiO比例大小:Ni-AC>Ni-N>Ni-C>Ni-S。其中,Ni-S和Ni-C还原峰形相似,但Ni-C试样表面游离态NiO较少,而Ni-S游离态NiO占23.4%,化合态γ-NiO占28.5%。相比Ni-S试样,Ni-N、Ni-C和Ni-AC的还原峰温度较高,主要以β1-NiO、β2-NiO为主,NiO与Al2O3之间作用力较强,还原时可抑制活性组分迁移团聚。
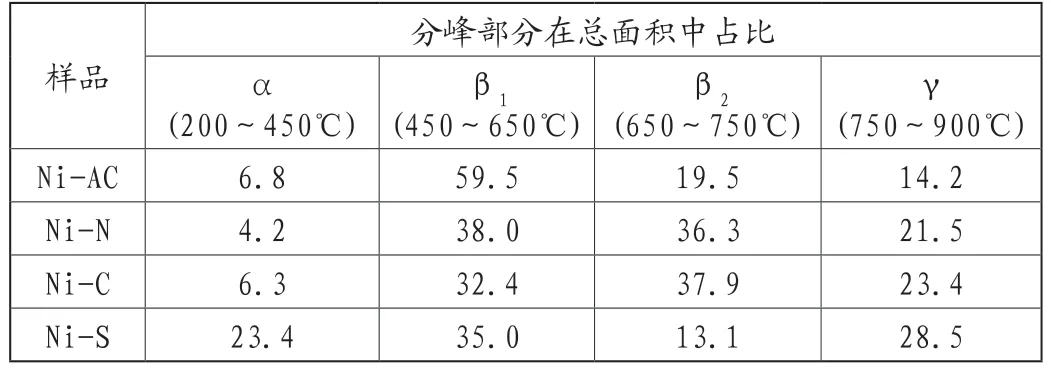
表1 燃烧体H2-TPR拟合参数(%)
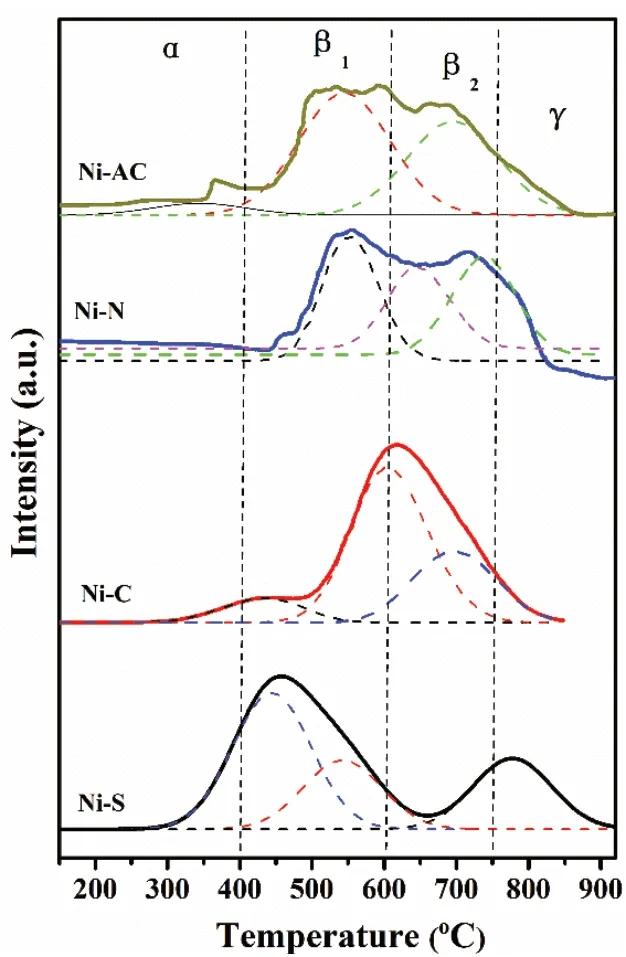
图5 不同镍源合成燃烧体的H2-TPR
④表面酸性分析
镍源不仅影响Ni物种存在形态和还原性能,而且还会影响催化剂表面的酸碱度。图6为四个催化剂的NH3-TPD结果。图6表明,Ni-N、Ni-C和Ni-S催化剂的NH3脱附峰峰形相似,均位于低温区和中温区,分别对应弱酸和强酸中心,而四个催化剂的NH3脱附峰差别较大,Ni-AC对应的弱酸和强酸中心均较大幅度后移,从183℃后移至323℃,强酸中心从521~528℃后移至653℃。镍源合成催化剂对弱酸强度的影响为:Ni-AC(323℃)>Ni-N(183℃)=Ni-C(183℃)=Ni-S(183℃)。镍源合成催化剂对强酸强度的影响为:Ni-AC(653℃)>Ni-N(528℃)>Ni-C(525℃)>Ni-S(521℃)。
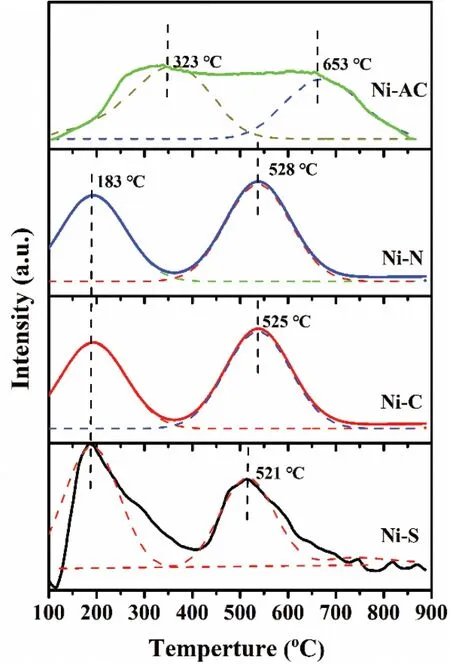
图6 催化剂的NH3-TPD
通过高斯拟合分别拟合出弱酸和强酸的面积如图7,从图中可知,催化剂总酸量大小顺序为Ni-N>Ni-S>Ni-C>Ni-AC,Ni-N催化剂总酸量最大,Ni-AC催化剂总酸量最小,总酸量出现这一现象的原因,是因为Ni(NO3)2、NiCl2和NiSO4是强酸弱碱盐,在催化剂制备过程中,Ni(NO3)2、NiCl2和NiSO4水解后酸性较强(如水解方程式(4)所示),部分酸吸附在催化剂表面,使催化剂表面总酸量大。Ni(Ac)2水解产物有弱酸HAc生成(如水解方程式(5)所示),使得催化剂表面总酸量最小。水解方程式如下:
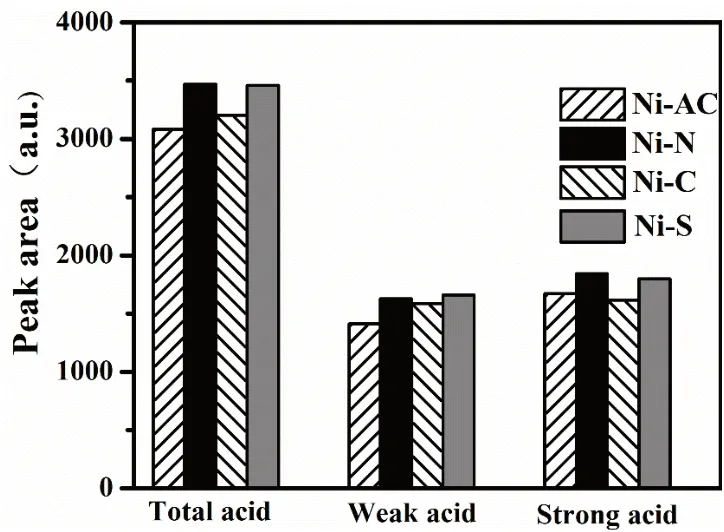
图7 NH3-TPD高斯拟合分析
⑤性能评价
催化剂的活性评价结果见图8。四个催化剂BYD的加氢的主要产物均为cis-BED,并含有一定量的trans-BED、BDO、HTHF、HALD及其他产物。通过对比可知,BYD转化率遵循如下顺序:Ni-AC>Ni-N>Ni-C>Ni-S,cis-BED收率遵循如下顺序:Ni-AC>Ni-N>Ni-C>Ni-S。其中,Ni-AC试样BYD转化率最高,达到59.8%,cis-BED的选择性为83.7%,收率最高为50.1%,Ni-N与Ni-AC催化剂BYD转化率相近,为58.7%。Ni-S催化剂的BYD转化率最低,为25.6%,收率最小,为21.4%。
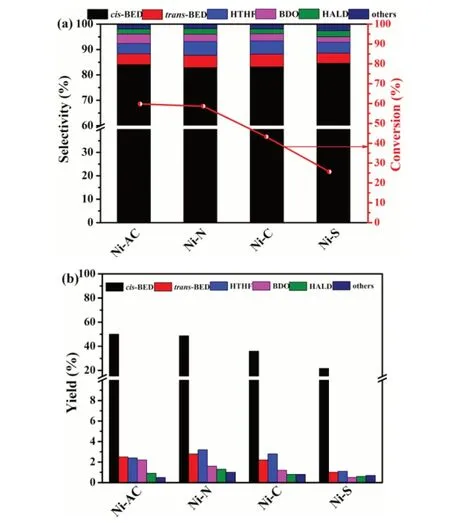
图8 催化剂BYD的加氢性能
结合H2-TPR分析,β1-NiO+β2-NiO比例大小:Ni-AC>Ni-N>Ni-C>Ni-S,β1-NiO+β2-NiO比例大小和BYD转化率一致,Ni-N与Ni-AC试样中β1-NiO+β2-NiO所占比例相近,表现出BYD转化率相近。Ni-AC催化剂BYD转化率最高,一方面归因于Ni-AC催化剂β1-NiO+β2-NiO所占比例最大,该形态NiO与载体间有适宜的相互作用,在高温还原条件下可抑制活性组分Ni的迁移团聚,还原出的Ni更利于加氢。另一方面归因于Ni-AC催化剂比表面积最大,能够提供更多活性位。Ni-S催化剂的BYD转化率和cis-BED收率均最低原因可能是:一方面,在催化剂制备过程中SO42-生成了SO2或SO32-吸附在催化剂表面,王桂茹等[15]报道生成的SO2或SO32-的孤对电子被催化剂活性中心强吸附,减少Ni的“d带空穴数”或覆盖催化中心致使催化剂中毒;另一方面,结合BET和H2-TPR分析,Ni-S比表面积最小且游离态α-NiO较多,占43.4%,游离态α-NiO还原出的活性组分Ni易迁移和团聚。
结合NH3-TPD分析,各催化剂表面酸性对BYD转化率影响较小,而催化剂表面酸性影响着产物的选择性,Ni-N、Ni-C、Ni-S催化剂加氢产物中副产物HALD和HTHF的选择性明显高于Ni-AC,这归因于催化剂表面酸性强,BED易发生异构化,生成HALD,继而,HALD发生羟醛自缩合反应,生成HTHF。
3.结论
本章通过溶液燃烧法,分别考察镍源(Ni(CH3COO)2·4H2O、Ni(NO3)2·6H2O、NiCl2·6H2O和NiSO4·6H2O对合成Ni/Al2O3催化剂加氢性能的影响。
结果显示:Ni源(Ni(CH3COO)2·4H2O、Ni(NO3)2·6H2O、NiCl2·6H2O和NiSO4·6H2O)中,以NiSO4·6H2O为镍源所得催化剂的BYD转化率最低,为25.6%,cis-BED的选择性为83.6%,收率最小,为21.4%,这可能是在催化剂制备过程中,SO42-生成了SO2或SO32-吸附在催化剂表面,减少Ni的“d带空穴数”或覆盖催化中心致使催化剂中毒。以Ni(CH3COO)2·4H2O合成催化剂的BYD转化率最高,为59.8%,cis-BED的选择性为82.7%。因此,在现有实验条件下,筛选出最佳镍源为Ni(CH3COO)2·4H2O。
