沉默Sp5对mEPMCs中Wnt信号通路相关因子及增殖能力的影响
2023-12-22柏宇兰雪娇唐璟文雨吕明敏宋庆高
柏宇,兰雪娇,唐璟,文雨,吕明敏,宋庆高
腭裂是常见的先天性出生缺陷之一,是一种基因与环境相互作用引起的多基因遗传病[1-2]。其易感基因包括干扰素调节转录因子6(IRF6)、亚甲基四氢叶酸还原酶(MTHFR)、骨形态发生蛋白4(BMP4)等[3-4]。研究发现,转录因子特异蛋白5(Sp5)与胚胎发育相关,Sp5基因敲除会引起非洲爪蟾色素沉着、颅面软骨、背鳍等严重缺损[5-6]。本课题组前期研究微量元素锌与C57BL/6J 小鼠腭裂的关系时,利用基因芯片检测腭突组织中锌指蛋白Sp家族成员,发现在胚胎14.5 d 时缺锌组腭突组织中Sp5mRNA表达高于常锌组和富锌组,故推测锌指蛋白Sp5基因可能是腭裂候选基因[7]。进一步采用不同浓度锌饲料喂养孕鼠,发现在腭突融合期缺锌导致腭裂的发生,并使其子代Sp5基因表达水平升高,推测Sp5 在调控腭的发育过程中起到负性调节作用[8]。利用免疫组织化学染色检测胎鼠腭胚突中Sp5表达变化,发现腭发育期间Sp5在腭突间充质及上皮细胞中表达均为阳性[9]。Wnt 信号通路在多项研究中被证明参与调控腭的发育[10-11]。然而,目前关于Sp5、Wnt信号通路是否参与小鼠腭发育过程的研究尚少见。本研究利用慢病毒载体沉默小鼠胚胎腭突间充质细胞(mouse embryo palatal mesenchymal cells,mEPMCs)中的Sp5基因,探讨Sp5 表达变化对Wnt信号通路及体外mEPMCs增殖的影响。
1 材料与方法
1.1 试剂与仪器 DMEM/F12 培养基、胰酶均购自美国Gibco公司;BI胎牛血清购自北京沃卡威生物技术有限公司;中性蛋白酶粉购自北京索莱宝科技有限公司;Sp5 沉默慢病毒、聚凝胺Polybrene 购自汉恒生物科技(上海)有限公司;高效RIPA 裂解液、BCA 蛋白含量检测试剂盒购自北京索莱宝科技有限公司;超敏化学发光底物(ECL)试剂盒购自美国Millipore 公司;Sp5 兔多克隆抗体购自北京博奥森生物技术有限公司;广谱细胞角蛋白(Pan-Cytokeratin,P-CK)兔单克隆抗体、丝氨酸/苏氨酸激酶(GSK-3β)兔单克隆抗体、Wnt家族成员3a(Wnt3a)兔单克隆抗体、特异性周期蛋白D1(CyclinD1)兔单克隆抗体购自美国CST 公司;波形蛋白(Vimentin)兔单克隆抗体、β-连环蛋白(β-catenin)兔单克隆抗体购自英国Abcam公司;微管蛋白(β-tubulin)兔单克隆抗体购自武汉三鹰生物技术有限公司;PCR引物购自上海生工生物工程股份有限公司/擎科生物有限公司;TRIzol购自美国Thermo 公司;SYBR®Premix Ex TaqTMⅡ购自日本TaKaRa;细胞计数(CCK-8)试剂盒购自日本同仁化学研究所;5-乙炔基-2'脱氧尿嘧啶核苷(EdU)试剂盒购自广州锐博生物科技有限公司;CO2培养箱购自美国Forma;荧光显微镜购自日本Olympus;酶标仪购自美国Thermo;凝胶成像分析仪购自美国Bio-Bad;PCR检测仪器购自美国Bio-Bad。体式显微镜购自瑞士Leica;流式细胞仪购自贝克曼库尔特商贸(中国)有限公司。
1.2 方法
1.2.1 实验动物 C57BL/6J小鼠60只(其中雌鼠40只,雄鼠20只),8~10周龄,体质量20 g及以上,购自贵州省遵义医科大学动物中心[动物生产许可证号:SCXK(黔)-2021-0002],饲养于遵义医科大学动物中心无特定病原体级的动物房中。本实验所有涉及实验动物的操作均由遵义医科大学动物实验伦理委员会伦理审查并同意后实施[批准号:遵医伦审(2021)1-053号]。
1.2.2 原代mEPMCs 的获取、培养 按照雌雄比例为2∶1 于每晚20:00合笼,次日早晨8:00检查小鼠阴道栓,有阴道栓的小鼠记为孕期0.5 d(GD0.5),称体质量并记录。GD10.5 时,雌鼠体质量增加超过2 g且腹部隆起判定为妊娠。于GD14.5时,采用脱颈法处死孕鼠,75%乙醇消毒,无菌眼科剪剖开孕鼠腹部,取出腹中胚胎置于无菌培养皿中。剥离羊膜及绒毛膜,体式显微镜下用无菌眼科剪及眼科镊获取1 块大小约0.5 cm×0.4 cm 的腭突组织,放入现配的中性蛋白酶液(由0.037 g 中性蛋白酶粉剂和5 mL PBS 液配制而成)中,4 ℃冰箱内过夜。次日取出腭突组织,PBS 液清洗3 次,加入1 mL 0.125%胰酶消化腭突组织6~8 min,至无明显组织块时即消化完成。消化结束后加入含10%血清的DMEM/F12 完全培养基2 mL 终止消化,1 000 r/min 离心5 min,弃上清液,加入3 mL 完全培养基,重悬细胞沉淀制成细胞悬液,接种于T25培养瓶中,置于5%CO2、37 ℃细胞培养箱培养。
1.2.3 原代mEPMCs 的鉴定 0.125%胰酶消化细胞制成细胞悬液并计数,1 000 r/min离心5 min,重悬细胞,以8 000个/孔细胞接种于96孔板。待细胞长至70%~80%时,4%多聚甲醛固定15 min;0.5% Triton X-100 通透室温孵育30 min;5%山羊血清封闭30 min;吸净封闭液,将一抗Vimentin(稀释比例1∶500)及P-CK(稀释比例1∶250)加入相应的孔内,4 ℃冰箱内过夜;荧光二抗孵育1 h(稀释比例1∶500,此步开始注意避光操作),DAPI染核,滴加抗荧光衰减剂,荧光显微镜下采集图像。
1.2.4 慢病毒载体转染mEPMCs 慢病毒包装的Sp5基因沉默载体由汉恒生物科技(上海)有限公司设计、构建、包装完成。载体为pHBLV-U6-MCS-CMV-ZsGreen-PGK-PURO,抗性标签为嘌呤霉素(Puromycin),荧光标签为绿色荧光蛋白(ZsGreen)。基于Sp5基因的编码序列CDS 区,公司设计了3个shRNA 干扰靶点并将其命名为shRNA4、shRNA5、shRNA6。Sp5基因shRNA干扰靶点序列及病毒滴度见表1。
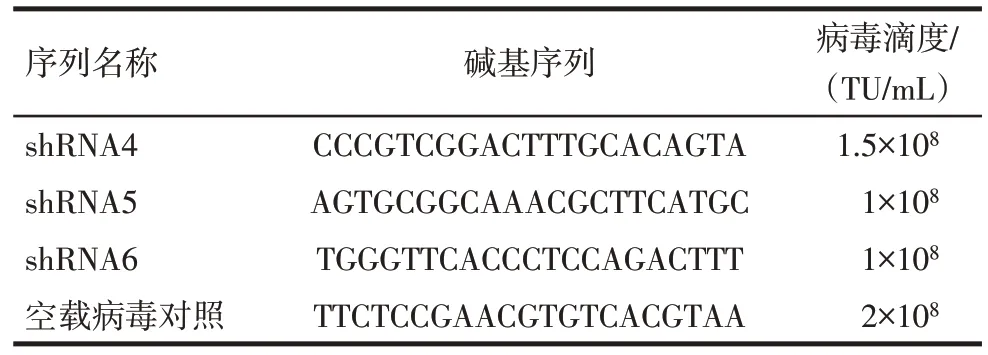
Tab.1 Sp5 gene shRNA interfered with target sequences and viral titers表1 Sp5基因shRNA干扰靶点序列及病毒滴度
(1)最佳感染复数(MOI)筛选及转染效率测定。将实验分为5组:空白对照组(在常规培养基上培养细胞)、空载病毒组(空载慢病毒载体转染细胞)、shRNA4 组(携带Sp5-shRNA4 的慢病毒载体转染细胞)、shRNA5 组(携带Sp5-shRNA5 的慢病毒载体转染细胞)、shRNA6 组(携带Sp5-shRNA6的慢病毒载体转染细胞)。将MOI设置为10、30、50,Polybrene 为4 mg/L[12]进行测定。以8 000 个/孔细胞接种于96 孔板。培养24 h 后转染,向每孔加入25 μL 病毒混合液(具体配制见表2)和0.05 μL Polybrene;转染4 h后加入25 μL完全培养基,置于5%CO2、37 ℃细胞培养箱培养。转染72 h后,荧光显微镜下观察各组细胞ZsGreen的表达情况,同时采用Western blot 法筛选出干扰效果最好的Sp5-shRNA,生长稳定后可继续后续实验。(2)实验分组及转染。实验设3组:空白对照组(在常规培养基上培养细胞)、空载病毒组(空载慢病毒载体转染细胞)、Sp5-shRNA组(干扰效果最好的携带Sp5-shRNA 慢病毒载体转染细胞)。以2×105个/孔细胞接种于6孔板,置于5%CO2、37 ℃细胞培养箱培养。细胞培养24 h后转染,转染操作同上。

Tab.2 Preparation of virus mixture in each group表2 各组病毒混合液配制情况(μL)
1.2.5 Western blot 检测Sp5、β-catenin、GSK-3β、Wnt3a、CyclinD1蛋白的表达 转染72 h后收集细胞样品,加入蛋白裂解液裂解细胞30 min,用BCA蛋白定量测定试剂盒检测总蛋白量。样品经10%SDS-PAGE 凝胶电泳(80 V恒压)分离,然后通过半干转印法(电压25 V、电流2.5 A、时间10 min)转印到PVDF膜。将膜放入5%脱脂奶粉中室温封闭2 h。孵育一抗Sp5(1∶1 000)、β-catenin(1∶7 500)、GSK-3β(1∶1 000)、Wnt3a(1∶1 000)、CyclinD1(1∶30 000)、β-tubulin(1∶4 500)。4 ℃孵育过夜后TBST 清洗3 次,加入HPR 标记的山羊抗兔IgG 二抗(1∶6 000)室温孵育2 h。TBST 清洗3 次,然后加入200 μL 显色液覆盖膜的表面,显影拍照。用Image J 图像分析软件各蛋白条带进行灰度值分析,以β-Tubulin为内参,计算各蛋白条带相对表达量。
1.2.6 RT-qPCR 检测β-catenin、GSK-3β、Wnt3a、CyclinD1mRNA 表达 转染72 h 后收集mEPMCs,用TRIzol 提取其总RNA,测定总RNA 浓度。按照逆转录试剂盒说明书合成cDNA。反应体系:5×PrimeScript Buffer(4 μL)、PrimeScriptRT Enzyme Mix I(1 μL)、Oligo dT Primer(1 μL)、Random 6 mers(1 μL)、Total RNA(1 000 ng/所测总RNA 浓度),加RNase Free ddH2O 补足至20 μL。按照TaKaRa 公司SYBR Green 染料法进行RT-qPCR 扩增反应实验。以GAPDH为内参,反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环。引物序列见表3。每个样本均设3个复孔,重复3次取均值,以2-ΔΔCt法计算mRNA相对表达量。

Tab.3 PCR primer sequence表3 PCR引物序列
1.2.7 CCK-8实验 以8 000个/孔细胞、100 μL/孔体积接种至96 孔板,每组重复3 个复孔。待细胞长至50%~70%进行转染。以换液的形式加入CCK-8 液(完全培养基∶CCK-8液=10∶1,110 μL/孔),孵箱中孵育2 h,培养24、48、72 h时通过酶标仪检测其在450 nm波长处的光密度(OD)值。
1.2.8 EdU 实验 细胞转染72 h,向各组细胞加入EdU 染料孵育8 h,对各组细胞进行固定、通透、孵育Apollo®染色反应液及Hoechst 33342复染细胞核,荧光显微镜拍照。EdU染色后呈红色荧光,Hoechst 33342 染色后呈蓝色荧光,将这两种荧光重叠后得到EdU阳性增殖细胞,呈粉紫色荧光。用FIJI软件计数相同视野下EdU 标记细胞及Hoechst 阳性细胞数,细胞增殖率=(EdU 阳性增殖细胞数/Hoechst 阳性细胞数)×100%。
1.2.9 流式细胞术检测细胞周期 细胞转染72 h后,按组别用PBS液清洗1次,1 mL 0.125%胰酶消化细胞制成单细胞悬液,1 500 r/min离心5 min,弃上清液,加入2 mL完全培养基,混匀。1 500 r/min离心5 min,弃上清液,加入500 μL 70%预冷乙醇,置于4 ℃冰箱固定过夜。次日用PBS 清洗细胞,1 500 r/min 离心5 min,弃上清液,向细胞沉淀中加入100 μL RNaseA,吹打重悬细胞,放入37 ℃水浴锅,孵育30 min。加入400 μL PI染色液混匀,置于4 ℃冰箱避光孵育30 min。采用流式仪检测各组细胞周期的分布情况,用modifit软件分析不同时相的细胞百分比。
1.3 统计学方法 采用Graph Pad Prism 8.0.2软件进行数据分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较行Tukey法。P<0.05为差异有统计学意义。
2 结果
2.1 倒置相差显微镜下小鼠原代mEPMCs 形态变化 小鼠原代mEPMCs接种后6~8 h时,细胞开始贴壁生长,多为三角形或多边形,其中可见大量漂浮的死细胞;接种24 h 时,细胞数量增多,细胞体积开始增大,细胞相互接触;接种48 h时,细胞快速生长,细胞接触更加紧密,细胞逐渐铺满培养瓶底,呈长梭形或漩涡状排列生长;接种48~72 h 时,细胞铺满培养瓶瓶底。见图1。

Fig.1 Morphology of primary mouse palatal mesenchymal cells under inverted phase contrast microscope(×40,scale=200 μm)图1 倒置相差显微镜下小鼠原代mEPMCs形态(×40,标尺=200 μm)
2.2 小鼠mEPMCs的免疫荧光鉴定 Vimentin染色见细胞质着色,绿色荧光表达较强,胞核呈蓝色荧光表达;P-CK 染色胞质未见绿色荧光表达,胞核呈蓝色荧光表达,见图2。

Fig.2 Identification of primary mouse palatal mesenchymal cells Vimentin and P-CK by fluorescence(×200,scale=50 μm)图2 小鼠mEPMCs Vimentin及P-CK免疫荧光鉴定(×200,标尺=50 μm)
2.3 各组细胞转染后绿色荧光表达情况 当MOI=10 时,ZsGreen 表达约50%;当MOI=30 或50 时,ZsGreen 表达达80%以上,见图3。确定后续实验转染条件为MOI=30,Polybrene=4 mg/L。
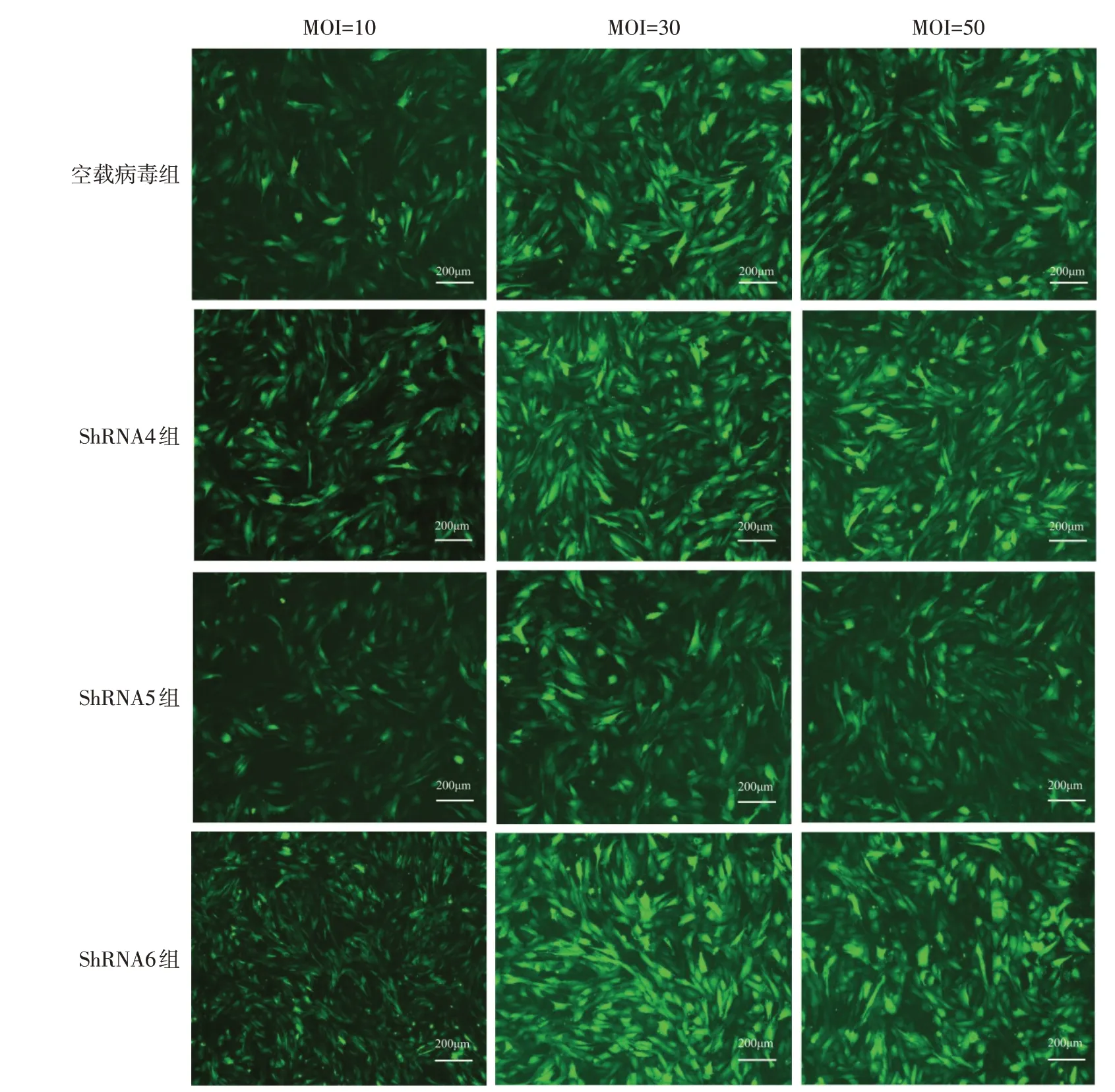
Fig.3 The expression of ZsGreen in each group 72 h after transfection(×40,scale=200 μm)图3 转染72 h后各组细胞ZsGreen表达情况(×40,标尺=200 μm)
2.4 各组细胞转染效率的测定 空白对照组、空载病毒组、shRNA4组、shRNA5组、shRNA6组中Sp5蛋白表达水平分别为:0.703±0.118、0.742±0.059、0.677±0.050、0.594±0.051、0.406±0.028。shRNA6 组中Sp5蛋白表达最低(F=11.400,P<0.05),故后续实验使用shRNA6慢病毒。见图4。

Fig.4 The influence of Sp5-shRNA on mEPMCs of Sp5 expression图4 Sp5-shRNA对mEPMCs Sp5表达的影响
2.5 沉默Sp5基因后对mEPMCs中β-catenin、GSK-3β、Wnt3a、CyclinD1 蛋白表达的影响 Sp5-shRNA组mEPMCs 中β-catenin、GSK-3β、Wnt3a、CyclinD1蛋白表达水平高于空白对照组和空载病毒组(P<0.05),空载病毒组与空白对照组差异无统计学意义(P>0.05),见图5、表4。

Fig.5 Western blot results of mouse palatal mesenchymal cells β-catenin,GSK-3β,Wnt3a and CyclinD1图5 小鼠mEPMCs中β-catenin、GSK-3β、Wnt3a、CyclinD1蛋白印迹图
Tab.4 Comparison of β-catenin,GSK-3β,Wnt3a and CyclinD1 protein between three groups of cells表4 各组细胞中β-catenin、GSK-3β、Wnt3a、CyclinD1蛋白表达比较(n=3,±s)
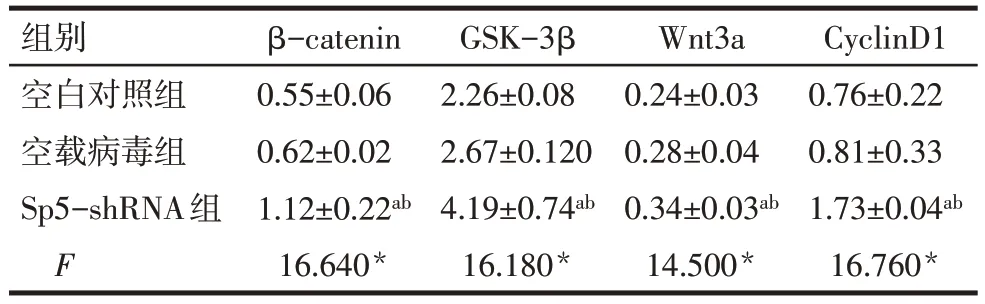
Tab.4 Comparison of β-catenin,GSK-3β,Wnt3a and CyclinD1 protein between three groups of cells表4 各组细胞中β-catenin、GSK-3β、Wnt3a、CyclinD1蛋白表达比较(n=3,±s)
*P<0.05;a与空白对照组比较,b与空载病毒组比较,P<0.05。
组别空白对照组空载病毒组Sp5-shRNA组F CyclinD1 0.76±0.22 0.81±0.33 1.73±0.04ab 16.760*β-catenin 0.55±0.06 0.62±0.02 1.12±0.22ab 16.640*GSK-3β 2.26±0.08 2.67±0.120 4.19±0.74ab 16.180*Wnt3a 0.24±0.03 0.28±0.04 0.34±0.03ab 14.500*
2.6 沉默Sp5基因后对mEPMCs中β-catenin、GSK-3β、Wnt3a、CyclinD1 mRNA 表达的影响 Sp5-shRNNA 组mEPMCs 中β-catenin、GSK-3β、Wnt3a、CyclinD1 mRNA相对表达量高于空白对照组和空载病毒组(P<0.05),空载病毒组与空白对照组差异无统计学意义(P>0.05),见表5。
Tab.5 Expression of β-catenin,GSK-3β,Wnt3a and CyclinD1 mRNA in each group of cells表5 各组细胞中β-catenin、GSK-3β、Wnt3a、CyclinD1 mRNA表达比较(n=3,±s)

Tab.5 Expression of β-catenin,GSK-3β,Wnt3a and CyclinD1 mRNA in each group of cells表5 各组细胞中β-catenin、GSK-3β、Wnt3a、CyclinD1 mRNA表达比较(n=3,±s)
*P<0.05;a与空白对照组比较,b与空载病毒组比较,P<0.05。
组别空白对照组空载病毒组Sp5-shRNA组F β-catenin 0.83±0.09 1.02±0.02 1.26±0.10ab 24.550*GSK-3β 0.96±0.22 0.96±0.09 1.96±0.39ab 14.310*Wnt3a 0.90±0.36 1.03±0.08 1.92±0.30ab 12.370*CyclinD1 0.70±0.24 1.01±0.01 1.61±0.33ab 11.940*
2.7 沉默Sp5基因后对mEPMCs增殖的影响 转染mEPMCs 48 h、72 h 后,Sp5-shRNNA 组细胞增殖能力高于空白对照组和空载病毒组(P<0.05),空载病毒组与空白对照组差异无统计学意义(P>0.05),见表6。
Tab.6 Comparison of cell proliferation ability between three groups表6 各组不同时点细胞增殖能力比较 (n=3,±s)
*P<0.05;a与空白对照组比较,b与空载病毒组比较,P<0.05。
组别空白对照组空载病毒组Sp5-shRNA组F OD450 72 h 1.24±0.19 1.21±0.21 1.81±0.11ab 8.457*24 h 0.31±0.05 0.33±0.06 0.39±0.03 2.419 48 h 0.64±0.06 0.67±0.05 0.84±0.01ab 16.500*
2.8 沉默Sp5基因后对EdU 阳性细胞增殖率的影响 空白对照组、空载病毒组、Sp5-shRNNA 组EdU阳性细胞增殖率分别为:14.00%±0、14.67%±0.58%、22.67%±4.62%,Sp5-shRNA 组高于空白对照组和空载病毒组(F=9.662,P<0.05),空载病毒组与空白对照组差异无统计学意义(P>0.05),见图6。

Fig.6 Cell proliferation indexes in each group detected by EdU immunofluorescence(×40,scale=200 μm)图6 EdU免疫荧光检测各组细胞增殖情况(×40,标尺=200 μm)
2.9 沉默Sp5基因后对细胞周期的影响 Sp5-shRNA 组mEPMCs 处于S 期的细胞比例高于空白对照组和空载病毒组,G0/G1 期细胞比例低于空白对照组和空载病毒组(P<0.05),各组G2/M 期细胞比例差异无统计学意义(P>0.05);空载病毒组各细胞周期与空白对照组差异无统计学意义(P>0.05),见表7。
Tab.7 Cell cycle distribution of each group of cells表7 各组细胞的细胞周期分布(n=3,%,±s)
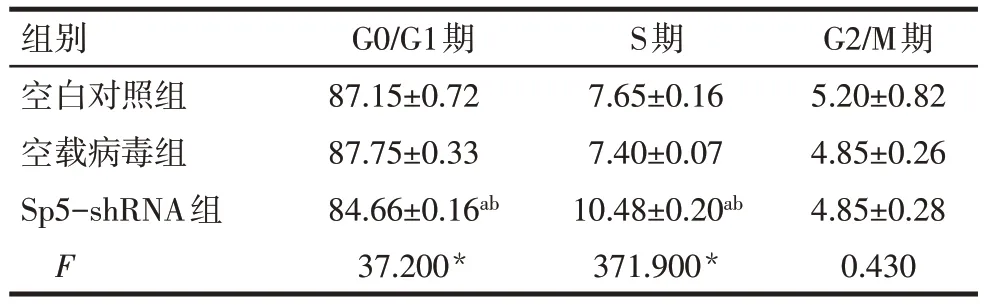
Tab.7 Cell cycle distribution of each group of cells表7 各组细胞的细胞周期分布(n=3,%,±s)
*P<0.05;a与空白对照组比较,b与空载病毒组比较,P<0.05。
组别空白对照组空载病毒组Sp5-shRNA组F G0/G1期87.15±0.72 87.75±0.33 84.66±0.16ab 37.200*S期7.65±0.16 7.40±0.07 10.48±0.20ab 371.900*G2/M期5.20±0.82 4.85±0.26 4.85±0.28 0.430
3 讨论
腭裂是常见的先天性出生缺陷,不仅造成患者面部畸形等生理功能及心理障碍,也给患者及其家庭带来沉重的经济负担[13-15]。目前临床上已有成熟的手术治疗方案,但对于其发病机制尚未完全阐明,因此积极进行病因研究,建立早期干预措施,对于唇腭裂的发生、预防、治疗和预后均至关重要[16]。
慢病毒载体是一种逆转录病毒载体,具有转染到分裂或非分裂细胞的能力,转染效率高以及扩大靶基因片段等优势[17]。本实验选用特异性强、携带ZsGreen 的慢病毒载体转染mEPMCs。转染72 h后,荧光显微镜下观察空载病毒组、Sp5-shRNA 组中均可见ZsGreen表达,初步提示细胞转染成功。随后经Western blot验证转染效率,shRNA6组Sp5蛋白表达水平最低,提示成功转染mEPMCs,达到实验要求,选择shRNA6慢病毒进行后续实验。
锌指蛋白是真核细胞中表达较为广泛的转录蛋白之一,其通过锌离子与特殊的氨基酸残基结合折叠后形成锌指结构,具有发育和分化过程、转录以及转录后的调节和激活、信号转导等多种生物学功能[18]。转录因子特异蛋白Sp5是锌指蛋白超家族中的一族成员,其在肝细胞癌、胃癌和结肠癌中表达上调,将Sp5 转入不表达内源性Sp5 蛋白的MCF-7 细胞,可诱导出显著的促生长活性,并与Wnt/βcatenin 信号通路有关[19]。另有研究发现,Sp5基因可作为特异性转录共激活因子,在小鼠胚胎和胚胎干细胞分化Wnt/β-catenin 通路信号传递中起重要作用[20]。本课题组前期通过GO 富集数据分析发现,Sp5在调控器官形成和发育、骨骼系统形成和发育等生物功能存在明显差异,故推测Sp5基因对腭骨乃至颅颌面骨骼的生物学发育可能起到关键作用[7]。有研究发现,在mEPMCs 中过表达Sp5,Wnt信号通路中β-catenin、GSK-3β、Wnt3a 表达均下调[12]。本研究结果显示,在mEPMCs 中沉默Sp5后,Wnt 信号通路相关因子β-catenin、GSK-3β、Wnt3a表达均上调,提示Sp5 可能通过Wnt 信号通路参与调控腭的发育。
腭部的发育涉及增殖、迁移和凋亡等细胞过程之间的紧密协调[21]。本研究CCK-8实验结果显示,Sp5-shRNA组细胞增殖能力较空白对照组和空载病毒组升高;EdU荧光染色实验结果显示,Sp5-shRNA组细胞增殖率较空白对照组和空载病毒组增加;提示沉默Sp5基因可促进mEPMCs细胞增殖。
细胞增殖能力的改变与细胞周期有关。本研究结果显示,沉默Sp5基因后mEPMCs 处于DNA 合成期(S期)的细胞比例升高,DNA合成前期(G0/G1期)的细胞比例降低,提示沉默Sp5基因后处于S 期的mEPMCs细胞增多。多种基因蛋白参与调控细胞周期,其中CyclinD1是调控细胞周期的关键蛋白[22],可通过调节细胞周期蛋白依赖性激酶(Cyclindependent kinases,CDKs)的活性,促进细胞从G1 期向S 期转变,从而促进细胞增殖[23]。本研究结果显示,沉默Sp5基因后,mEPMCs 中CyclinD1 蛋白和mRNA 表达水平高于空白对照组和空载病毒组,提示沉默Sp5基因后CyclinD1 表达上调,可能会使mEPMCs细胞周期由G0/G1期向S期转换,从而促进mEPMCs 细胞增殖。陈珏蓉等[24]研究表明,地塞米松可影响小鼠胚胎腭突Shh下游信号传递和初级纤毛解聚,抑制CyclinD1表达,从而抑制小鼠胚胎腭突细胞增殖,与本研究结果相似,提示Sp5通过Wnt信号通路调控mEPMCs细胞增殖及细胞周期参与腭的发育,但沉默Sp5基因后,Wnt 信号通路分子间是否存在相互作用尚需进一步探究。
综上所述,沉默Sp5基因可提高Wnt 信号通路相关因子β-catenin、GSK-3β、Wnt3a 表达,促进mEPMCs 细胞增殖及使其细胞周期从G0/G1 期向S期转变。深入研究Sp5基因在腭裂发生发展中的作用及其机制,这将为唇腭裂畸形的病因、早期筛查研究、疾病预防、诊疗提供新思路。
