肠道菌群改变影响CG-IUGR大鼠糖代谢的初步研究
2023-12-22袁冰舒李丽娟
袁冰舒,李丽娟
糖尿病(DM)发病的关键为胰岛素(insulin,INS)分泌减少和胰岛素抵抗(insulin resistance,IR),主要临床表现为糖原合成功能降低引起的血糖增高。糖原合成酶(glycogen synthetase,GYS)是调控糖原合成及维持血糖水平稳定的重要因素。目前DM 的发生机制仍不清楚。有学者指出宫内发育迟缓(intrauterine growth retardation,IUGR)个体,尤其是具有生长追赶的宫内发育迟缓(catch-up growth intrauterine growth retardation,CG-IUGR)个体,对DM等代谢性疾病的易感性明显增加[1-2]。已有研究表明肠道菌群异常与DM 的发生明显相关[3]。肠道菌群的组成及丰度变化受宿主遗传、生活方式和药物等多种因素影响,参与机体的多种生理和病理活动[4]。Nuli 等[5-6]研究发现,2 型糖尿病(T2DM)患者肠道菌群多样性显著低于健康人群;DM或T2DM个体肠道菌群的丰度均与正常个体有明显不同,表明肠道菌群变化与DM 的发生紧密相关,但肠道菌群改变是否介导CG-IUGR大鼠糖代谢异常尚不清楚。本研究通过检测糖代谢相关指标和肠道菌群的变化,分析CG-IUGR大鼠糖代谢功能降低与肠道菌群改变之间的关联,为CG-IUGR 个体DM 高易感提供潜在的防治靶点。
1 材料与方法
1.1 实验动物 体质量180~200 g 的8 周龄SD 大鼠雌性15只和雄性3只购自北京维通利华实验技术有限公司,动物生产许可证号:SCXK(京)2016-0006。
1.2 主要试剂和仪器 戊巴比妥钠购自北京化学试剂公司,125I 胰岛素放射免疫试剂购自北方生物技术研究所有限公司,PrimeScriptTMRT reagent Kit、SYBR®Premix Ex TaqTMⅡ试剂盒购自日本TaKaRa 公司,GYS 酶活性试剂盒和BCA 试剂盒购自Solarbio 公司,兔抗鼠糖原合成酶(GYS)1 及GYS2 多克隆抗体购自英国Abcam 公司,兔抗β-actin 单克隆抗体购自Absin 公司,羊抗兔IgG 抗体购自Sigma 公司,E.Z.N.ATMDNA 提取试剂盒购自美国Omega 公司,Qubit3.0 DNA 检测试剂盒购自美国Life 公司,Illumina MiSeq/HiSeq 测序平台由上海生物工程有限公司提供。
1.3 实验分组及处理 大鼠适应性喂养1周后,按照雌∶雄=5∶1比例交配,通过阴道涂片法确定受孕后,将孕鼠按照随机数字表法分为正常饲养组(3只)和营养不良组(12只)。正常饲养组孕期采用常规饲料饲养(饲料质量为30 g/d,热量为1 031.9 kJ/d),所产子代大鼠常规喂养至8 周龄后为Control组(8 只)。营养不良组孕期采用低热量饲料饲养(40%常规饲养量,饲料质量为12 g/d,热量为412.8 kJ/d),产下子代大鼠后,选取出生体质量低于Control 组新生大鼠平均体质量2个标准差的大鼠进行常规饲养,把3周龄时具有生长追赶的IUGR 大鼠(在早期生长发育过程中体质量追赶上或者超过Control组的大鼠)采用随机数字表法分为CG-IUGR组(8只)和CG-IUGR+肠菌组(8 只)。CG-IUGR+肠菌组用Control 组大鼠的粪便菌液进行灌胃,每周1 次,共6 次。Control 组和CG-IUGR组用同量生理盐水灌胃,同时3组大鼠均继续采用常规饲养至8 周龄。在0~8 周龄期间,每周测量3 组大鼠的体质量和身长(从鼻尖到尾根部),计算体质量指数(BMI),评估大鼠生长发育情况。所有动物生长至8周龄时进行后续指标的检测。菌液制备:在无菌超净台中,采用提尾反射法收集Control组大鼠新鲜排出的粪便,称质量后用生理盐水将粪便10倍稀释,细致研磨后过滤粪便残渣得到新鲜菌液。
1.4 葡萄糖代谢功能检测
1.4.1 空腹血糖(fasting blood glucose,FBG)和空腹胰岛素(fasting serum insulin,FINS)水平检测 每组取6 只大鼠,空腹12 h后,通过断尾法取尾静脉血,用强生血糖仪检测3组大鼠的FBG水平;腹腔注射2%戊巴比妥钠(2 mL/kg)麻醉大鼠后,分离颈动脉取血并提取血清,按照试剂盒说明书检测血清FINS水平。
1.4.2 葡萄糖耐量试验(glucose tolerance test,GTT)和胰岛素耐量试验(insulin tolerance test,ITT) 每组取6 只大鼠。GTT:大鼠空腹12 h 后,经腹腔缓慢注射20%葡萄糖注射液(2 g/kg),并在注射后的0、15、30、60、90 及120 min 采集尾静脉血,用强生血糖仪检测血糖水平;ITT:大鼠空腹12 h后,经腹腔缓慢注射INS 注射液(0.1 U/kg),检测血糖,检测方法同GTT。
1.4.3 放射免疫法检测葡萄糖负荷后15 min 血清INS 水平 每组取6 只大鼠,腹腔注射2%戊巴比妥钠(2 mL/kg)麻醉大鼠后,经腹腔注射20%葡萄糖注射液(2 g/kg)15 min后,取颈动脉血后分离血清,按照试剂盒说明书检测大鼠血清INS水平。
1.5 大鼠粪便16S rDNA 测序及分析 每组取5 只大鼠,收集大鼠粪便,按照试剂盒说明书提取DNA,琼脂糖凝胶电泳检测DNA 完整性,进行PCR 扩增及DNA 纯化回收,然后用Qubit3.0 DNA试剂盒进行定量,上机终浓度为20 pmol/L。对样本序列进行聚类分析,在97%相似水平下的操作分类单元(operational taxonomic units,OTU)进行生物信息统计分析;基于OTU 计算出Alpha 多样性指数,包括反应物种丰富度的ACE 指数和Chao1 指数,以及反应物种多样性的Shannon 指数和Simpson指数;将序列进行物种分类,最后整理得到属水平物种差异性比较结果。
1.6 骨骼肌及肝脏GYS 的表达及活性检测 每组取6 只大鼠,腹腔注射2%戊巴比妥钠(2 mL/kg)麻醉后,取其骨骼肌和肝脏组织,检测GYS 的mRNA 和蛋白表达水平及其酶活性。
1.6.1 实时荧光定量聚合酶链式反应(qPCR)检测骨骼肌GYS1 和肝脏GYS2 的mRNA 表达水平 提取骨骼肌和肝脏组织总RNA,并按照PrimeScriptTMRT reagent Kit 说明书将其逆转成为cDNA。根据SYBR®Premix Ex TaqTMⅡ试剂盒说明书进行检测,反应条件:95 ℃预变性30 s;95 ℃变性10 s,55~65 ℃退火30 s,40 个循环。反应体系为20 μL:cDNA 2 μL,SYBR Premix Ex Taq TMⅡ10 μL,PCR上、下游引物(10 μmol/L)各1 μL,ddH2O 6 μL。引物由上海捷瑞生物工程有限公司设计合成,见表1。采用2-ΔΔCt法分析骨骼肌GYS1和肝脏GYS2mRNA的相对表达水平。

Tab.1 Primer sequences表1 引物序列
1.6.2 Western blot 检测骨骼肌GYS1 和肝脏GYS2 的蛋白表达水平 提取骨骼肌和肝脏组织总蛋白,并用BCA试剂盒测定蛋白浓度,经电泳、转膜、封闭,加一抗兔抗GYS1 多抗(1∶10 000)/兔抗GYS2 多抗(1∶500)/兔抗β-actin 单抗(1∶5 000),4 ℃摇动孵育过夜,加二抗羊抗兔IgG抗体(1∶5 000),室温孵育2 h,TBST洗涤3次,ECL显影拍照。通过Image J软件分析各个蛋白条带灰度值,以目的蛋白/β-actin 灰度值比值表示目的蛋白的相对表达量。
1.6.3 骨骼肌和肝脏GYS 酶活性检测 提取骨骼肌和肝脏组织总蛋白,用BCA 试剂盒测定蛋白浓度后,按照GYS 酶活性试剂盒说明书测定GYS的酶活性。
1.7 统计学方法 采用SPSS 18.0 软件进行数据分析,符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法;多个时间点体质量分析采用重复测量方差分析;采用STAMP 软件对菌群丰度进行差异性分析并结合SPSS进行Welch'st-test分析。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠的生长发育情况 CG-IUGR 组出生时的身长、体质量均明显低于Control 组大鼠,随着周龄增加,与CG-IUGR 组大鼠相比较,CG-IUGR+肠菌组大鼠的体质量和BMI 增长速度均有减缓(P<0.05),见图1—3。

Fig.1 Changes of body length from birth to 8 weeks in three groups of rats图1 3组大鼠0—8周龄的身长变化
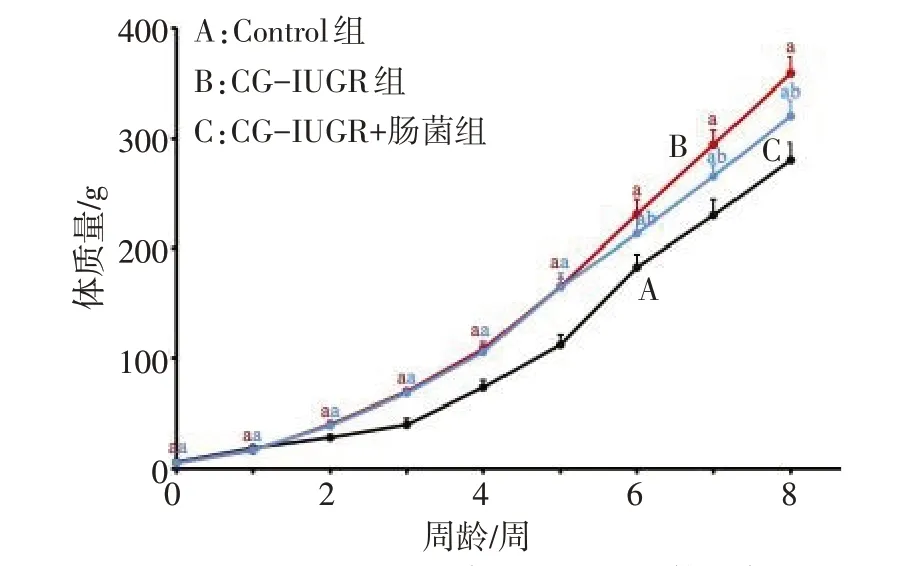
Fig.2 Changes of body weight from birth to 8 weeks in three groups of rats图2 3组大鼠0—8周龄的体质量变化
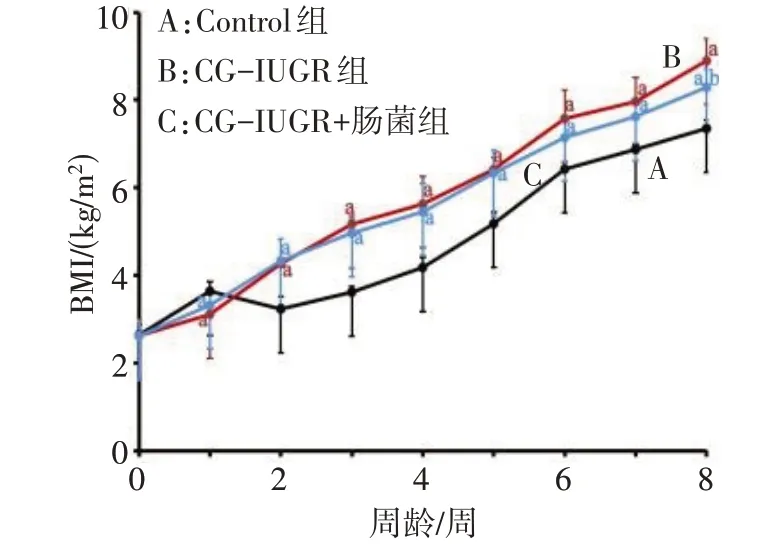
Fig.3 Changes of body mass index from birth to 8 weeks in three groups rats图3 3组大鼠0—8周龄的BMI变化
2.2 大鼠葡萄糖代谢功能的变化
2.2.1 FBG 和FINS 水平 与Control 组比较,CGIUGR组FINS水平降低(P<0.05),与CG-IUGR组比较,CG-IUGR+肠菌组FINS水平升高(P<0.05);3组大鼠的FBG水平差异无统计学意义,见表2。
Tab.2 Comparison of FBG and FINS levels between three groups表2 各组大鼠FBG及FINS水平比较 (n=6,±s)
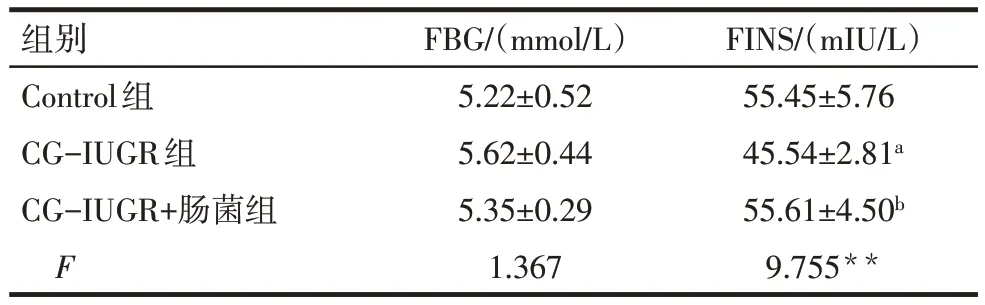
Tab.2 Comparison of FBG and FINS levels between three groups表2 各组大鼠FBG及FINS水平比较 (n=6,±s)
**P<0.01;a与Control组比较,b与CG-IUGR组比较,P<0.05。
组别Control组CG-IUGR组CG-IUGR+肠菌组F FBG/(mmol/L)5.22±0.52 5.62±0.44 5.35±0.29 1.367 FINS/(mIU/L)55.45±5.76 45.54±2.81a 55.61±4.50b 9.755**
2.2.2 葡萄糖耐量及INS 耐量情况 GTT 结果显示,3 组大鼠在葡萄糖负荷后各个时间点的血糖均升高,且均在15 min 时达最大值。与Control 组比较,CG-IUGR组糖负荷后各时间点的血糖水平均升高(P<0.05);ITT结果显示,CG-IUGR组INS负荷后血糖水平明显高于Control 组(P<0.05);与CGIUGR 组比较,CG-IUGR+肠菌组大鼠糖负荷和INS负荷后的血糖均有所下降(P<0.05)。见图4—5。

Fig.4 Changes of GTT blood glucose in 3 groups of rats图4 3组大鼠GTT血糖的变化
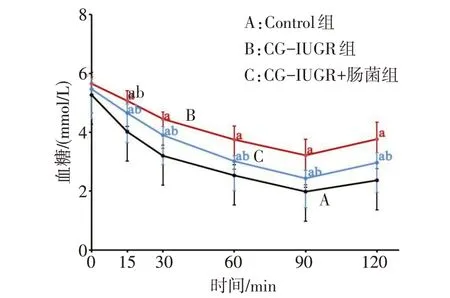
Fig.5 Changes of ITT blood glucose in 3 groups of rats图5 3组大鼠ITT血糖的变化
2.2.3 葡萄糖负荷后15 min血清INS水平比较 葡萄糖负荷后15 min,Control 组、CG-IUGR 组和CGIUGR+肠菌组血清INS 水平(mIU/L)分别为67.23±13.44、169.43±37.19 和119.24±31.81,其差异有统计学意义(n=6,F=18.247,P<0.05);CG-IUGR 组和CG-IUGR+肠菌组血清INS 水平均高于Control 组(P<0.05),CG-IUGR+肠菌组血清INS 水平低于CG-IUGR组(P<0.05)。
2.2.4 骨骼肌GYS1 和肝脏GYS2 的mRNA 表达水平 与Control 组相比,CG-IUGR 组骨骼肌GYS1 和肝脏GYS2 mRNA 表达水平均降低(P<0.05);与CG-IUGR组相比,CG-IUGR+肠菌组骨骼肌GYS1和肝脏GYS2 mRNA 表达水平均升高(P<0.05),见表3。
Tab.3 Comparison of mRNA expression levels of GYS1 in skeletal muscle and GYS2 in liver between three groups表3 3组大鼠骨骼肌GYS1和肝脏GYS2 mRNA表达水平比较(n=6,±s)

Tab.3 Comparison of mRNA expression levels of GYS1 in skeletal muscle and GYS2 in liver between three groups表3 3组大鼠骨骼肌GYS1和肝脏GYS2 mRNA表达水平比较(n=6,±s)
*P<0.05,**P<0.01;a 与Control 组比较,b 与CG-IUGR 组比较,P<0.05。
组别Control组CG-IUGR组CG-IUGR+肠菌组F GYS1 1.00±0.00 0.70±0.19a 0.97±0.25b 4.822*GYS2 1.00±0.00 0.56±0.17a 0.88±0.20b 13.126**
2.2.5 骨骼肌GYS1 和肝脏GYS2 的蛋白表达水平 与Control 组相比,CG-IUGR 组骨骼肌GYS1 和肝脏GYS2 的蛋白表达均降低(P<0.05);与CGIUGR 组相比,CG-IUGR+肠菌组骨骼肌GYS1 和肝脏GYS2的蛋白表达均升高(P<0.05),见图6、表4。
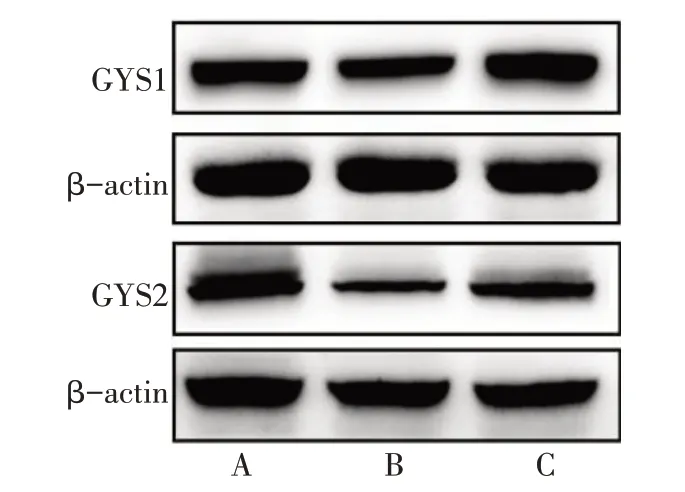
Fig.6 Protein expression of GYS1 in skeletal muscle and GYS2 in liver of rats in each group图6 3组大鼠骨骼肌GYS1和肝脏GYS2的蛋白表达水平
Tab.4 Comparison of skeletal muscle GYS1 and liver GYS2 protein expression between three groups表4 3组大鼠骨骼肌GYS1和肝脏GYS2蛋白表达水平比较(n=6,±s)
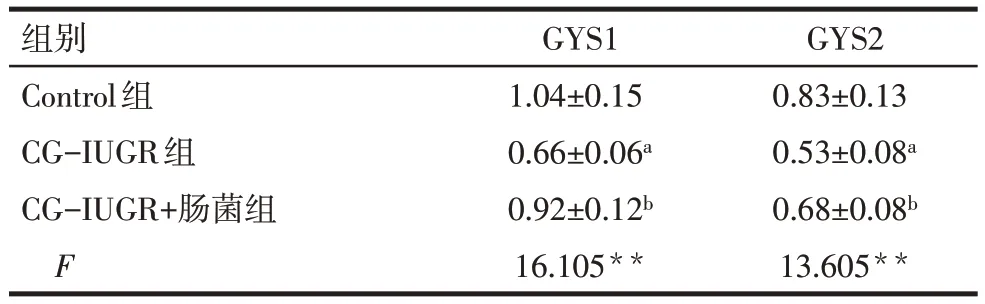
Tab.4 Comparison of skeletal muscle GYS1 and liver GYS2 protein expression between three groups表4 3组大鼠骨骼肌GYS1和肝脏GYS2蛋白表达水平比较(n=6,±s)
**P<0.01;a与Control组比较,b与CG-IUGR组比较,P<0.05。
组别Control组CG-IUGR组CG-IUGR+肠菌组F GYS1 1.04±0.15 0.66±0.06a 0.92±0.12b 16.105**GYS2 0.83±0.13 0.53±0.08a 0.68±0.08b 13.605**
2.2.6 骨骼肌和肝脏GYS 酶活性 与Control 组相比,CG-IUGR组骨骼肌和肝脏GYS的酶活性均降低(P<0.05);与CG-IUGR 组相比,CG-IUGR+肠菌组骨骼肌和肝脏GYS酶活性均升高(P<0.05),见表5。
Tab.5 Comparison of skeletal muscle and liver GYS enzyme activity between three groups表5 3组大鼠骨骼肌和肝脏GYS酶活性比较(n=6,U/mg,±s)
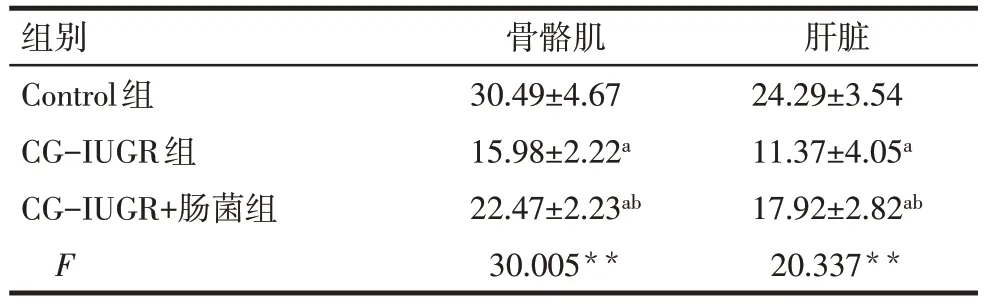
Tab.5 Comparison of skeletal muscle and liver GYS enzyme activity between three groups表5 3组大鼠骨骼肌和肝脏GYS酶活性比较(n=6,U/mg,±s)
**P<0.01;a与Control组比较,b与CG-IUGR组比较,P<0.05。
组别Control组CG-IUGR组CG-IUGR+肠菌组F骨骼肌30.49±4.67 15.98±2.22a 22.47±2.23ab 30.005**肝脏24.29±3.54 11.37±4.05a 17.92±2.82ab 20.337**
2.3 3 组大鼠肠道菌群多样性和结构分析 3 组大鼠肠道菌群OTU 以及Shannon、Simpson 指数比较差异均无统计学意义,而CG-IUGR组的ACE、Chao1指数低于Control 组(P<0.05);与CG-IUGR 组相比,CG-IUGR+肠菌组的ACE、Chao1 指数升高(P<0.05)。见表6。3 组肠道双歧杆菌相对丰度差异有统计学意义(n=5,F=4.202,P<0.05),与CG-IUGR组(0.06±0.04)相比,CG-IUGR+肠菌组(1.12±1.00)肠道双歧杆菌相对丰度增加(P<0.05),但Control组大鼠(0.40±0.25)和CG-IUGR 组大鼠的双歧杆菌相对丰度无统计学意义。
Tab.6 Diversity analysis of intestinal flora in each group表6 各组大鼠肠道菌群的多样性分析(n=5,±s)
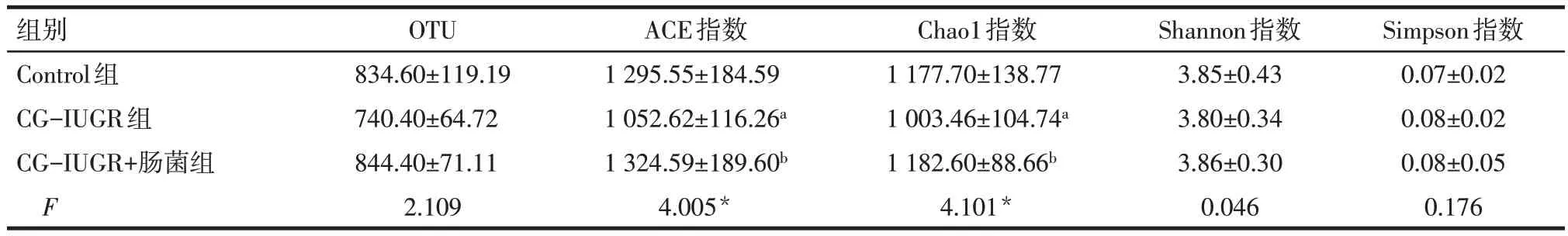
Tab.6 Diversity analysis of intestinal flora in each group表6 各组大鼠肠道菌群的多样性分析(n=5,±s)
*P<0.05;a与Control组比较,b与CG-IUGR组比较,P<0.05。
组别Control组CG-IUGR组CG-IUGR+肠菌组F OTU 834.60±119.19 740.40±64.72 844.40±71.11 2.109 ACE指数1 295.55±184.59 1 052.62±116.26a 1 324.59±189.60b 4.005*Chao1指数1 177.70±138.77 1 003.46±104.74a 1 182.60±88.66b 4.101*Shannon指数3.85±0.43 3.80±0.34 3.86±0.30 0.046 Simpson指数0.07±0.02 0.08±0.02 0.08±0.05 0.176
3 讨论
DM是常见的代谢紊乱性疾病,主要与遗传及环境因素改变等有关。DM 的发病可追溯至胚胎发育的时期。大量研究发现,胚胎期营养不良个体成年后易患肥胖及DM等代谢性疾病[1-2]。Long等[7]采用孕期摄入33%正常饮食量的方法建立IUGR 大鼠模型,IUGR 大鼠出生体质量及BMI 均显著低于对照组,之后出现生长追赶并在3 周时体质量超过对照组,该大鼠在9 周龄时的BMI 超过对照组。郑锐丹等[8]采用孕期30%正常饮食量的方法建立IUGR 大鼠模型,发现刚出生的IUGR大鼠体质量及身长明显低于对照组,在12周龄时该大鼠的体质量及BMI均显著高于对照组。Wu 等[9]发现低蛋白饮食法建立IUGR 大鼠亦得到相同的结果。可见不同方法复制的IUGR 动物模型可有不同程度的生长追赶及肥胖倾向。本研究通过低热量饮食法建立的IUGR大鼠,在其生长发育过程中的身长、体质量及BMI 也显著高于对照组大鼠,提示低热量饮食法建立的IUGR大鼠也有生长追赶现象及肥胖倾向。
糖尿病的发病机制主要表现为INS分泌减少和IR 效应。Wang 等[10]通过对比正常出生的胎儿与长期处于饥饿环境中的妊娠期母体所产的胎儿在成年后T2DM的患病率,发现后者成年后患T2DM的风险明显增加。Long等[7-8]发现IUGR大鼠在成年后存在葡萄糖耐受不良及INS敏感性受损现象。Chen等[11]采用缺氧干预妊娠期母体建立IUGR小鼠模型,发现该小鼠成年后出现糖代谢异常现象。本研究发现8周龄CG-IUGR 大鼠对葡萄糖和INS 的耐受性均降低,糖负荷15 min的血清INS水平均增高,提示低热量饮食法建立的CG-IUGR 大鼠亦具有葡萄糖耐受不良及IR效应。
GYS 是糖原合成的关键限速酶,对维持血糖的动态平衡起重要作用。哺乳动物的GYS主要包括两个亚型,GYS1主要表达于骨骼肌,GYS2主要表达于肝脏。研究显示,GYS 的表达及活性降低是DM,特别是T2DM 发病的重要机制[12-14]。Ren 等[12]研究表明T2DM 大鼠肝糖原含量显著降低,GYS 酶活性同步下调;Oyenihi等[13]采用高糖饮食和腹膜内注射低剂量链脲佐菌素的方法复制T2DM 大鼠模型,发现其骨骼肌糖原含量显著降低,GYS酶活性同步降低;Luo 等[14]的研究证实T2DM 小鼠肝糖原和肌糖原含量显著降低。这些研究提示T2DM大鼠存在糖原合成功能受损现象,且其机制可能与GYS 的表达水平及活性降低有关。Xirouchaki 等[15]发现GYS1 基因敲除小鼠餐后血糖明显升高,同时骨骼肌糖原含量明显下降,表现出明显的葡萄糖耐受不良和IR 效应。Deng 等[16]采用添加高糖和高胰岛素的培养基培养IR-HepG2 细胞,发现其细胞糖原含量显著降低,同时GYS2的表达水平及活性显著下调。本研究也发现成年CG-IUGR 大鼠骨骼肌GYS1 和肝脏GYS2 mRNA和蛋白的表达水平下调,同时其相应组织GYS 的酶活性也同步降低,提示低热量饮食法建立的CG-IUGR大鼠存在糖代谢异常,其机制可能与GYS的表达下调和酶活性降低有关。
肠道菌群与机体的多种生理和病理活动密切相关。Fassatoui等[17]发现,T2DM患者肠道疣微菌门嗜黏蛋白-艾克曼菌的相对丰度降低,且与其血糖水平及糖化血红蛋白水平呈负相关。Zhang 等[18]通过高脂饮食和腹腔注射链脲佐菌素建立T2DM 大鼠,发现其肠道菌群的多样性降低且组成发生改变,表现为厚壁菌门乳杆菌属的相对丰度增加。另有学者发现T2DM 大鼠肠道嗜黏蛋白-艾克曼菌的相对丰度降低,硬壁菌门/拟杆菌门的比例升高[19]。Yu 等[20]研究发现,与移植正常小鼠肠菌的无菌小鼠相比,移植了T2DM 小鼠肠菌的无菌小鼠FBG 水平显著升高,同时肠道拟杆菌门的相对丰度明显增加。有学者研究发现,移植了正常成人肠道菌群的T2DM 小鼠以及给予双歧杆菌灌胃的T2DM 小鼠,二者的血糖水平均有所降低[21-22]。这些研究提示T2DM 大鼠和小鼠均表现出不同程度的肠菌组成和丰度改变。本研究中CG-IUGR组大鼠与Control组相比较,肠道菌群ACE、Chao1 指数降低,表明其物种丰富度下降;与CG-IUGR 组相比,CG-IUGR+肠菌组大鼠肠道菌群ACE、Chao1 指数增高,表明其物种丰富度有所增加;与CG-IUGR 组大鼠相比,CG-IUGR+肠菌组大鼠相应组织GYS 的表达及活性均有所提升,其肥胖倾向及对葡萄糖和INS 的耐受性均有所改善。结合既往研究提示,本研究认为IUGR 可降低CGIUGR大鼠的糖代谢能力,其机制可能与肠道菌群丰富度降低下调了GYS 的表达及酶活性有关,但二者之间的关系还需要进一步研究证实。另外,本研究观察到CG-IUGR+肠菌组肠道双歧杆菌的相对丰度与CG-IUGR组相比有所增高,但该变化在Control组和CG-IUGR组间差异无统计学意义,可见双歧杆菌的改变与CG-IUGR 大鼠糖代谢异常之间的关系还需要进一步实验证实。
Li 等[23]采用8%蛋白饮食法建立IUGR 小鼠,发现IUGR小鼠出生后胰岛面积减少及INS表达降低,提示胰腺发育受损。相萌等[24]采用低蛋白饮食法复制IUGR 小鼠模型,亦发现相同结果,证实IUGR 个体存在胰岛发育不良的问题。本研究结果发现,CG-IUGR 组大鼠FINS 水平相比Control 组大鼠下调,提示CG-IUGR 大鼠血清FINS 水平的降低可能与其胰腺发育受损有关,也可能是由于模型复制方法及糖代谢受损程度不同等导致IR 效应的进展不同有关。
综上,本研究结果表明,IUGR 可通过下调骨骼肌和肝脏GYS 的表达及活性降低CG-IUGR 大鼠的糖代谢功能,其机制可能与肠道菌群改变有关。
