紫草素调节Notch信号通路对肝癌细胞恶性生物学活性的影响
2023-12-22吴德建杨秋谢桂丹彭鑫
吴德建,杨秋,谢桂丹,彭鑫△
肝癌是常见的恶性肿瘤,肝细胞癌(HCC)是肝癌的主要组织学亚型,约占原发性肝癌的90%,是癌症相关死亡的第二大原因[1]。尽管对肝癌手术治疗和分子靶向治疗的研究已有较多报道[2],但由于该病复发率高、转移率高、预后差,近30年的生存率仍然相对较低[3]。因此,迫切需要寻找新的肝癌治疗靶点并探索可能的相关分子机制。紫草素(SHI)是一种天然萘醌,富含于中草药紫草中,对癌症的治疗有积极效果[4]。Bao 等[5]研究显示,SHI 可以通过抑制癌细胞侵袭、迁移以及上皮间质转化(EMT)来抑制三阴性乳腺癌的发展。SHI还可抑制宫颈癌细胞增殖、迁移[6]。近期研究发现SHI 治疗HCC 有积极作用[7]。Notch 信号传导在肝脏稳态和肝癌发生中起关键作用,Notch信号的持续失调会对肝脏炎症和肿瘤发展产生重要影响[8]。Shi 等[9]研究发现,抑制Notch信号通路可以促进肝卵圆细胞分化为肝细胞,进而减轻肝损伤。Xu等[6]的研究表明抑制Notch 信号通路中hairy相关转录因子(HEY)1的表达可以抑制肝癌细胞的转移。本研究旨在探讨SHI是否可以通过抑制Notch信号通路,降低肝癌细胞恶性生物学活性,进而发挥抗癌作用。
1 材料与方法
1.1 组织标本 收集2018 年1 月—2022 年1 月在儋州市人民医接受腹腔镜精准切除术的20例肝癌患者的癌组织及癌旁组织标本,所有患者均有慢性乙型肝炎病史,术前均未接受经导管动脉化疗栓塞术、免疫治疗或靶向抗癌治疗。本研究取得患者及其家属同意,且经我院伦理审查委员会批准(批号:2017-10-007)。
1.2 细胞及主要材料 SHI 购自南京赛泓瑞生物科技有限公司;CCK-8试剂盒购自上海广锐生物科技有限公司;Notch通路激活剂丙戊酸(VPA)、Notch 信号抑制剂DAPT 均购自MedChemExpress LLC;正常肝细胞HL-7702 细胞及肝癌HepG2、Hep3B、HCCLM3、Huh-7、SMMC-7721 细胞均购自上海名劲生物科技有限公司;Notch、内参蛋白GAPDH 兔抗人一抗、辣根过氧化物酶(HRP)标记的山羊抗兔IgG 二抗购自英国Abcam 公司;发状分裂相关增强子-1(HES1)兔抗人一抗购自NSJ Bioreagents;HEY1兔抗人一抗购自Biotrend;B淋巴细胞瘤-2基因(Bcl-2)、Bcl-2相关X蛋白(Bax)、活化的胱天蛋白酶-3(cleaved-Caspase-3)、钙黏蛋白E(E-Cadherin)、神经性钙黏素(N-cadherin)、波形蛋白(Vimentin)兔抗人一抗购自Cell Signaling Technology;NovoCyte 流式细胞仪购自广州柏赛柯生物技术有限公司;Transwell小室购自北京达科为生物技术有限公司。
1.3 细胞培养及分组 将肝癌细胞(HepG2、Hep3B、HCCLM3、Huh-7、SMMC-7721)及正常肝细胞(HL-7702)用含有10%胎牛血清、1%青霉素-链霉素混合物的DMEM培养基(37 ℃,5%CO2)培养。将Notch、HES1及HEY1蛋白表达最高的肝癌细胞用于后续实验,分为对照组(未做任何处理)、LSHI 组(1 μmol/L SHI 处理)、M-SHI 组(2 μmol/L SHI 处理)、H-SHI 组(4 μmol/L SHI 处理)[10]、DAPT 组(50 μmol/L DAPT 处理[11])、H-SHI+VPA 组(4 μmol/L SHI 和8 mmol/L VPA[12]共同处理),培养48 h。
1.4 Western blot 检测Notch、EMT 相关蛋白、凋亡蛋白表达 将组织或各组肝癌细胞与裂解液混合,30 min后抽取蛋白通过BCA法定量,随后加入缓冲液进行SDS-PAGE电泳后转膜,成功后用脱脂牛奶封闭,加入一抗Bcl-2(1∶1 000)、Bax(1∶1 000)、cleaved-Caspase-3(1∶2 000)、Notch(1∶2 000)、(1∶2 000)、HEY1(1∶2 000)、E-cadherin(1∶2 000)、Ncadherin(1∶1 000)、Vimentin(1∶1 000)和GAPDH(1∶1 000),4 ℃下孵育过夜,加入二抗(1∶1 000),ECL试剂染色后,对目的条带拍照,以GAPDH 作为内参,用Image J 软件分析蛋白质条带。
1.5 CCK-8法检测Huh-7细胞增殖以及平板克隆实验检测细胞克隆形成能力 将Huh-7 细胞按5×103个/孔的密度接种在96 孔板,培养2 d 后,将Huh-7 细胞与10 μL CCK8 一起孵育2 h。使用酶标仪测定450 nm波长处的光密度(OD)值。
将Huh-7 细胞以1×105个/孔的密度接种到6 孔板中,培养15 d 后,磷酸盐缓冲液(PBS)洗涤,用4%多聚甲醛固定20 min,结晶紫染色后在显微镜下观察菌落。
1.6 流式细胞术检测Huh-7 细胞凋亡以及细胞周期 收集Huh-7 细胞,用PBS 冲洗2 次后,将Huh-7 细胞置于预冷的70%乙醇中固定2 h,随后以1 000×g离心5 min,与25 μL PI和10 μL RNase A避光孵育30 min,使用NovoCyte流式细胞仪进行细胞周期分析。将肝癌细胞配置成2.5×105个/mL悬浮液,取100 μL 细胞悬液与5 μL Annexin V-FITC、10 μL PI 孵育,使用NovoCyte流式细胞仪检测细胞凋亡率。
1.7 细胞划痕实验和Transwell 侵袭实验分别检测Huh-7细胞迁移和侵袭情况 (1)迁移。取各组肝癌细胞接种在6孔板,在37 ℃、5%CO2环境下培养,待细胞生长密度达70%,用移液器枪头制造人工划痕,随后加入无血清培养基,培养0、12 h置于显微镜下拍照。用Image J软件分析迁移率,迁移率(%)=[(0 h划痕面积-12 h划痕面积)/0 h划痕面积]×100%。(2)侵袭。用无血清培养基将肝癌细胞调整为5×104个/mL,Transwell 下室加入600 μL DMEM 培养基(含10%胎牛血清),Transwell上室先铺满基质胶,再加入200 μL无血清细胞悬液,Transwell小室置于37 ℃,5%CO2环境下培养24 h后用4%多聚甲醛固定,结晶紫染色,PBS洗涤后,擦拭上室未侵袭的肝癌细胞,于显微镜下计算穿膜细胞数。
1.8 统计学方法 采用SPSS 25.0 软件处理数据,计量数据行正态分布和方差齐性检验后以均数±标准差(±s)表示,2组间比较用t检验,多组间比较用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 Notch、HES1、HEY1 在组织和细胞中的表达 癌组织较癌旁组织Notch、HES1、HEY1 蛋白水平均升高(P<0.01);与HL-7702细胞相比,HepG2、Hep3B、HCCLM3、Huh-7、SMMC-7721 细胞中Notch、HES1、HEY1 蛋白水平均升高(P<0.05),且Huh-7细胞升高最明显,见表1、2,图1、2。以Huh-7细胞为研究对象。
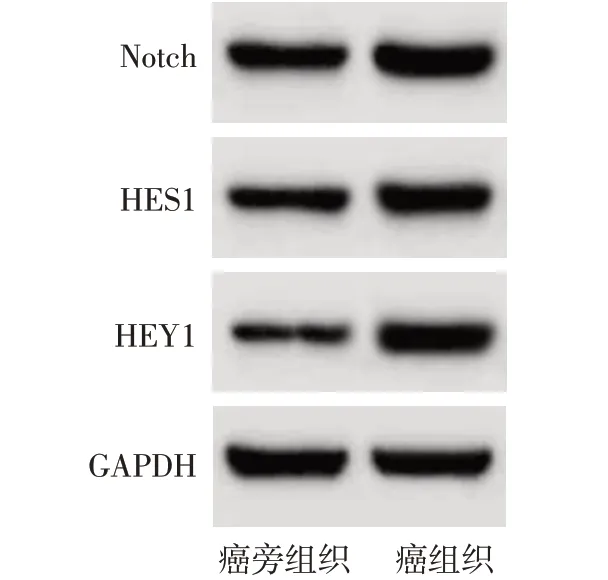
Fig.1 Western blot detection of Notch,HES1 and HEY1 protein expression in liver cancer tissue and adjacent tissue图1 Western blot检测肝癌组织及癌旁组织中Notch、HES1、HEY1蛋白表达

Fig.2 Western blot detection of Notch,HES1 and HEY1 protein levels in normal hepatocytes and hepatoma cells图2 Western blot检测正常肝细胞及肝癌细胞中Notch、HES1、HEY1蛋白水平
Tab.1 Expression of Notch,HES1 and HEY1 proteins in liver cancer tissue and adjacent tissue表1 Notch、HES1、HEY1蛋白在癌组织及癌旁组织中的表达(n=20,±s)

Tab.1 Expression of Notch,HES1 and HEY1 proteins in liver cancer tissue and adjacent tissue表1 Notch、HES1、HEY1蛋白在癌组织及癌旁组织中的表达(n=20,±s)
**P<0.01。
组别癌旁组织癌组织t Notch 0.78±0.09 1.41±0.13 17.819**HES1 0.63±0.07 1.24±0.11 10.633**HEY1 0.39±0.05 1.37±0.14 29.481**
Tab.2 Expression of Notch,HES1 and HEY1 proteins in normal liver cells and liver cancer cells表2 Notch、HES1、HEY1蛋白在正常肝细胞及肝癌细胞中的表达(n=6,±s)

Tab.2 Expression of Notch,HES1 and HEY1 proteins in normal liver cells and liver cancer cells表2 Notch、HES1、HEY1蛋白在正常肝细胞及肝癌细胞中的表达(n=6,±s)
**P<0.01;a与HL-7702细胞比较,P<0.05。
组别HL-7702细胞HepG2细胞Hep3B细胞HCCLM3细胞SMMC-7721细胞Huh-7细胞F Notch 0.60±0.06 1.41±0.13a 1.33±0.12a 1.35±0.14a 1.37±0.15a 1.60±0.17a 67.663**HES1 0.51±0.05 1.05±0.09a 1.13±0.12a 1.07±0.11a 1.09±0.13a 1.23±0.14a 52.880**HEY1 0.35±0.04 1.16±0.12a 1.22±0.13a 1.26±0.14a 1.24±0.16a 1.42±0.17a 81.609**
2.2 SHI 对Huh-7 细胞中Notch、HES1、HEY1 蛋白表达的影响 与对照组相比,L-SHI 组、M-SHI 组、H-SHI 组、DAPT 组Notch、HES1、HEY1 蛋白表达水平下调(P<0.05),且SHI 的作用效果呈现剂量依赖性;H-SHI+VPA 组较H-SHI 组Notch、HES1、HEY1蛋白表达水平上调(P<0.05),见图3、表3。
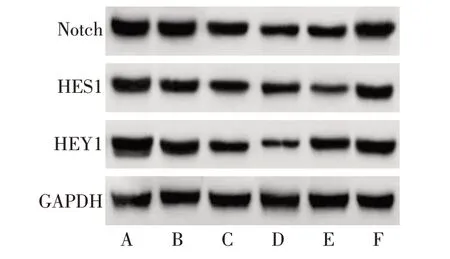
Fig.3 Western blot detection of effects of SHI on Notch,HES1 and HEY1 proteins in Huh-7 cells图3 Western blot检测SHI对Huh-7细胞中Notch、HES1、HEY1蛋白的影响
Tab.3 Effects of SHI on Notch,HES1 and HEY1 proteins in Huh-7 cells表3 SHI对Huh-7细胞中Notch、HES1、HEY1蛋白表达的影响(n=6,±s)
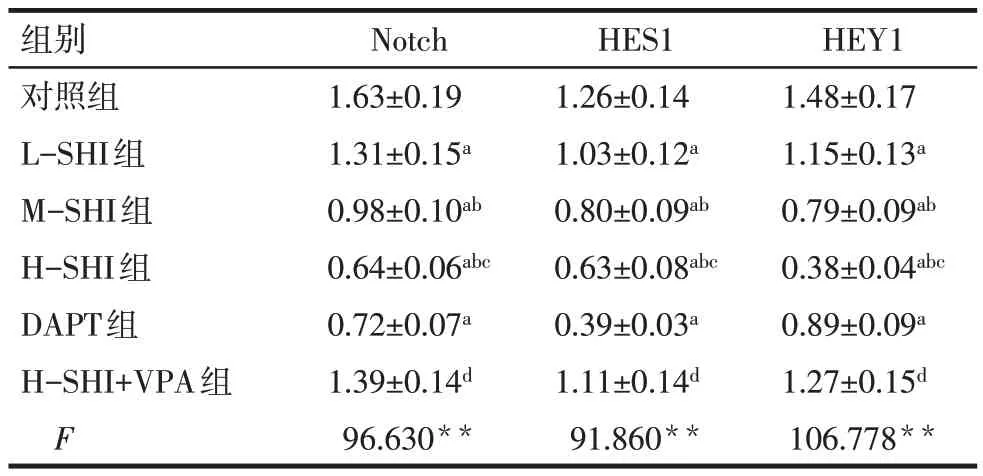
Tab.3 Effects of SHI on Notch,HES1 and HEY1 proteins in Huh-7 cells表3 SHI对Huh-7细胞中Notch、HES1、HEY1蛋白表达的影响(n=6,±s)
**P<0.01;a与对照组比较,b与L-SHI组比较,c与M-SHI组比较,d与H-SHI组比较,P<0.05;表4—8同。
组别对照组L-SHI组M-SHI组H-SHI组DAPT组H-SHI+VPA组F Notch 1.63±0.19 1.31±0.15a 0.98±0.10ab 0.64±0.06abc 0.72±0.07a 1.39±0.14d 96.630**HES1 1.26±0.14 1.03±0.12a 0.80±0.09ab 0.63±0.08abc 0.39±0.03a 1.11±0.14d 91.860**HEY1 1.48±0.17 1.15±0.13a 0.79±0.09ab 0.38±0.04abc 0.89±0.09a 1.27±0.15d 106.778**
2.3 SHI 对Huh-7 细胞增殖的影响 与对照组相比,L-SHI 组、M-SHI 组、H-SHI 组、DAPT 组OD450值及克隆数均降低(P<0.05),且SHI 的作用效果呈现剂量依赖性;H-SHI+VPA 组较H-SHI 组OD450值及克隆数升高(P<0.05),见图4、表4。
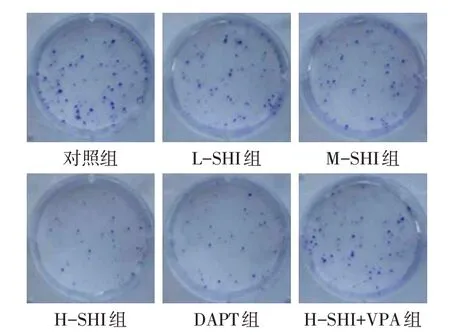
Fig.4 Effects of SHI on the formation of Huh-7 cell clone图4 SHI对Huh-7细胞克隆形成的影响
Tab.4 Effects of SHI on OD450 value and clone number of Huh-7 cells表4 SHI对Huh-7细胞OD450值及克隆数的影响(n=6,±s)

Tab.4 Effects of SHI on OD450 value and clone number of Huh-7 cells表4 SHI对Huh-7细胞OD450值及克隆数的影响(n=6,±s)
组别对照组L-SHI组M-SHI组H-SHI组DAPT组H-SHI+VPA组F OD450值1.33±0.14 1.12±0.11a 0.89±0.09ab 0.67±0.07abc 0.70±0.06a 1.18±0.12d 69.795**克隆数/个56.76±5.94 44.83±5.54a 35.37±4.65ab 24.16±2.21abc 26.73±2.02a 45.17±5.47d 32.725**
2.4 SHI 对Huh-7 细胞凋亡的影响 与对照组相比,L-SHI 组、M-SHI 组、H-SHI 组、DAPT 组G1/G0期细胞比例升高,S 期和G2/M 期细胞比例降低,凋亡率、Bax、cleaved-Caspase-3 均升高,Bcl-2 蛋白表达水平降低(P<0.05),且SHI 的作用效果呈现剂量依赖性;H-SHI+VPA 组较H-SHI组G1/G0期细胞比例、凋亡率、Bax、cleaved-Caspase-3 均降低(P<0.05),S期和G2/M期细胞比例、Bcl-2蛋白表达水平升高(P<0.05),见图5—7,表5、6。

Fig.5 Effects of SHI on cell cycle of Huh-7 cells by flow cytometry图5 流式细胞术检测SHI对Huh-7细胞细胞周期的影响

Fig.6 Detection of Huh-7 cell apoptosis by flow cytometry图6 流式细胞术检测Huh-7细胞凋亡
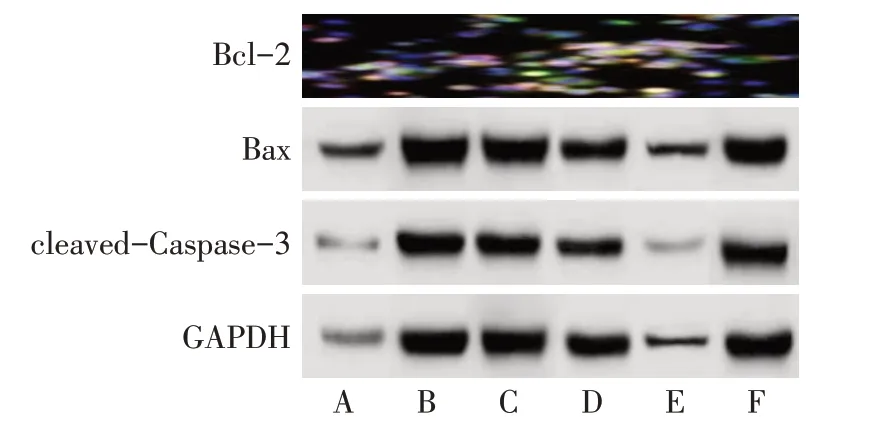
Fig.7 Effects of SHI on Bcl-2,Bax,cleaved-Caspase-3 protein levels in Huh-7 cells图7 SHI对Huh-7细胞中Bcl-2、Bax、cleaved-Caspase-3蛋白水平的影响
Tab.5 Effects of SHI on cell cycle of Huh-7 cells表5 SHI对Huh-7细胞细胞周期的影响(n=6,%,±s)

Tab.5 Effects of SHI on cell cycle of Huh-7 cells表5 SHI对Huh-7细胞细胞周期的影响(n=6,%,±s)
组别对照组L-SHI组M-SHI组H-SHI组DAPT组H-SHI+VPA组F细胞周期分布G1/G0 44.13±4.27 51.01±5.53a 52.89±5.76a 58.34±5.65a 57.23±5.34a 50.78±5.56d 9.124**S 38.45±3.56 33.65±3.16a 31.92±3.03a 26.53±2.45a 27.96±2.67a 33.12±3.32d 20.200**G2/M 17.42±1.69 15.34±1.79a 15.19±1.57a 15.13±1.35a 14.81±1.23a 16.10±1.37d 7.609**
Tab.6 Effects of SHI on apoptosis rate and apoptoticprotein of Huh-7 cells表6 SHI对Huh-7细胞凋亡率和凋亡蛋白的影响(n=6,±s)
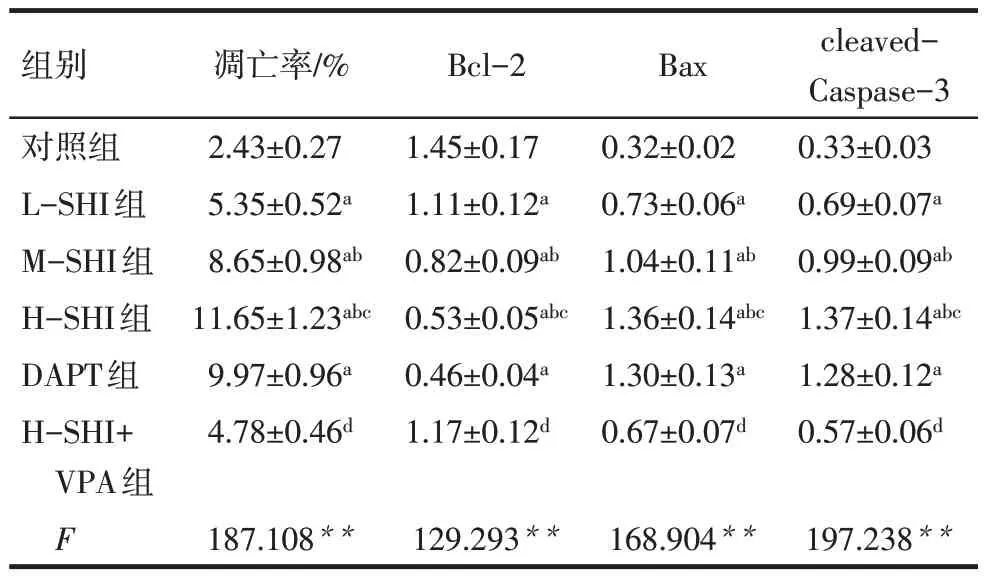
Tab.6 Effects of SHI on apoptosis rate and apoptoticprotein of Huh-7 cells表6 SHI对Huh-7细胞凋亡率和凋亡蛋白的影响(n=6,±s)
组别对照组L-SHI组M-SHI组H-SHI组DAPT组H-SHI+VPA组F凋亡率/%2.43±0.27 5.35±0.52a 8.65±0.98ab 11.65±1.23abc 9.97±0.96a 4.78±0.46d Bcl-2 1.45±0.17 1.11±0.12a 0.82±0.09ab 0.53±0.05abc 0.46±0.04a 1.17±0.12d Bax 0.32±0.02 0.73±0.06a 1.04±0.11ab 1.36±0.14abc 1.30±0.13a 0.67±0.07d cleaved-Caspase-3 0.33±0.03 0.69±0.07a 0.99±0.09ab 1.37±0.14abc 1.28±0.12a 0.57±0.06d 187.108**129.293**168.904**197.238**
2.5 SHI 对Huh-7 细胞侵袭、迁移以及EMT 相关蛋白的影响 与对照组相比,L-SHI 组、M-SHI 组、HSHI 组、DAPT 组迁移率、侵袭细胞数目以及Ncadherin、Vimentin 水平降低(P<0.05),E-cadherin水平升高(P<0.05),且SHI 的作用效果呈现剂量依赖性;H-SHI+VPA 组较H-SHI 组迁移率、侵袭细胞数目以及N-cadherin、Vimentin水平升高(P<0.05),E-cadherin水平降低(P<0.05),见图8—10,表7、8。

Fig.8 Effects of SHI on the number of invasive cells of Huh-7 cells(×200)图8 SHI对Huh-7细胞侵袭细胞数量的影响(×200)

Fig.9 Effects of SHI on the migration rate of Huh-7 cells图9 SHI对Huh-7细胞迁移率的影响
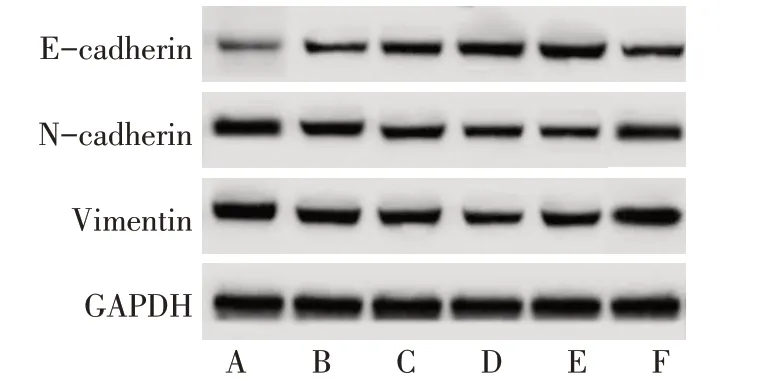
Fig.10 Western blot detection of E-cadherin,N-cadherin and Vimentin protein levels in Huh-7 cells图10 Western blot检测Huh-7细胞中E-cadherin、N-cadherin、Vimentin蛋白水平
Tab.7 Effects of SHI on migration rate and number of invasive cells of Huh-7 cells表7 SHI对Huh-7细胞迁移率和侵袭细胞数目的影响(n=6,±s)
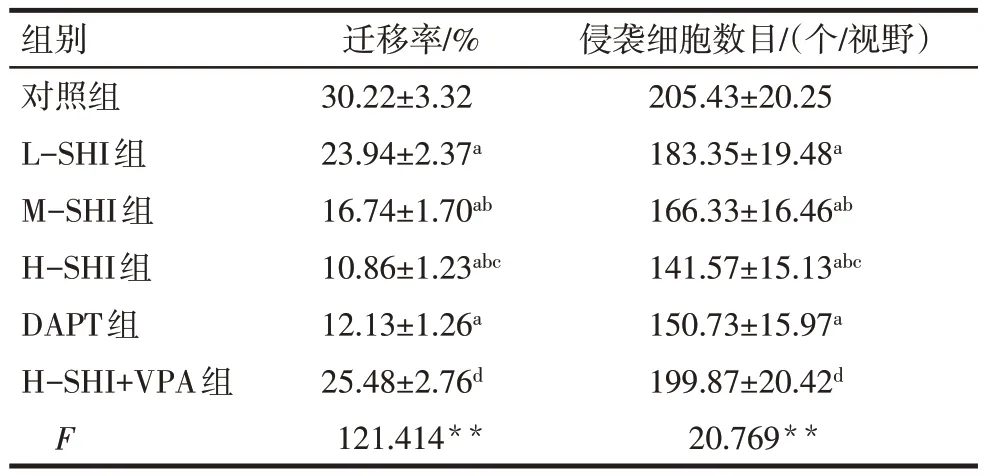
Tab.7 Effects of SHI on migration rate and number of invasive cells of Huh-7 cells表7 SHI对Huh-7细胞迁移率和侵袭细胞数目的影响(n=6,±s)
组别对照组L-SHI组M-SHI组H-SHI组DAPT组H-SHI+VPA组F迁移率/%30.22±3.32 23.94±2.37a 16.74±1.70ab 10.86±1.23abc 12.13±1.26a 25.48±2.76d 121.414**侵袭细胞数目/(个/视野)205.43±20.25 183.35±19.48a 166.33±16.46ab 141.57±15.13abc 150.73±15.97a 199.87±20.42d 20.769**
Tab.8 Effects of SHI on levels of E-cadherin,N-cadherin and Vimentin in Huh-7 cells表8 SHI对Huh-7细胞E-cadherin、N-cadherin、Vimentin表达水平的影响(n=6,±s)

Tab.8 Effects of SHI on levels of E-cadherin,N-cadherin and Vimentin in Huh-7 cells表8 SHI对Huh-7细胞E-cadherin、N-cadherin、Vimentin表达水平的影响(n=6,±s)
组别对照组L-SHI组M-SHI组H-SHI组DAPT组H-SHI+VPA组F E-cadherin 0.22±0.02 0.39±0.04a 0.57±0.06ab 0.78±0.09abc 0.72±0.07a 0.36±0.03d 148.635**N-cadherin 0.90±0.09 0.71±0.07a 0.52±0.05ab 0.30±0.02abc 0.35±0.03a 0.79±0.09d 143.108**Vimentin 1.18±0.21 0.98±0.09a 0.74±0.08ab 0.52±0.05abc 0.58±0.06a 1.04±0.13d 52.235**
3 讨论
由于肿瘤复发率高且常发生转移,HCC 患者的预后并不理想[13]。针对肿瘤细胞的恶性表型包括细胞增殖、迁移、侵袭和凋亡的治疗是缓解HCC 进展的重要策略。SHI 是细胞分裂周期25(Cdc25)磷酸酶的抑制剂,可诱导细胞周期停滞[3]。研究报道,SHI 可抑制多种人类癌细胞系的生长,可诱导前列腺癌细胞发生坏死性凋亡,进而抑制前列腺癌的发展[14]。Tsai 等[15]发现SHI可以诱导肾癌细胞程序性死亡。SHI 还可以促进HCC 细胞凋亡,抑制其增殖[7]。Li 等[16]也发现SHI 可以诱导结肠癌细胞周期停滞,抑制细胞增殖,表明SHI 具有广泛的抗癌作用。本研究发现,SHI 处理后Huh-7 细胞活力、S 期和G2期细胞比例、Bcl-2蛋白水平均降低,G1/G0期细胞比例、细胞凋亡率、Bax 和cleaved-Caspase-3 蛋白水平升高,表明SHI 可能通过上调促凋亡基因(Bax、cleaved-Caspase-3),下调抗凋亡基因(Bcl-2),来调节细胞周期,进而加速Huh-7细胞凋亡。研究报道,EMT是肝癌细胞发生转移的关键原因,上皮标志物E-cadherin 表达量降低以及间充质标志物N-cadherin、Vimentin表达量升高可以使肝癌细胞获得间充质细胞的特性,从而促进肝癌细胞的运动性,导致肝癌的发展[17]。本研究发现SHI处理后Huh-7细胞迁移和侵袭数目、N-cadherin、Vimentin 蛋白水平均降低,E-cadherin 蛋白水平升高,表明SHI 可能通过使肝癌上皮细胞保持上皮特征,阻止其获得间质表型,进而抑制肝癌细胞扩散到其他邻近组织。
Notch 信号通路在癌症进展中的作用已经得到证实。Li 等[18]研究发现通过抑制结肠癌细胞中的Notch-HES1信号传导可抑制EMT,进而抑制结肠癌进展。Zhang 等[19]发现上调Notch 可促进乳腺癌细胞迁移。Xiang 等[11]发现抑制Notch 信号可促进肝癌细胞凋亡,从而起到抗癌作用。本研究结果与Xiang 等[11]的研究一致。在本研究中,Notch、HES1、HEY1在肝癌组织和肝癌细胞中高表达,且SHI处理后Huh-7 细胞中Notch、HES1、HEY1 蛋白表达水平下调,提示SHI可能通过抑制Notch信号通路发挥降低肝癌细胞恶性生物学行为的作用,为了进一步证实该结论,本研究用Notch 信号抑制剂DAPT 处理Huh-7细胞,SHI和Notch通路激活剂VPA共同处理Huh-7 细胞,结果发现DAPT 组效果与H-SHI 组相似,而VPA削弱了H-SHI抑制Huh-7细胞恶性生物学行为的作用,进一步证实SHI可能通过抑制Notch信号通路发挥抗肝癌作用。
综上所述,SHI 可能通过下调Notch 信号通路,抑制肝癌细胞恶性生物学行为,从而发挥抗肝癌作用,且SHI 的治疗效果呈现剂量依赖性。本研究不足之处是未观察其他与肝癌相关的通路是否也起到相同效果,后续将进行通路比较,完善相关治疗机制的研究。
