酶催化法测定13C 标记尿素同位素丰度
2023-12-21宋明鸣
雷 雯, 解 龙, 宋明鸣
(上海化工研究院有限公司 上海市稳定同位素检测及应用研发专业技术服务平台, 上海 200062)
尿素-13C 是尿素[13C]呼气试验诊断试剂的有效成份,被广泛应用于临床诊断幽门螺杆菌(helicobacter pylori, Hp)感染[1-2],Hp 是目前已知胃中唯一存活的微生物,当患者口服尿素-13C 药物后,胃中的Hp 含有人类细胞中不存在的高活性脲酶,在胃酸存在下可以将尿素-13C 分解成13CO2,13CO2被小肠上段吸收后进入血液循环,到达肺部随呼气排出[3-4]。使用专业的质谱仪或13C 红外光谱仪分析服药前后呼气样本,当基线差值(delta over baseline,DOB)≥4 可判定为阳性[5-7],即患者感染Hp,该方法因具有特异性高、无损伤、无放射性、快速等优势被公认为胃部感染Hp 诊断的金标准[8-9]。呼气试验诊断试剂及原料药尿素-13C 中同位素丰度的准确测定直接影响到临床检测结果,因此准确测定尿素-13C 的同位素丰度显得尤为重要。
现有尿素-13C 同位素丰度检测方法主要有液相色谱串联质谱法[10]、气相色谱串联质谱法[11]、傅立叶变换-离子回旋共振质谱法[12]和气体同位素质谱法[13]等。尿素-13C 原料药同位素丰度检测标准主要有美国药典方法和行业标准方法[14],美国药典方法采用气相色谱串联质谱法,早期的2014 版美国药典[15]方法中无需衍生化处理,直接测定尿素-13C 的同位素丰度,但现行2022 版的美国药典方法[16]中采用衍生化的方法,衍生化步骤相对繁琐。行业标准方法的原理是利用亚硝酸具有强氧化性[13],将尿素-13C 氧化生成13CO2,但在反应过程中亚硝酸易分解生成NO2等杂质气体,同时该方法也不具有选择性。市场上尿素[13C]呼气试验诊断试剂主要分为2 类:①胶囊,尿素-13C 为纯物质;②试剂盒,试剂盒中除了尿素-13C 外,还有辅料甘露醇、阿司帕坦、枸橼酸等物质[17],试剂盒中的辅料绝对不能添加食品级的碳酸盐,因为碳酸盐在胃酸中反应生成CO2,对测试结果进行干扰,针对不同类型尿素[13C]呼气试验诊断试剂,现有的检测技术均无法模拟“胃”中的反应过程,因此开发一种既可以模拟“胃”中的反应过程,又快速的、专一性测试结果准确的尿素-13C 同位素丰度检测方法显得尤为重要。
胃中存在的Hp 含有人类细胞中不存在的高活性脲酶,在胃酸存在下可以将尿素-13C 分解成13CO2。脲酶是一种含镍的寡聚酶,高活性的非氧化还原金属酶,将尿素催化转化生成碳酸铵,酸性条件下分解产生二氧化碳。脲酶也被认为是目前已知的催化效率最高的水解酶[18]。脲酶分解尿素的方法在其它领域应用相对比较成熟[19-21],但用于呼气试验诊断试剂及原料药尿素-13C 的测定却未见文献报道。本研究主要对酶活性的最佳温度、最优的反应时间和脲酶用量等参数进行了优化,并就酶催化法与行业标准方法测定13C 同位素丰度的结果、方法精密度、准确度等进行了对比,初步建立了基于酶催化法测定尿素-13C 同位素丰度检测方法。
1 实验部分
1.1 主要仪器与试剂
MAT-271 气体同位素质谱仪(美国Finnigan质谱公司);DF-101Z 智能集热式恒温磁力搅拌器(上海卫凯仪器设备有限公司);ML204T 电子天平(梅特勒托利多科技(中国)有限公司)。
尿素-13C(99.25%13C(原子百分比,下同),上海化工研究院有限公司);标样尿素-13C(≥99.0%13C,3 个批号:I0H205、I1H205 和R081Q0,USP 参考标准);尿素-13C(99.4%13C,批号:U822503,多伦多化学研究公司);浓硫酸(AR,江苏强盛化工有限公司);脲酶(~1 U/mg,西格玛奥德里奇(上海)贸易有限公司);尿素(AR,天然丰度1.11%13C)、甘露醇(AR)、亚硝酸钠(AR),均为国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 质谱条件
电子轰击(electron impact,EI)离子源;离子源温度130 ℃;电子能量100 eV;法拉第杯;高压10 kV;质量扫描30~50 m/z。
1.2.2 酶催化法转化原理
酶具有专一性,尿素-13C 在脲酶水溶液的存在下催化转化生成碳酸铵-13C,碳酸铵-13C 在酸性条件下分解产生13CO2,将13CO2气体引入MAT-271气体同位素质谱仪中检测质荷比为44 和45 离子流强度,并计算13C 同位素丰度。
1.2.313C 同位素丰度计算公式
CO2质荷比为44,13CO2质荷比为45,将反应生成的13CO2气体引入到MAT-271 气体同位素质谱仪中,检测质荷比为44 和45 的离子流强度,利用行业标准方法[14]计算13C 同位素丰度:
式中,E、I44、I45分别表示待测物质13C 同位素丰度、质荷比为44 的离子流强度和质荷比为45 的离子流强度。
1.2.4 样品前处理
图1、2 分别为进样旋塞阀和三球反应管的示意图。取3~10 mg 尿素-13C、50 mg 脲酶加入三球反应管中的“A”位置或“B”位置,取1~2 mL 蒸馏水放入三球反应管中的“A”位置,取0.5~1 mL,3 mol/L 硫酸溶液放入三球反应管中的“C”位置,进样旋塞阀“4”与三球反应管“5”连接,进样旋塞阀“1”与真空系统连接,打开旋塞阀“2”和“3”,抽真空。待液体中无气泡,此时可将进样旋塞阀中的旋塞阀“2”和“3”关闭,将三球反应管和进样旋塞阀从真空系统中取下,先将“A”中的蒸馏水倒入“B”球泡中,3~5 min 后再将“C”中的硫酸溶液倒入“B”球泡中混合后生成13C 标记二氧化碳气体即可作为测定13C 同位素丰度的样品气。玻璃连接处均涂抹高真空硅脂。

图1 进样旋塞阀Fig.1 Injection stopcock

图2 三球反应管Fig.2 Three ball reaction tube
在对仪器做好必要的校正设置后,进样旋塞阀“1”接入气体同位素质谱仪,将三球反应管的球泡浸入酒精液氮调制的冷冻液中数分钟,利用气体同位素质谱仪的进样系统抽真空,待真空度低于50 Pa 后,打开旋塞阀“2”和“3”,将三球反应管内的13CO2引入气体同位素质谱仪中,检测质荷比为44和45 的离子流强度,通过式(1)计算13C 同位素丰度。
2 结果与讨论
2.1 反应温度的考察
酶催化反应的3 大特点为:专一性、温和性和高效性。酶的温和性是指酶催化反应需要在相对温和的条件下进行,适宜pH 和温度,尿素-13C 与脲酶的水溶液pH 接近7.0,脲酶活性最佳pH 为7.4,pH 在适宜的范围内。“A”球泡中的蒸馏水在抽真空时会出现温度降低的现象,温度低至10 ℃,此温度下酶的活性不足,反应温度过高又会造成酶失活,选择适宜的反应温度对准确测定13C 同位素丰度至关重要。三球反应管浸泡在相应温度的烧杯中,反应5 min,检测质荷比为45 的离子流强度,将反应温度为40 ℃的离子流强度设置为100%,其余反应温度的相对强度见表1,随着反应温度的增加,相对强度逐渐增加,在40 ℃时达到最大,之后下降,在20~60 ℃时,13C 同位素丰度无显著性差异,反应温度选择40 ℃。在10 ℃下酶的活性不足,生成的13CO2气体较少,13C 同位素丰度偏低。
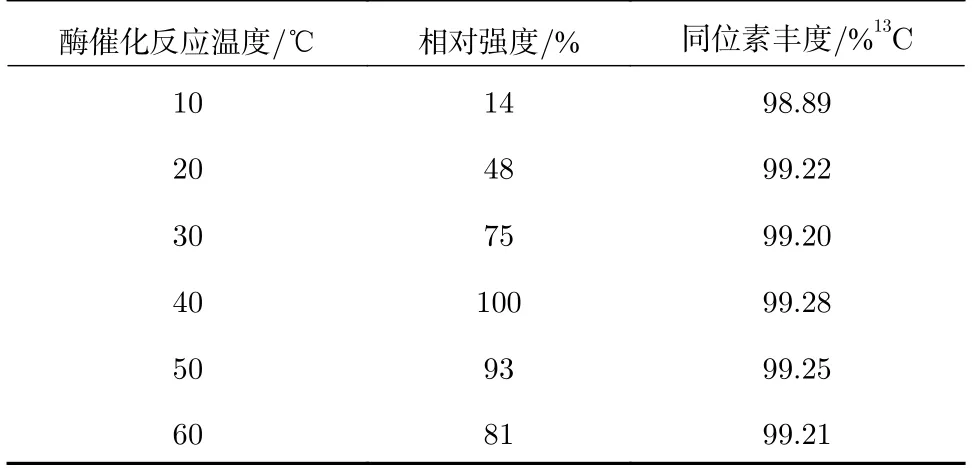
表1 不同反应温度下的13C 同位素丰度Tab.1 13C isotopic abundances at different reaction temperatures
2.2 反应时间的考察
尽管酶的催化效率比无机催化剂更高,但不如酸碱滴定反应速度快,因此选择合适的反应时间是准确测定13C 同位素丰度的关键。尿素-13C 于40 ℃下,使用过量的50 mg 脲酶能在1 h 内完全分解3~10 mg 尿素-13C,脲酶的最佳pH 为7.4,在“1.2.4 样品前处理”过程中将三球反应管“C”中的硫酸溶液倒入“B”球泡中混合,此时“B”球泡中的溶液呈酸性,脲酶失活,酶催化反应结束。反应时间是指“A”中的蒸馏水倒入“B”球泡中开始,一直到“C”中的硫酸溶液倒入“B”球泡中结束。
检测质荷比为45 的离子流强度,将反应时间为60 min 的离子流强度设置为100%,其余反应时间的相对强度见表2,反应时间为1 min 时生成的13CO2气体较少,13C 同位素丰度偏低,反应时间为60 min 时13C 同位素丰度下降,可能是由于反应时间过长,进样旋塞阀“4”与三球反应管“5”的连接处有少量空气进去。由表2 可知,酶催化反应在20 min 内完全反应,在3~5 min 反应时间下检测13C同位素丰度与完全反应时测试的结果一致,为了缩短反应时间,反应时间优选3~5 min。
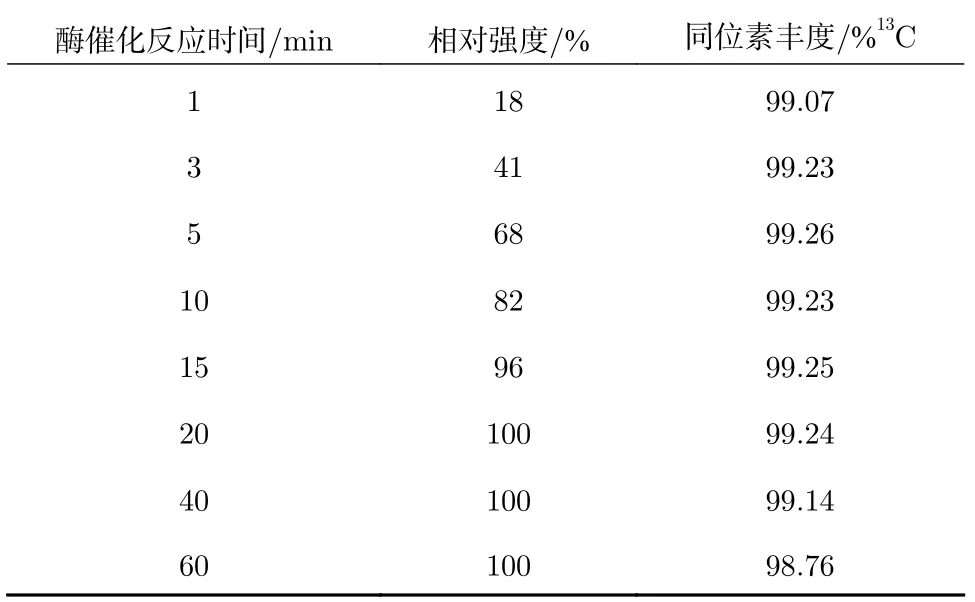
表2 不同反应时间下的13C 同位素丰度Tab.2 13C isotopic abundance at different reaction times
在无样品的空白进样实验中发现,由于玻璃连接处均涂抹高真空硅脂,在30 min 内无空气漏入,40 min 时有少量空气漏入,漏入空气的量约占实际样品气量的0.1%,空气中二氧化碳所占的比例为0.03%,二氧化碳的漏入比例非常少,可以忽略不计。尿素-13C 样品实际检测过程中整体耗时<15 min,因此玻璃连接处无需做进一步处理。如果“C”中的硫酸溶液加入过多,在抽真空的时候会有少量溅出,通过管壁流入“B”球泡中,后续的酶催化反应终止,这一现象不易察觉,仪器进样后才能发现没有气体生成,在硫酸溶液中加入少量的甲基红指示剂可以让这种“终止反应”被轻易察觉,在反应没有结束时,“B”球泡中不会有甲基红指示剂的颜色。
2.3 脲酶用量的考察
在三球反应管“A”位置分别取10、25、50、75、100 mg 的脲酶和1 mL 蒸馏水,取100 μL 30 mg/mL 尿素-13C(标示值99.4%13C)加入三球反应管“B”位置,1 mL、3 mol/L 硫酸溶液加入三球反应管“C”位置,在pH 为7.0、40 ℃温度下,反应3 min,检测质荷比为45 的离子流强度,将脲酶用量为100 mg 的离子流强度设置为100%,其余脲酶用量的相对强度见表3。数据表明,随着脲酶用量的增加相对强度逐渐增加,在10 mg 脲酶催化反应下,最终生成的13C 标记二氧化碳较少,仅为仪器进样需求的1/4,13C 同位素丰度受质谱本底影响偏低,脲酶用量超过25 mg 时,反应气量均达到仪器进样需求,同时测试结果与标示值99.4%13C 基本一致,脲酶用量的增加可以进一步缩短反应时间,因此脲酶用量优选50 mg。

表3 不同脲酶用量下的13C 同位素丰度Tab.3 13C isotopic abundance under different urease dosages
2.4 方法精密度和准确度考察
使用自然丰度尿素与USP(R081Q0)进行1:1配制成同位素丰度为50.06%13C 的试样,采用1.2.4 节中方式,对不同厂家的尿素-13C 进行同位素丰度检测,各平行测样6 次,结果见表4。RSD 均<0.1%,表明方法精密度良好。USP 3 个批次的尿素-13C 测试值平均值与标识值误差在0.05%13C 范围内,USP(I0H205)测试结果与文献[11]报道值99.0%13C 偏差为0.04%13C,TRC 的尿素-13C 测试平均值与标识值误差为0.02%13C,1:1 配制的尿素-13C 测试平均值与理论值误差为0.04%13C,表4 数据显示测定值与标样的标示值误差均在0.1%13C以内,表明方法准确度较高。

表4 精密度和准确度考察Tab.4 Precision and accuracy investigations
2.5 不同检测方法测定结果比对
同一样品分别采用酶催化法与行业标准法测定结果比对,各平行测样6 次。行业标准法的原理是尿素-13C 样品与亚硝酸钠试剂在硫酸的条件下反应生成13CO2气体,将生成的13CO2气体送入质谱仪检测系统,用质谱测定其13C 同位素丰度,结果见表5。2 种检测方法的精密度均<0.1%,表明2种方法精密度较好,且13C 同位素丰度无显著性差异。行业标准法采用亚硝酸钠与硫酸作用生成亚硝酸,利用生成的亚硝酸具有强氧化性,将尿素-13C 氧化生成13CO2,在反应过程中亚硝酸易分解生成NO2等杂质气体,而酶催化法利用脲酶的专一性,只分解尿素-13C,整个反应无杂质气体生成,因此,酶催化法相对行业标准法具有很大的优势。
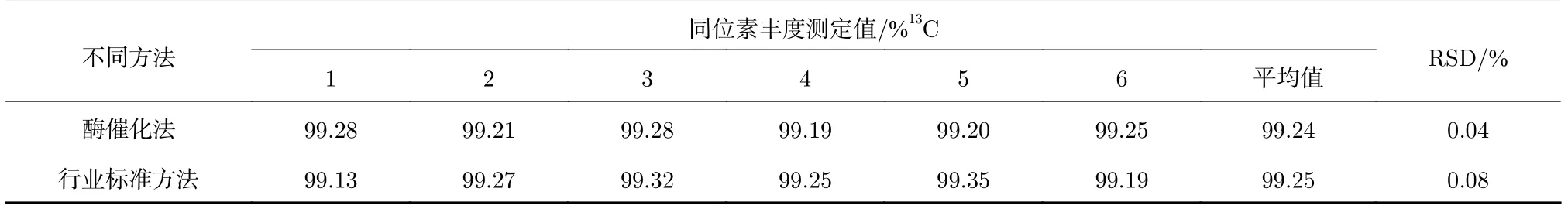
表5 酶催化法与行业标准方法测定结果比对Tab.5 Comparison of determination results between enzymatic catalysis method and line standard method
2.6 实际样品检测
酶促反应对底物有一定的选择性,所催化的反应通常也仅限于一种特定类型,生成特定的产物,这种现象称为酶的特异性。酶的特异性是指酶对催化底物的选择性。尿素、原料药尿素-13C、胶囊等均属于纯物质,尿素[13C]呼气试验诊断试剂盒是混合物,其中含有大量辅料甘露醇、阿司帕坦、枸橼酸等物质。辅料的添加对结果是否有影响,在pH 为7.0、40 ℃、反应时间为5 min 的条件下,考察了辅料甘露醇的影响。表6 中尿素-13C 化学试剂同位素丰度测试结果为99.15%13C,尿素-13C 化学试剂与甘露醇质量比为1:5 时同位素丰度测试结果为99.13%13C,两者相差-0.02%13C,表明辅料甘露醇对尿素-13C 同位素丰度的结果没有显著性影响,进一步表明方法选择性较强。对市售的尿素[13C]呼气试验诊断试剂盒中尿素-13C 同位素丰度测试结果为99.21%13C,市售产品符合现行2022 版的美国药典方法[16]中有关尿素-13C 同位素丰度大于等于99.0%13C 的要求。表5 结果表明,酶催化法对于基质样品尿素[13C]呼气试验诊断试剂盒同样适用,同时酶催化法模拟“胃”中的反应过程,不仅对尿素-13C 进行了检测,也检验了辅料中是否含有微量的碳酸盐,排除辅料带来的影响。

表6 不同来源的尿素-13C 同位素丰度测定Tab.6 Determination of urea-13C isotopic abundance from different sources
采用酶催化法对市售的不同来源的尿素、尿素[13C]呼气试验诊断试剂(胶囊和试剂盒)及原料药进行13C 同位素丰度,表6 数据表明不同来源的尿素-13C 同位素丰度存在差异,建立的酶催化法测试尿素-13C 同位素丰度的检测方法适用于化学试剂、呼气试验诊断试剂及原料药尿素-13C 中13C 同位素丰度的测定。
3 结 语
本文通过对脲酶催化反应时间、脲酶催化反应温度和脲酶用量等实验参数进行优化,确定最优条件下脲酶催化反应时间为3~5 min,脲酶催化反应温度为40 ℃,脲酶用量为50 mg,开发了基于酶催化反应测定尿素-13C 同位素丰度的检测方法。测试结果表明:建立的检测方法精密度和准确度良好,能够满足不同类型的尿素-13C 同位素丰度检测的需求;建立的酶催化法既可以模拟“胃”中的反应过程、又具有快速的、专一性强、无杂质气体生成等优势,适用于化学试剂、呼气试验诊断试剂及原料药等不同类型的尿素-13C 同位素丰度的质量控制,同时可以用于检验尿素[13C]呼气试验诊断试剂盒中辅料对尿素-13C 同位素丰度是否存在干扰,为药品质量监管提供技术支持。
