TBI 大鼠Claudin-5 紧密连接蛋白表达变化及CBD 干预研究
2023-12-21康丽曹艳李恒希李佳丽凌腾晗尹爱平张瑞林李坪
康丽,曹艳,李恒希,李佳丽,凌腾晗,尹爱平,张瑞林,李坪*
1.河南护理职业学院人体解剖与组织胚胎学教研室,河南 安阳 455000; 2.昆明医科大学人体解剖学与组织胚胎学系,昆明 650500; 3.昆明医科大学法医学院毒物化学系,昆明 650500
创伤性脑损伤(traumatic brain injury,TBI)为神经外科常见疾病,其致残率、致死率居创伤首位[1]。TBI 发生后,机械性损伤导致神经元、轴突、胶质细胞和血管等结构剪切、撕裂和组织变形,尤其是血脑屏障(blood brain barrier,BBB)的连续性和通透性受损,包裹于微血管周围的星形胶质细胞(astrocyte,AST)足板肿胀和小血管内皮细胞间的紧密连接破坏。TBI 会引起AST 和紧密连接蛋白Claudin-5 受损[2],而大麻二酚(cannabidiol,CBD)作为大麻的天然提取物,具有镇痛、抗炎和抗肿瘤等作用,且不具神经毒性,其安全性和耐受性良好[3~6],对蛛网膜下腔出血造成的脑损伤早期有改善作用[7]。本实验观察TBI 后紧密连接蛋白Claudin-5 的表达变化和CBD 干预对脑损伤的改善作用,探究参与构成血脑屏障的AST 和Claudin-5 蛋白表达之间的关系,为临床救治TBI 患者提供新的依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 选用体重(280±20)g 的健康成年雄性SD 大鼠(昆明医科大学实验动物中心提供),在标准照明(12 h 光照/黑暗)和标准环境(温度20~25 ℃,湿度55%~65%)适应性喂养1 周,自由进食和饮水,术前8 h 禁食不禁水。实验符合动物学伦理,实验期间尽可能减轻动物痛苦。
1.1.2 主要试剂 CBD(云南汉素生物公司);兔抗Claudin-5 多克隆抗体(美国Affinity 公司);Cy3 goatanti rabbit IgG(美 国Sigma 公 司);488-conjugated GFAP monoclonal antibody(中国Proteintech 公司);总RNA 提取试剂盒(日本Takara 公司);荧光定量试剂盒(日本Takara 公司);逆转录试剂盒(日本Takara 公司);即用型免疫组化超敏试剂盒(福州迈新生物公司);DAB 显色液(福州迈新生物公司);山羊血清(北京Biotopped 公司);抗荧光衰减封片剂(大连美仑生物公司)。
1.1.3 主要实验仪器 自由落体脑损伤打击装置(深圳瑞沃德公司);-80 ℃冰箱(美国Thermo Fisher 公司);LED 数显圆周摇床(美国scilogex 公司);石蜡切片机(德国Laica 公司);光学显微镜(德国Laica 公司);荧光倒置显微镜(德国ZEISS 公司);荧光定量PCR 仪(美国ABI 公司)。
1.2 实验方法
1.2.1 模型制备及神经功能缺损鉴定 参照改良的Feeney 自由落体方式制备TBI 大鼠模型。大鼠腹腔注射2%戊巴比妥钠(2 mL/kg)进行麻醉,额顶部剃毛并俯卧位固定于脑立体定位仪上,常规消毒后矢状位切开头皮,暴露右侧颅骨,用牙科钻钻出一个直径6 mm 的窗孔(矢状缝右侧2.5 mm,冠状缝下方2 mm),将40 g 砝码从15 cm 高度自由落下打击骨窗暴露的硬脑膜,随后止血、缝合、腹腔注射生理盐水补液等处理[8]。假手术组仅做开骨窗,不进行打击,其余实验过程相同。术后动物接受监护,直到恢复自主呼吸。依据改良神经功能缺损评分(modified neurological severity score,mNSS),从运动、行走、感觉、平衡木、反射5 个方面对大鼠的神经损伤评分,评分越高代表神经功能损伤越严重。测试显示大鼠TBI 模型制备成功[9]。
1.2.2 分组及给药 将符合条件的108 只大鼠随机分为形态学实验(n=54)和RT-PCR 实验(n=54),各分为3 组(Sham 组、TBI+vehicle 组和TBI+CBD 组),按8 h、1d、2 d、3 d、5 d 和7 d(n=3)6 个时间点断头取脑。其中TBI+CBD 组于造模前30 min 以及造模后6 h 腹腔注射CBD 混悬液(10 mg/kg),之后每天注射1 次直至取材,Sham 组和TBI+vehicle 组注射等量2%Tween-80 生理盐水(1 mL/kg)。
1.2.3 免疫组化染色 大鼠灌注取脑并用4%多聚甲醛固定,乙醇梯度脱水,二甲苯透明,石蜡浸透包埋。脑组织切片厚5 μm。严格按照试剂说明书采用免疫组化SP 方法,步骤如下:切片常规脱蜡、抗原热修复;用0.01 M 的PBS-0.1% triton 缓 冲 液 冲 洗3 min×3 次,滴加内源性过氧化物酶阻断剂,室温孵育10 min;滴加正常非免疫性羊血清,室温孵育10 min;滴加一抗(兔抗Claudin-5 多克隆抗体,1:100)孵育,4 ℃过夜;室温复温20 min;PBS-0.1% triton 缓冲液冲洗3 min×5次;滴加生物标记的第二抗体,37 ℃孵育15 min;PBS-0.1% triton 缓冲液冲洗3 min×3 次;滴加链霉菌抗生物素蛋白-过氧化物酶溶液,室温孵育15 min;PBS-0.1% triton 缓冲液冲洗3 min×3 次;DAB 试剂显色;双蒸水冲洗3 min×3 次终止DAB 显色;梯度酒精脱水、二甲苯透明、中性树脂封片。将大鼠损伤侧/开骨窗侧皮质区作为采图和分析部位,随机选取5 个高倍视野(×400)拍片,光学显微镜下观察Claudin-5 的形态学特征,用Image J 软件对每张照片的平均光密度进行分析。
1.2.4 免疫荧光双标染色 取待测组织石蜡切片,脱蜡以及抗原修复,PBS 清洗3 min×3 次;5%山羊血清封闭30 min;加兔抗Claudin-5 多克隆抗体(1:100),4 ℃冰箱过夜;室温平衡30 min,PBS 清洗5 min×3次;加Cy3 标记羊抗兔IgG(1:200),室温孵育1 h,PBS 清 洗5 min×3 次;再 加488-conjugated GFAP 多 克隆抗体(1:200),室温孵育2 h,PBS 清洗5 min×3 次;抗荧光衰减封片剂封片。于倒置显微镜(×400)下观察染色情况,随机选取组织结构及背景清晰的5 个视野拍片,Image J 图像分析系统测量每张图片中阳性表达的平均荧光强度。
1.2.5 实时荧光定量PCR 大鼠断头取脑,分离损伤侧皮质区新鲜脑组织,用Trizol 法提取总RNA,根据说明书规范操作,用紫外线分光光度计检测RNA 样品浓度及A260 和A280 比值,每组取1 μg 总RNA 进行反转录反应生成cDNA 作为模板,Claudin-5 上游引物:CTTGGAAGGGGCTGTGGAT,下游引物:GCCAGCACAGACTCATACAC;GAPDH 上 游 引 物:ACGGCAAGTTCAACGGCACAG,下 游 引 物 :GACGCCAGTAGACTCCACGACA。利 用 SYBR Green 试剂盒进行实时定量PCR 扩增,反应条件为:预变性95 ℃、30 s,变性95 ℃、5 s,退火60 ℃、30 s,进行40 次循环。独立实验重复3 次。采用实时荧光定量PCR 仪器进行Claudin-5 mRNA 定量分析。
1.3 统计学分析
使用SPSS 25.0 软件对数据进行统计学分析,数据以平均值±标准差()表示,组间比较采用单因素方差分析,组内比较采用Student'st检验,P<0.05时,认为差异具有统计学意义。
2 结果
2.1 RT-PCR 检测CBD 干预对TBI 不同时间Claudin-5 mRNA 表达影响
与Sham 组相比,TBI 大鼠损伤侧皮质Claudin-5 mRNA 表达减弱(8 h~5 d),其中2 d 组的表达最低,CBD 干预后1~5 d,Claudin-5 mRNA 表达明显升高,差 异 均 有 统 计 学 意 义(P<0.05)。7 d 组Claudin-5 mRNA 表达均无统计学差异(P>0.05),见图1。
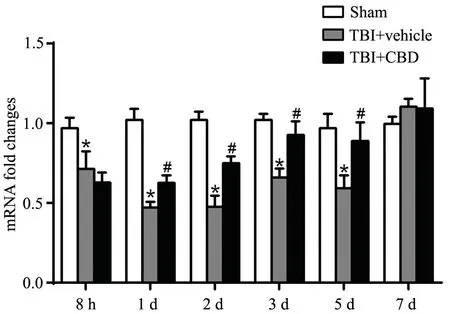
图1 实时荧光定量PCR 检测Claudin-5 mRNA 表达*P<0.05,与Sham 组比较 # P<0.05,与TBI+vehicle 组比较Fig.1 Expression of claudin-5 mRNA detected by realtime PCR* P<0.05, vs Sham group; # P<0.05, vs TBI + vehicle group
2.2 免疫组化检测CBD 干预对TBI 不同时间Claudin-5 阳性表达影响
Sham 组阳性细胞内皮较为连续、完整,阳性表达较强,TBI 后不同时间点Claudin-5 线条发生断裂,阳性表达的平均光密度值从8h 起逐渐下降,2d 组阳性表达降至最低值,Claudin-5 线条呈点状分布,随后有所回升,但至7d 组阳性表达仍低于Sham 组。CBD 干预后,2 d,3 d,5 d 和7 d 组Claudin-5 阳性表达的形态有所恢复,呈现较为连续、完整的细胞结构,阳性显色程度显著高于TBI 组(P<0.05)。见图2。

图2 免疫组化检测Claudin-5 蛋白表达A:免疫组化染色(Bar=25 μm)箭头示Claudin-5 阳性 B:Image J 分析Claudin-5 光密度 * P<0.05,与Sham 组比较 # P<0.05,与TBI+vehicle 组比较Fig.2 Protein expression of Claudin-5 detected by immunohistochemistry A: Immunohistochemical staining (Bar=25 μm), arrows indicated positive expression of Claudin-5; B: Image J software analysis of Claudin-5 optical density values * P<0.05, vs Sham group; # P<0.05, vs TBI + vehicle group
2.3 免疫荧光双标检测CBD 干预对TBI 不同时间Claudin-5 和胶质纤维酸性蛋白阳性表达影响
由于RT-PCR 及免疫组化结果均显示TBI 后2 d组AST 激活最明显,Claudin-5 阳性表达下降最明显,因此选择TBI 后2 d 组做免疫荧光染色,从脑微血管区及非微血管区均可看到:与Sham 组相比,TBI 后胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)阳性表达增强,即AST 处于激活状态,主要表现为胞体变大、突起增多和变粗,贴附在脑血管内皮表面的足板肿胀,且出现断裂、点状不连续分布。而Claudin-5 阳性表达显著减低。CBD 干预后,GFAP 阳性表达减弱,即AST 的激活状态减弱,而Claudin-5 的荧光表达强度有所恢复(图3)。这进一步说明:CBD 干预能够抑制TBI 损伤引起的AST 激活,提高Claudin-5 表达。
3 讨论
国内外研究证实各种类型的脑损伤可导致BBB功能障碍[1,10],而BBB 受损通常与微血管内皮紧密连接破坏有关。紧密连接是位于BBB 脑微血管内皮细胞(brain microvascular endothelial cells,BMECs)最顶部的蛋白分子复合体,Claudin-5 是紧密连接蛋白的主要成分。多项研究表明,Claudin-5 主要表达于微血管内皮细胞,其阳性表达在不同的脑损伤模型中呈现不同程度的下降[10~12]。本实验参照改良的Feeney 自由落体方式制备TBI 大鼠模型[8],通过免疫组织化学染色对Claudin-5 的平均光密度进行测量,结果显示对照组Claudin-5 呈强阳性表达,并沿血管内皮连续分布,TBI 后各时间点的Claudin-5 表达显著降低,2 d 达最低,免疫荧光染色和RT-PCR 结果与免疫组织化学结果类似。此外,在脑非血管部位同样发现Claudin-5表达下调。因此推测TBI 所致的Claudin-5 表达持续降低导致BBB 的完整性破坏,且Claudin-5 可能引起BBB 以外的大脑组织结构改变。
与Claudin-5 类似,紧密贴附于BMECs 表面的AST 对于维持BBB 结构完整和功能正常至关重要。AST 和紧密连接蛋白Claudin-5 作为血脑屏障的主要结构,两者的相互关系备受关注。文献报道Claudin-5和贴附于微血管内皮细胞表面的AST 在不同的脑损伤类型中表现有时间依赖性[12~16]。前期课题组发现TBI 后AST 表现为激活状态,胞体变大、突起增多和变粗[17]。本实验分别从脑血管区和非血管区免疫荧光双标图片发现TBI 后GFAP 阳性表达增强,说明AST 被激活,同时发现Claudin-5 表达降低。由此推测TBI 导致AST 激活,进而参与调节Claudin-5 蛋白表达。基于上述实验研究,寻找一种适合的化合物,能有效干预AST 激活及增强Claudin-5 表达,进而改善TBI 损伤显得尤为重要。
CBD 是大麻提取物中含量第二丰富的无精神活性成分的物质,其作用有别于四氢大麻酚(THC)。国内外研究CBD 与脑缺血疾病较为密集,有关CBD 与创伤性脑损伤方面的文献较少。有研究发现口服CBD 可以改善TBI 所致的慢性疼痛、抑郁等神经功能障碍[18];对于体外BMECs 和AST 共培养制备缺血性脑损伤模型研究发现:缺血再灌注前给予CBD 是最有效的,缺血再灌注后2 h 仍可观察到保护作用,提示缺血性脑损伤后CBD 影响BBB 通透性从而发挥神经保护功能[17,19]。那么CBD 干预能否改善TBI 大鼠的神经功能障碍?本课题组前期研究发现TBI 后Claudin-5 阳性表达的平均荧光强度明显减弱,而CBD 干预后Claudin-5 表达明显升高[2],但未能揭示干预后表达时序性变化,所以本实验主要研究CBD 干预后8 h、1 d、2 d、3 d、5 d 和7 d 6 个时间点AST 的激活程度和Claudin-5 的阳性表达变化规律,结果显示TBI 后AST 的突起足板与血管内皮细胞之间有直接接触,Claudin-5 阳性表达下降,线条状发生断裂,多呈点状分布。CBD 干预后AST 激活状态下降,Claudin-5 阳性表达逐渐增强,线条状有所恢复,干预后2 d 表现最为明显。由此推断CBD 能降低TBI 引起的AST激活及增加Claudin-5 表达,从而改善BBB 结构的完整性。
综上所述,颅脑损伤后通过CBD 干预可抑制AST 激活,提高Claudin-5 表达水平,从而改善脑损伤后BBB 通透性,CBD 对改善脑损伤的神经保护作用有待临床进一步验证。