CaMKIV 信号缺失促进肌损伤炎症并影响肌再生
2023-12-21王涵厉洋洋菅晓婷黄静雯蓝海强胡稷杰廖华
王涵,厉洋洋,菅晓婷,黄静雯,蓝海强,胡稷杰*,廖华*
1.广东省组织构建与检测重点实验室,南方医科大学基础医学院解剖教研室,广州 510515;2.南方医科大学南方医院创伤骨科,广州 510515
肌损伤是日常生活中比较常见的一种疾患,是运动医学比较常见的损伤之一。肌损伤通常由肌纤维破坏、溃变、坏死开始,然后肌肉被炎症细胞快速和持续浸润。炎症细胞可吞噬或降解可能由肌损伤产生的细胞碎片[1],还可以释放多种细胞因子,促进肌肉再生修复。此外,在肌损伤时期钙调蛋白依赖性蛋白激酶4(CaMKIV)表达上调[2]。CaMKIV 是一种多功能蛋白激酶。活化的CaMKIV 能与钙/钙调蛋白(Ca2+/Calmodulin)结合,是关键的Ca2+下游信号分子之一[3-5]。CAMKIV 是调节外周免疫和炎症的关键分子,参与淋巴细胞激活、增殖和终末分化,例如,CaMKIV 参与调控小鼠胸腺的胚胎发生[6],以及成年动物胸腺细胞亚群成熟[7,8];干预cAMP 反应元件调制器α(CREM-α)对IL-2 的合成抑制,下调调节性T 细胞(Tregs)细胞功能,激活效应T 细胞,导致器官损伤[9, 10]。
CaMKIV 能干预骨骼肌细胞内Ca2+依赖性的肌基因表达,尤其是线粒体发生和氧化酶活性,参与肌再生、重塑并决定肌纤维异质性[11,12]。肌损伤可触发局部炎症及多种炎性细胞浸润,这有助于损伤肌再生[13-15]。我们尝试构建CaMKIV-/-小鼠,并采用CTX 诱发骨骼肌损伤,分析CaMKIV 信号对对损伤肌内炎症反应及肌修复的影响,为降低肌损伤炎症、促进骨骼肌有效再生及新药开发提供依据。
1 材料与方法
1.1 CaMKIV-/-小鼠的构建及检测
采用CRISPR/Cas9 技术,利用非同源重组修复引入突变的方式,造成CaMKIV 基因蛋白读码框移码,功能缺失。简要过程如下:通过体外转录方式,获得Cas9 mRNA 和gRNA(图1A);将Cas9 mRNA 和gRNA 显微注射入C57BL/6J 小鼠(上海南方模式生物科技股份有限公司)受精卵中,获得F0 代小鼠。PCR扩增及测序鉴定(生工生物工程(上海)有限公司,试剂)阳性的F0 代小鼠与C57BL/6J 小鼠交配获得阳性F1 代小鼠(图1B)。
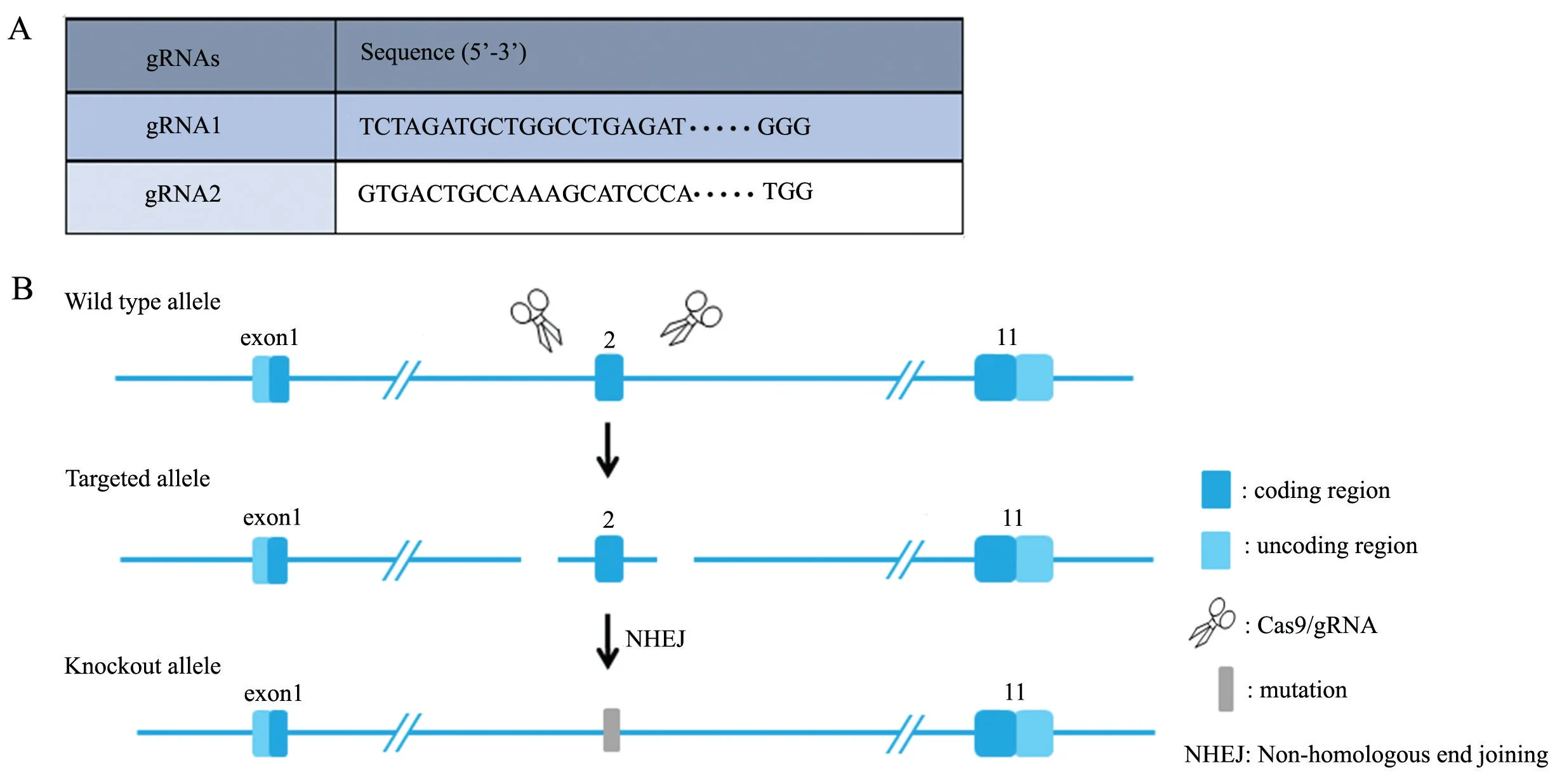
图1 CaMKIV-/-小鼠构建A: gRNAs 序列 B: 构建策略示意: 使用CRISPR/Cas9 技术,利用非同源重组修复引入突变的方式,造成Camk4 基因蛋白读码框移码,功能缺失Fig.1 The cconstruction of CaMKIV-/- mice A: gRNAs sequence; B: Construction strategy: CRISPR/Cas9 technique was used to cause aberration of Camk4 gene reading frame and loss of function
将获得的基因敲除杂合子小鼠(CaMKIV+/-)分成两部分:一部分杂合子小鼠与野生型小鼠交配,扩群繁育较多的杂合子小鼠;一部分杂合子小鼠自交,获得基因敲除纯合子小鼠(CaMKIV-/-),进行基因敲除效果验证和后续的表型分析。
1.2 肌损伤实验
C57BL/6 (B6)对照鼠(购于南方医科大学动物实验中心),以及CaMKIV-/-小鼠常规饲养(12 h/12 h 光照/黑夜,饮食、饮水充足自由)。动物实验遵守南方医科大学动物伦理委员会规定实施。选择4~8 周龄小鼠,采用CTX 诱导骨骼肌损伤:小鼠腓肠肌注射30 μL CTX (100 μg/mL; Sigma),分别于注射后第3、5、7天处死小鼠,收集肌组织标本快速冷冻用于基因和蛋白分析等。
1.3 组化及免疫荧光染色
肌组织样本冰冻切片,厚度8μm,HE 或免疫荧光染色:丙酮固定,添加一抗,4 ℃孵育过夜。PBS 冲洗,二抗室温孵育1h。PBS 冲洗,DAPI 核染。所用的一抗包括:大鼠抗小鼠Dystrophy(1:400,Abcam)、大鼠抗小鼠F4/80(1:200,ebioscience)。二抗则采用:Alexa Fluor 488 偶 联 的 羊 抗 兔IgG(1:400,Santa Cruz)、Cy3 偶联的羊抗鼠IgG(1:400,Santa Cruz)、Cy3偶联的羊抗兔IgG(1:400,Santa Cruz)或Alexa Fluor 488 偶联的羊抗鼠IgG(1:400,Santa Cruz)。奥林巴斯BX51 荧光显微镜(Olympus, 日本)下观察并分析。
1.4 流式检测
37 °C、0.2%Ⅱ胶原酶(Merck)消化剪碎的肌组织或培养细胞。离心收集细胞,重悬于荧光激活细胞分选缓冲液(磷酸盐缓冲液,广州鼎国生物技术有限公司)获得单细胞悬液。添加荧光抗体(anti-F4/80-PE,anti-Ly-6C-FITC, anti-CD206-FITC, anti-Ki67-BV421)。流式检测(多维高清流式细胞分析仪,BD LSRFortessa X-20),FlowJo 软件分析。
1.5 统计学分析
2 结果
2.1 CaMKⅣ-/-小鼠的构建及检测
将注射后的受精卵移植到假孕母鼠中获取F0 代嵌合体小鼠。采用PCR 扩增及测序对其进行基因型鉴定(图2A)。将阳性F0 代小鼠与野生型C57BL/6J小鼠交配,获得F1 代杂合小鼠(CaMKIV+/-)(图2B)。进一步自交CaMKIV+/-小鼠,获得基因敲除纯合子小鼠(CaMKIV-/-)。CaMKIV-/-小鼠基因的验证和表型分析见图3。

图2 F0 及F1 代小鼠的鉴定结果A: F0 代小鼠序列突变情况 B: F1 代小鼠与野生小鼠的测序结果比对(Query 为野生型基因组序列,Subject 为实际测序结果)Fig.2 The identification result of F0 and F1 mice A: Sequence mutation of F0 generation mice; B: Comparison of sequencing results between F1 generation mice and wild mice (Query was wild-type genome sequence, Subject was actual sequencing results)
2.2 CaMKⅣ信号参与调节小鼠损伤肌内炎症反应
HE 染色显示,野生(WT)小鼠胫骨前肌CTX 损伤后3 d 可见大量肌纤维坏死,细胞溶解、溃变,伴明显的炎性细胞渗出。随损伤时间延长,炎症撤退,炎性浸润减少,受损肌纤维逐渐被大量再生的中央核肌纤维所代替(图4)。较之WT 鼠,CaMKⅣ-/-小鼠损伤肌内炎性渗出加剧,炎症持续时间延长(图4)。免疫染色则证实,CaMKⅣ-/-小鼠损伤肌内的单核/巨噬细胞(F4/80+)数量较WT 鼠显著增多,再生的中央核肌纤维(Dystrophin+)数量却显著低于WT 鼠(图5)。我们的结果提示,小鼠体内CaMKⅣ信号缺失可致肌内炎症程度加剧、炎症反应延长、肌修复延迟。

图4 HE 染色显示CTX 损伤肌组织炎症及再生A、B 分别为WT 小鼠与CaMKIV-/-小鼠肌组织损伤3 d 后,HE 染色显示肌内组织炎症浸润,C、D 分别为WT 小鼠和CaMKIV-/-小鼠肌组织损伤7 d后,HE 染色显示肌细胞再生Fig.4 HE staining showed inflammation and regeneration of CTX injured muscle tissue A and B showed intramuscular tissue inflammation 3 days after muscle tissue injury in WT mice and CaMKIV-/-mice; C and D showed intramuscular tissue regeneration 3 days after muscle tissue injury in WT mice and CaMKIV-/- mice
2.5 CaMKⅣ信号缺失影响损伤肌内巨噬细胞表型
流式检测发现,CTX 注射可诱导WT 鼠损伤肌内促炎的M1 型巨噬细胞(F4/80+Ly6C+)于坏死期(D3)聚集,随肌再生进行(D5)逐渐下降。我们发现,同一损伤时间,CaMKⅣ-/-小鼠损伤肌内M1 细胞数量远高于WT 鼠(图6A)。随损伤时间延长和肌修复启动,WT 鼠损伤肌内促缓解的M2 细胞(F4/80+CD206+)数量逐渐增加,CaMKⅣ-/-鼠损伤肌内M2 细胞比例却始终低于WT 鼠(图6B)。这提示,CaMKⅣ信号参与调控损伤骨骼肌内M1 巨噬细胞向M2 表型的转变。M2 巨噬细胞可通过释放IL-10 等抑炎因子促进肌再生[14],我们因此推测损伤肌内M2 细胞缺失是CaMKⅣ-/-小鼠肌修复延迟的可能原因。
2.6 CaMKⅣ信号缺失影响肌损伤局部巨噬细胞增殖
前述研究提示,CaMKⅣ-/-小鼠损伤肌内M1 细胞滞留、M2 细胞稀少是炎症持续、肌修复延迟的可能原因。2 种巨噬细胞比例差异是否源于其局部增殖能力改变呢?采用FACS 分析,我们发现,CaMKⅣ-/-小鼠损伤肌内增殖巨噬细胞(F4/80+Ki67+)数量显著高于对照鼠(图7A),但CaMKⅣ-/-鼠损伤肌内增殖巨噬细胞以M1 型细胞为主(F4/80+Ly6C+Ki67+)(图7B),M2 细胞的增殖(F4/80+CD206+Ki67+)与对照鼠无显著差异(图7C)。上述结果提示,CaMKⅣ信号缺失促进损伤肌内巨噬细胞、尤其是促炎的M1 细胞增殖,从而导致肌内炎症加剧。
3 讨论
肌损伤将触发局部炎症及多种炎性细胞浸润,这有助于损伤肌再生[13,16]。以往研究表明,CTX 急性肌损伤-炎症-再生过程中,CaMKIV 水平于坏死溃变期(3d)快速上调, 随着肌再生进行,CaMKIV 水平及活性逐渐下调,表明肌损伤导致CaMKIV 信号激活[17]。为明确CaMKIV 信号如何影响肌内炎症,我们构建了CaMKIV-/-鼠,采用CTX 注射制备野生鼠及CaMKIV-/-小鼠急性肌损伤模型。我们发现,CaMKIV 基因缺失将导致肌损伤后炎症反应加重,损伤肌组织内单核/巨噬细胞细胞募集增加(CD11b+和F4/80+细胞数量显著上调)、肌内促炎的M1 巨噬细胞(CD45+/Ly-6C+F4/80+细胞)比例明显增高,提示CaMKIV 信号参与调控损伤肌内巨噬细胞的表型及功能。
骨骼肌损伤后,肌内聚集的巨噬细胞主要源自渗出的血单核细胞。但有研究指出[18],血单核细胞删除小鼠的损伤肌内仍存在巨噬细胞聚集(较对照鼠,巨噬细胞数量降低57%), 损伤肌内炎性微环境可诱导渗出的,或定居的M1 及M2 细胞增殖。我们的研究证实,CaMKIV 基因缺失条件下,损伤肌内M1 巨噬细胞数量显著上调,M2 细胞比例低于对照鼠。进一步的细胞增殖分析表明,CaMKIV 基因缺失小鼠损伤肌内增殖的M1 细胞比例显著高于对照鼠。我们的结果表明,CaMKIV 信号可抑制M1 细胞的渗出和局部增殖,是肌损伤后的促修复因素。
CaMKIV 为免疫反应的组成部分,介导Ca2+依赖性巨噬细胞功能,参与败血症等炎症反应的调节。LPS 诱导条件下,CaMKIV 过表达可促进巨噬细胞的M1 极化,上调IL-6/IL-1 转录活性、增加促炎分子释放。反之,缺乏CaMKIV 基因的巨噬细胞M1 极化能力减弱[19]。CaMKIV 能干预骨骼肌内Ca2+依赖性的肌基因表达,尤其是线粒体发生和氧化酶活性,参与肌再生、重塑并决定肌纤维异质性。我们以往的研究证明,炎性环境中肌纤维上调CaMKIV 蛋白表达,CaMKIV 基因敲除导致体外分化肌纤维下调MHC-I/II、TLR3 及部分促炎的肌因子水平[20]。我们推测,本研究观察的CaMKIV 全敲小鼠所呈现的肌损伤炎症加剧、肌修复延迟可能源于:i)CaMKIV 基因缺失影响肌纤维释放特定肌因子,间接调控巨噬细胞功能;ii)CaMKIV 基因缺失影响巨噬细胞功能及极化。接下来,我们将深入分析损伤肌内再生肌纤维,或免疫细胞CaMKIV 基因缺失对肌内炎症和肌修复的影响。