中心性浆液性脉络膜视网膜病变中扁平不规则色素上皮脱离的短波长和近红外眼底自发荧光图像特征
2023-12-21杨纯周挺业林冰
杨纯,周挺业,林冰
温州医科大学附属眼视光医院 眼底内科,浙江 温州 325000
中心性浆液性脉络膜视网膜病变(central serous chorioretinopathy, CSCR)是一种常见的脉络膜视网膜疾病,其特征是特发性的浆液性视网膜脱离(serous retinal detachment, SRD),常伴视网膜色素上皮脱离(pigment epithelium detachment,PED),导致中心视力下降[1]。该病病因尚不明确,可能与脉络膜通透性增高、静水压升高以及视网膜色素上皮(retinal pigment epithelium, RPE)外屏障功能受损有关[1]。CSCR的临床分型和PED类型存在差异,其中扁平不规则PED(flat irregular pigment epithelial detachment, FIPED)常见于慢性CSCR,并与脉络膜新生血管(choroidal neovascularization, CNV)密切相关[2]。然而,当CSCR与CNV共存时,传统的染料眼底血管造影的影像学特征重叠[2],从而对疾病的准确诊断带来挑战。因此,多模影像技术,尤其是光学相干断层扫描血管成像(optical coherence tomography angiography, OCTA),被广泛应用于提高CNV的检出率[2]。眼底自发荧光(fundus autofluorescence,FAF)作为一种多模影像技术,可无创检测和评估RPE的功能状态,对CSCR的诊断和预后评估有重要意义[3-4]。然而,在伴有FIPED的CSCR中,对FAF的研究报道有限。本研究旨在利用多模影像技术观察CSCR眼中FIPED的FAF特征,区分非血管化和血管化FIPED,以指导相关治疗和随访。
1 对象和方法
1.1 对象 收集2020年3月至2021年3月于温州医科大学附属眼视光医院眼底内科确诊伴有FIPED的慢性或复发性CSCR患者,其临床表现为长期或反复的视力下降,视物变暗、变形、变小等。共入组患者38例38眼,其中男30例30眼,女8例8眼;年龄36~66(48.79±6.49)岁。15眼有多次复发史,最近一次发病距就诊时间0.5~24.0个月;23眼为初次发病,病程4.0~120.0个月;38眼的CSCR病程0.5~120.0个月,中位病程6.0个月。纳入标准:①患眼的临床表现、眼底检查、荧光素眼底血管造影(fundus fluorescein angiography, FFA)、吲哚菁绿血管造影(indocyanine green angiography, ICGA)以及OCT结果均符合CSCR的临床诊断[1];②病程>4个月或既往有1次以上CSCR病史再次复发者;③OCT检查除可见黄斑区视网膜下积液(subretinal fluid, SRF)以及中心凹下脉络膜厚度(subfoveal choroidal thickness, SFCT)增厚外,局部还存在呈现中等反射的FIPED,且FIPED位于SRF范围之内。排除标准:①既往有球内注药史、眼部手术史或眼部外伤史;②合并或存在年龄相关性黄斑变性、糖尿病视网膜病变、视网膜静脉阻塞、高度近视、青光眼、葡萄膜炎、黄斑前膜等其他眼病;③影响眼底成像清晰度的屈光间质混浊;④存在散瞳禁忌证或者眼底血管造影检查禁忌证;⑤视力差难以固视者;⑥相关病历资料不全。本研究经温州医科大学附属眼视光医院伦理委员会审批(批准号:2022-137-K-160)。
1.2 方法 患眼均接受最佳矫正视力(bestcorrected visual acuity, BCVA)、眼压、裂隙灯显微镜联合90 D前置镜、频域光学相干断层扫描(spectral-domain optical coherence tomography,SD-OCT)、OCTA、短波长眼底自发荧光(shortwavelength autofluorescence, SW-FAF)和近红外眼底自发荧光(near-infrared autofluorescence,NIR-FAF)、FFA以及ICGA等检查。BCVA采用国际标准视力表进行,统计时换算为最小分辨角对数视力。采用德国Heidelberg公司Spectralis HRA+OCT仪行SW-FAF、NIR-FAF、FFA、ICGA以及SD-OCT、OCTA检查。每项检查均由同一名医师使用同一台设备完成。常规皮试、散瞳后,患者双眼先分别进行激发光波长为488 nm的SW-FAF扫描以及激发光波长为787 nm的NIR-FAF扫描,调节敏感度旋钮,均连续采集3~5张图像,使用Herdelberg Eye Explore软件处理,得到SW-FAF及NIR-FAF影像。随后将吲哚菁绿25 mg溶于5 mL注射用水,与20%荧光素钠3 mL混合,在6 s内将溶液从患者肘前静脉快速注入,对眼底行同步FFA和ICGA拍摄,FFA早期和晚期分别观察荧光素渗漏点的情况及变化,ICGA中期到晚期观察脉络膜血管扩张、血管通透性增加以及高荧光斑块,获取FFA和ICGA影像。SD-OCT检查采用EDI(enhanced depth imaging, EDI)技术,扫描深度2~3 mm,扫描部位以黄斑中心凹为中心进行30°×30°范围的水平和垂直扫描,以及20°×20°范围的25次水平B扫描,选择质量与位置较佳的图像进行标记保存。OCTA检查以黄斑中心凹为中心,根据FIPED的具体位置和面积大小,选择3 mm×3 mm或者6 mm×6 mm的扫描范围,采集速度为85 000次A扫描/s,在扫描过程中采用Eye-Tracking动眼追踪技术,选择质量与位置较佳的图像进行标记保存,通过手动调整分层,结合B扫描图像、En-face图像,确定FIPED处是否存在血流信号。
1.3 统计学处理方法 采用SPSS22.0软件行统计学分析。计量资料以表示,计数资料用频数和百分数表示。两组计量资料比较用独立样本t检验,两组计数资料比较用χ2检验。P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者一般资料比较 共有38眼慢性或复发性CSCR存在FIPED,其中18眼存在非血管化FIPED(非血管化FIPED组),即未发现CNV;另外20眼存在血管化FIPED(血管化FIPED组),均为1型CNV。两组患者年龄比较,差异存在统计学意义(P<0.001);但平均logMAR BCVA、性别、慢性和复发性CSCR占比的比较,差异均无统计学意义(P>0.05),见表1。
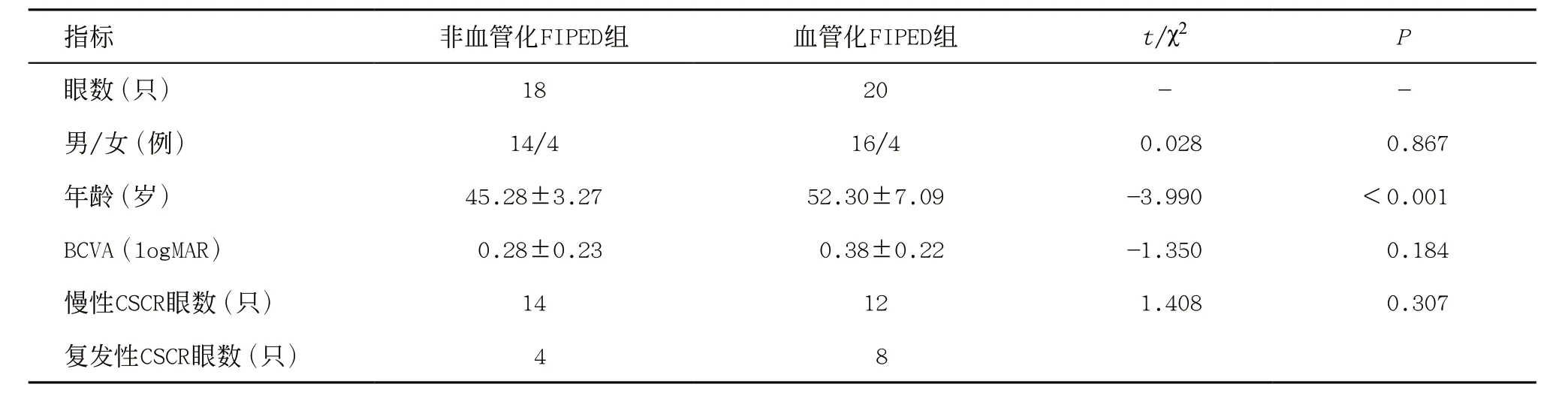
表1 两组患者的基本信息
2.2 FIPED的FAF分类 对38眼的FIPED的两种FAF图像进行观察,均发现存在异常,占100%。按异常自发荧光(autofluorescence, AF)的强弱分类,包括AF增强、AF减弱以及强弱混合形式。按异常AF的形态进行分类,分为:点状、斑片状、混合状(指点状和斑片状均存在的AF)、融合状(指大量斑片状AF聚集融合)。
2.3 非血管化FIPED的FAF表现 非血管化FIPED在SW-FAF上以点状强弱混合AF更常见,有10眼,占55.6%,见图1A-C;其次是点状弱AF 7眼,占38.9%;混合状弱AF 仅1 眼,占5.6%。非血管化FIPED在NIR-FAF上的表现则以斑片状强弱混合AF为主,15 眼,占83.3%,见图1D;斑片状弱AF仅3 眼,占16.7%。
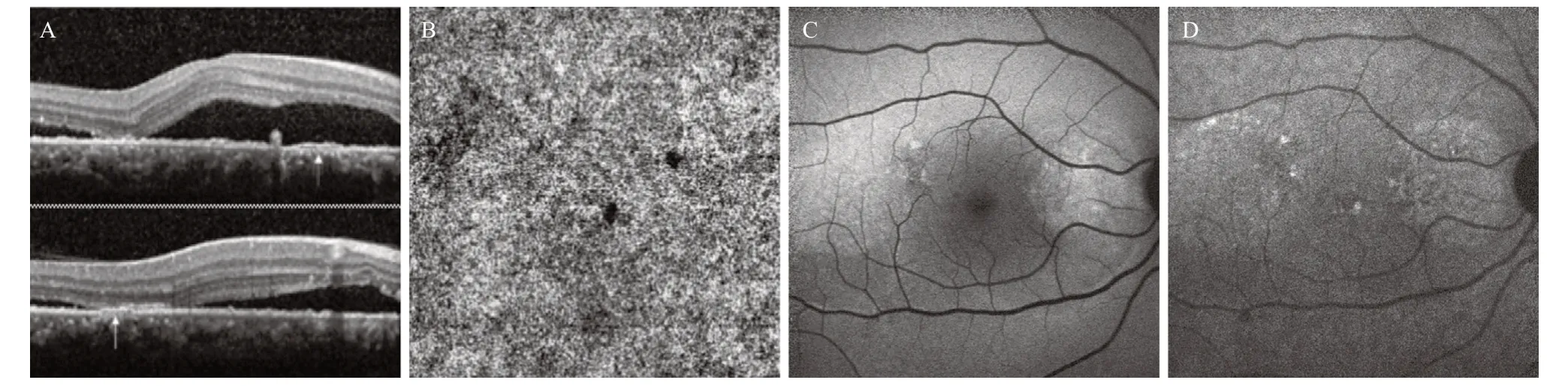
图1 复发性CSCR伴非血管化FIPED的多模影像表现
2.4 血管化FIPED的FAF表现 血管化FIPED在SWFAF上的改变有3种特征:点状弱AF 13眼,占65%,混合状弱AF 4眼,占20%,见图2A-C;点状强弱混合AF 3眼,占15%。血管化FIPED在NIR-FAF上的表现有2种特征:融合状伴点状弱AF 16眼,占80%,见图2D;斑片状强弱混合AF 4眼,占20%。
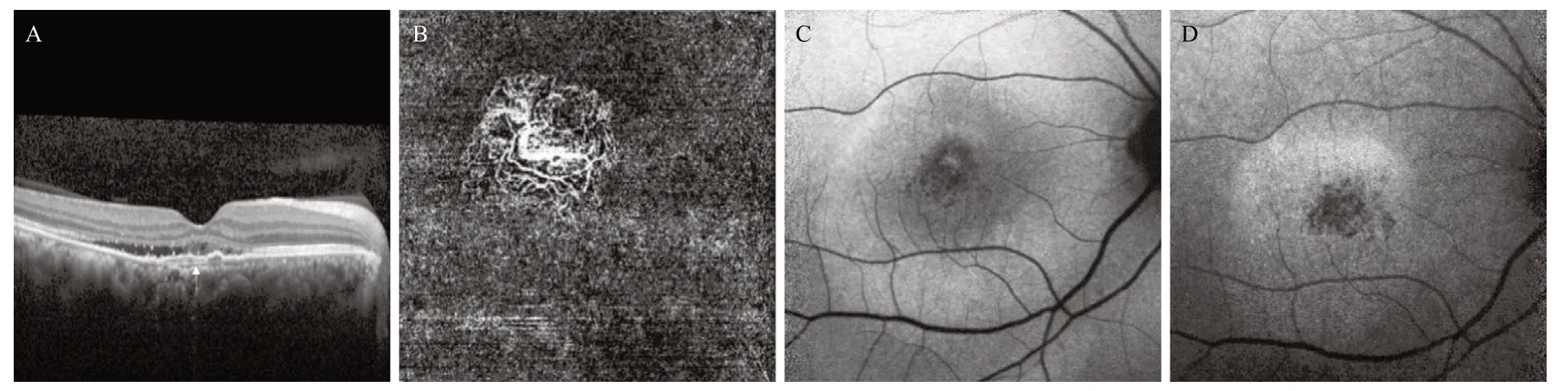
图2 慢性CSCR伴血管化FIPED的多模影像表现
2.5 渗漏点的FAF表现 无论是在SW-FAF还是在NIR-FAF上,所有CSCR眼的荧光素渗漏点均表现为弱AF点,但是NIR-FAF的弱AF点可见性和大小比SWFAF更突出。非血管化FIPED组的CSCR渗漏点均位于FIPED内部,共18眼,占100%,见图3A。血管化FIPED组的CSCR渗漏点中,18眼位于FIPED内部,占90%,见图3B;另2眼位于FIPED之外,占10%。
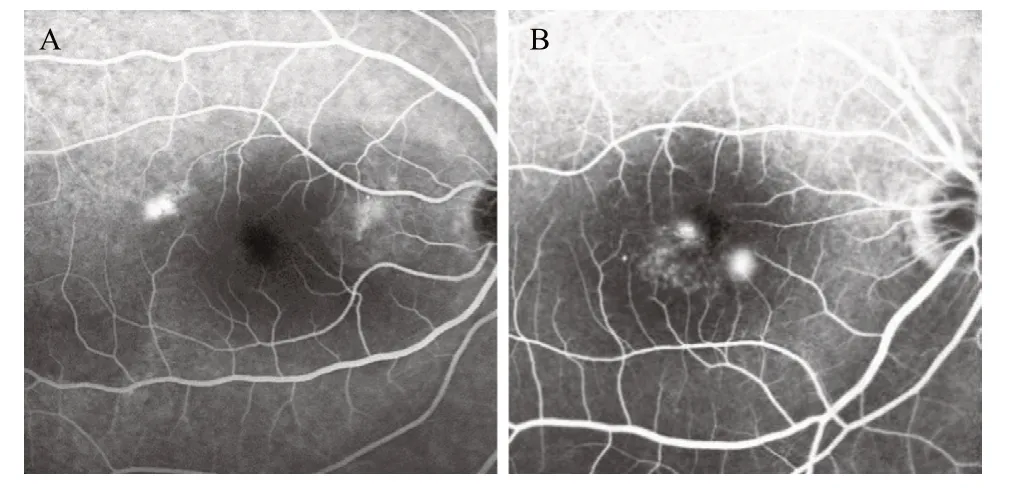
图3 CSCR伴非血管化和血管化FIPED的FFA表现
2.6 两组患者的治疗情况 非血管化FIPED组的18眼全部接受了视网膜激光治疗;血管化FIPED组的20眼中,5眼采取观察治疗,7眼接受了视网膜激光治疗,4眼接受了抗VEGF治疗,另外4眼则接受了抗VEGF治疗联合视网膜激光治疗。
3 讨论
研究表明,与传统的FFA相比,FAF能够提供更丰富的CSCR视网膜病理信息,对CSCR的诊断、监测和预后评估具有重要意义[3-4]。FAF成像技术有两种类型,分别是SW-FAF和NIR-FAF。SW-FAF信号来源于RPE的脂褐素,经488 nm蓝光激发产生;NIR-FAF信号源自RPE和脉络膜中的黑色素,由787 nm近红外光激发产生[5]。正常眼的黄斑区脂褐质含量较低,叶黄素和玉米黄质等色素含量较高,可吸收大部分短波长光,因此黄斑区SW-FAF呈现出以中心凹为中心的弱AF区域。由于黄斑区中心凹处RPE中黑色素含量最高,故正常眼黄斑区NIR-FAF呈现出以中心凹为中心的强AF区域。最初,SW-FAF率先被应用于描述CSCR的临床特征,不少研究先后报道了关于CSCR渗漏点、浆液性视网膜脱离区域、眼底沉积物、PED以及RPE萎缩的SW-FAF特点[3,6-7]。近些年 来,NIR-FAF也逐渐应用于CSCR的研究,许多研究者认为NIR-FAF在检测由CSCR引起的视网膜异常方面比SW-FAF更为敏感[3,5]。
本研究发现慢性或复发性CSCR眼的FIPED在SWFAF上呈现出三种特征:点状弱AF、混合状弱AF和点状强弱混合AF。既往研究发现CSCR中常见的浆液性PED在SW-FAF上通常表现为局灶性高AF[8]。而AZZOLINI等[9]观察了8 例血管化FIPED和2 例非血管化FIPED的慢性CSCR眼,发现所有患者的黄斑区SW-FAF呈点状强弱混合AF,与本研究的观察结果接近。但是,该研究样本量较小,未进一步讨论结果。BINDEWALD-WITTICH等[10]观察了93只存在PED眼的SW-FAF,发现其中12只血管化PED眼的SW-FAF主要表现为不规则颗粒状AF。研究者认为SW-FAF信号的变化可能是由于相应视网膜层内形态学和代谢学的改变所致,而不一定与特定的PED亚型或病理改变一致[10]。GIANSANTI等[11]发现SW-FAF能够检测CSCR眼中的PRE营养不良,18只眼(占95%)表现为强AF,20只眼(占100%)表现为弱AF。脂褐素是光感受器外节的副产物,并在RPE溶酶体内随着年龄和视网膜疾病的发展而积累,SW-FAF可以显示活体RPE中脂褐素的水平和分布。当脂褐素或其前体荧光团在RPE上方或内部过度积累时,会产生强AF;而当RPE失去功能,不再产生和降解任何荧光团时,就会出现弱AF,表明此时RPE受损或缺失。在本研究中,血管化FIPED在SW-FAF上主要呈点状弱AF(占65%),而非血管化FIPED主要呈点状强弱混合AF(占55.6%),这说明血管化FIPED可能存在更多的RPE受损或缺失的情况。
NIR-FAF信号源于RPE和脉络膜中的黑色素。研究者推测,其AF增强可能是由于光感受器退化导致RPE吞噬作用增加和黑色素生成增加,以及黑色素受到氧化应激或形成黑脂褐质[12]。AF减弱可能是由于光感受器受损导致黑色素减少,黑色素活性降低导致的吞噬活动减少,黑色素分布不均,RPE细胞早期凋亡,以及渗出或血液的遮蔽等因素[12]。与SW-FAF相比,NIR-FAF在检测黄斑中心凹病变时更具优势,因其不受黄斑色素遮蔽影响。本研究发现CSCR眼中血管化FIPED在NIR-FAF上主要呈融合状伴点状弱AF(占80%),非血管化FIPED主要呈斑片状强弱混合AF(占83.3%),相比SW-FAF更具特异性。ROISMAN等[13]观察了22例慢性CSCR眼PED的NIR-FAF成像,发现36.4%PED呈点状强AF,63.6%呈点状弱AF,没有出现强弱混合AF。这与本研究结果不同,本研究选取的研究对象是与CSCR继发CNV密切相关的FIPED,其病理发展过程和FAF表现可能与其他类型的PED有所不同。此外,在本研究中,血管化FIPED在NIR-FAF上显示出与SW-FAF不同的融合状弱AF病灶,既往的研究未曾报道。PILOTTO等[14]认为NIR-FAF可能比SW-FAF更早检测到地图样萎缩中受损的RPE区域。TOJU等[15]对特发性CNV患者的NIR-FAF研究发现其中心呈弱AF,周围呈环状强AF。据推测,环状强AF可能反映了CNV周围增生的RPE中的黑色素,而中心的弱AF可能是由于RPE被其他细胞类型如成纤维细胞和神经胶质细胞替代所致[15]。在本研究中,血管化FIPED在NIR-FAF上主要呈融合状伴点状弱AF,表明该区域的RPE细胞中黑色素减少。黑色素是一种已知的抗氧化剂,对眼部光损伤和氧化损伤的细胞具有保护作用。然而,随着黑色素的老化,其抗氧化能力逐渐减弱,同时促氧化特性也会逐渐增强[16]。因此,可推测血管化FIPED缺乏正常黑色素,这可能加重氧化损伤,进一步促进1型CNV生长。这一发现有助于更深入理解CSCR继发CNV的病理过程。
此外,AYATA等[3]的研究已经报道了在急性CSCR中,渗漏点在SW-FAF和NIR-FAF上呈弱AF点,而 NIR-FAF成像中渗漏点处的弱AF斑点更为明显,这与本研究结果一致。这些弱AF点可能与RPE缺陷或含有纤维蛋白的致密视网膜下液体有关[3]。此外,由于NIR-FAF成像中黄斑呈强AF区域,因对比度差异使得呈弱AF信号的渗漏点更容易被检测到。同时,NIR-FAF成像使用的特定波长也有助于发现渗漏点[3]。在本研究中,绝大多数渗漏点的弱AF位于FIPED的内部。然而,在2只患有血管化FIPED的眼中,渗漏点的弱AF位于FIPED之外。由于继发CNV的CSCR眼中视网膜下积液的来源仍存在争议,尤其是在目前国内缺乏光动力疗法(photodynamic therapy, PDT)药物的情况下,因此关于该疾病的治疗选择,是抗VEGF药物还是视网膜激光光凝,已成为一个争议点。根据本研究的发现,如果CSCR渗漏点位于血管化FIPED之外,这可能意味着继发性CNV处于非渗出状态,而视网膜下积液的主要来源可能是CSCR本身。在这种情况下,抗VEGF治疗可能是不必要的,仅需进行视网膜激光治疗即可奏效。然而,对于那些渗漏点位于血管化FIPED内部的眼睛来说,这可能意味着继发性CNV处于渗出状态。如果这些血管化FIPED呈现大片融合状弱NIR-FAF,表明此处RPE缺乏正常的黑色素,那么视网膜激光治疗可能无法获得理想效果,而抗血管内皮生长因子(vascular endothelial growth factor, VEGF)治疗可能成为首选。因此,NIR-FAF技术可以较好地帮助临床医师为继发CNV的CSCR患者选择适合的治疗方案。
FAF是一种快速、无创的多模影像工具,可以有效评估CSCR。慢性或复发性CSCR眼中的血管化或非血管化FIPED具有特征性的SW-FAF和NIR-FAF改变,这可能反映了RPE损伤和黑色素分布在不同状态下的差异。相比SW-FAF,NIR-FAF在血管化FIPED的成像中更具特异性,通常呈现融合状伴点状弱AF。这进一步提示黑色素缺失和氧化损伤可能在促进CSCR眼FIPED血管化的病理过程中发挥作用。因此,当NIR-FAF提示处于渗出状态的血管化FIPED存在大量RPE缺乏正常黑色素时,抗VEGF治疗可能成为首选。然而,需要注意的是,本研究是一项回顾性横断面研究,样本量较小,目前仅对FAF影像进行了定性分析,缺乏进一步的定量分析。此外,FAF信号可能会受到视网膜下积液的影响,而NIR-FAF信号还包含了部分脉络膜组织的黑色素成分,这些因素在分析时并未被考虑。因此,以上情况均存在一定的局限性。
