MiR-152-3p靶向调控KLF4促进结肠癌细胞增殖、迁移和侵袭
2023-12-21赵建国朱晓灵金学英江黎明李振军陈遐林
赵建国,朱晓灵,金学英,江黎明,李振军,陈遐林
绍兴市人民医院 浙江大学绍兴医院,浙江 绍兴 312000,1.肿瘤内科;2.肛肠外科
结肠癌(colon cancer, CC)是常见的胃肠道恶性肿瘤,是癌症相关死亡的第二大原因[1]。据统计,CC的发病率和病死率自2000 年以来总体呈下降趋势,但在50岁以下的年轻人群中却持续上升[2]。因此,CC依然是严重威胁人类身体健康的恶性肿瘤之一,需要进一步探究其分子机制,制定具有针对性的诊断和治疗策略。
微小RNA(microRNA, miRNA)是一类小的内源性单链非编码RNA,可以通过调控相应mRNA靶标的表达,进而调节众多生物过程,在不同类型肿瘤的发生发展过程中往往都伴随着miRNA的表达异常[3-4]。 miR-152-3p作为一个重要的miRNA,在多种癌细胞的发展过程中起到关键作用,如肝细胞癌[5]、非小细胞腺癌[6]、前列腺癌[7]等。在肺癌中,miR-152-3p作为lncRNA KIF9-AS1的下游靶标,可抑制肺癌细胞对顺铂的敏感性[8]。在甲状腺乳头状癌中,miR-152-3p低表达可促进甲状腺乳头状癌细胞恶性进展,且miR-152-3p通过靶向TGFA发挥作用[9]。此外,有研究报道miR-152-3p在CC中的表达异常[10-11]。但有关miR-152-3p在CC中是促癌因子还是抑癌因子的结论却不完全一致。Krüppel样因子4(Krüppellike factor 4, KLF4)是一种锌指转录因子,在多种癌症中差异表达[12-13]。KLF4同样在不同癌种中发挥促癌或抑癌作用[14-15]。在CC中,KLF4对CC细胞耐药性产生影响[16]。但miR-152-3p对CC细胞表型的影响是否与KLF4有关,还需进一步探究。因此,进一步研究miR-152-3p在CC中的分子机制,明确其在CC中的作用,具有一定意义。
本研究通过调控miR-152-3p及其靶基因在CC细胞中的表达,进一步探究miR-152-3p对调控CC细胞的增殖、迁移和侵袭过程的分子机制,明确其在CC细胞中的影响。
1 材料和方法
1.1 主要材料与试剂 人正常结肠上皮细胞 CCD841CON(BNCC338086)、人CC细胞系HCT116(BNCC287750)、SW620(BNCC337664)、SW480(BNCC100604)均购自北京北纳生物科技有限公司,胎牛血清(fetal bovine serum, FBS)、链霉素、青霉素、Lipofectamine 2000、TRIzol试剂、结晶紫均购自美国Thermo Fisher公司,EMEM培养基、RPMI-1640培养基、DMEM培养基、L-15 培养基购自美国Gibco公司,PrimeScriptTMRT reagent Kit with gDNA Eraser、TB Green®Premix Ex TaqTM均购自日本TaKaRa公司,RIPA裂解液、ECL试剂盒、MTT溶液均购自中国Solarbio公司,BCA蛋白浓度测定试剂盒购自中国Beyotime公司,PVDF膜和EZ Magna RIP Kit购自美国Millipore公司,一抗兔抗KLF4(ab215036)、兔抗GAPDH(ab181602)、二抗山羊抗兔IgG H&L(HRP)(ab6721)均购自英国Abcam公司,pmirGLO、Luciferase Assay System均购自美国Promega公司,Transwell小室购自美国Corning公司,细胞周期试剂盒、细胞凋亡试剂盒均购自南京凯基生物有限公司,ABI 7500 Real-Time PCR仪购自美国Applied Biosystems公司,荧光及化学发光成像系统购自中国Clinx公司,流式细胞仪购自美国BD Biosciences公司。
1.2 生物信息学分析 从TCGA数据库中下载CC表达量数据集,采用“edgeR”包对数据集进行差异分析(|logFC|>2,adj.p value<0.01)。利用starBase 数据库预测has-miR-152-3p靶基因以及结合位点,结合相关性分析,初步确定其靶向结合关系及表达情况。
1.3 细胞培养 CCD841CON细胞在含10% FBS、 0.1 mg/mL链霉素和100 U/mL青霉素的EMEM培养基中培养;HCT116细胞在含10% FBS、0.1 mg/mL链霉素和100 U/mL青霉素的RPMI-1640培养基中培养;SW620细胞在含10% FBS、0.1 mg/mL链霉素和100 U/mL 青霉素的DMEM培养基中培养;SW480 细胞在含10% FBS、0.1 mg/mL链霉素和100 U/mL青霉素的L-15培养基中培养。培养条件均为37 ℃,5% CO2。
1.4 载体构建和细胞转染 mimic NC、miR-152-3p mimic购自美国Thermo Fisher公司,pcDNA3.1-KLF4质粒(oe-KLF4)和空pcDNA3.1质粒(oe-NC)由上海生工生物工程有限公司合成。将CC细胞接种到6孔板中(1×105个/孔)培养。待细胞汇合度至80%左右时,按制造商的说明书,使用Lipofectamine 2000将mimic NC、miR-152-3p mimic、oe-NC和oe-KLF4转染至CC细胞中,并在合适的培养基中培养,培养条件:37 ℃,5% CO2。
1.5 RT-qPCR 使用TRIzol试剂从结肠癌细胞中提取总RNA。使用PrimeScriptTMRT reagent Kit with gDNA Eraser将RNA反转录为cDNA。接着使用TB Green®Premix Ex TaqTM在ABI 7500 RT-PCR系统上进行RT-qPCR检测。miR-152-3p以U6为内参,KLF4以GAPDH为内参,引物序列见表1。用2-ΔΔCt法比较相对表达量的差异。

表1 引物列表
1.6 Western blot 用RIPA裂解液从细胞中提取总蛋白,随后用BCA蛋白浓度测定试剂盒对蛋白进行定量。经过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,再将蛋白转移至PVDF膜上。将PVDF膜于5%脱脂牛奶中封闭1 h,随后将膜分别与一抗兔抗KLF4(1:1 000)、一抗兔抗GAPDH(1:10 000)在4 ℃下孵育过夜。TBST清洗3次后,与辣根过氧化物酶标记的二抗山羊抗兔IgG H&L(HRP)(1:2 000)在室温下孵育2 h。使用ECL试剂盒在荧光及化学发光成像系统检测蛋白条带并拍照。
1.7 双荧光素酶报告基因检测 将细胞接种到24孔板中,构建含有WT-KLF4(野生型)和MUT-KLF4(突变型)两种pmirGLO荧光素酶质粒。随后将mimic NC和miR-152-3p mimic与WT/MUT-KLF4 质粒共转染到细胞中。转染48 h后,根据厂商说明书使用 Luciferase Assay System测定荧光素酶活性。
1.8 RNA结合蛋白免疫沉淀实验 使用EZ Magna RIP Kit,根据制造商的说明书进行RIP实验。将SW480细胞接种到培养皿中,使用RIP裂解缓冲液裂解细胞,并加入anti-KLF4抗体或正常兔IgG免疫沉淀RNA-蛋白复合物,在4 ℃孵育6 h后,纯化共沉淀的RNA,并进行RT-qPCR分析。
1.9 MTT实验 收集对数期CC细胞,接种于96 孔板(3×103个/孔),在37 ℃、5% CO2条件下培养。在培养24、48、72、96 h时,小心吸去上清,加入 90 μL新鲜培养液,再加入10 μL MTT溶液,继续培养4 h。随后吸掉上清,每孔加入100 μL Formazan溶解液,置摇床上低速振荡10 min,使结晶物充分溶解。在570 nm处测量各孔的吸光值。
1.10 划痕愈合实验 将转染后的CC细胞接种在6孔板中(2×105个/孔)培养,当细胞汇合度达80%左右时,用200 μL移液管尖端轻轻刮擦经过孔中心垂直于孔板路径上的细胞,PBS洗涤除去分离的细胞,加入无血清培养基,在0 h和24 h时分别在显微镜下拍照记录。
1.11 Transwell侵袭实验 将用无血清培养基重悬的CC细胞加入到用基质胶包被的Transwell小室上室中,在下室添加含10% FBS的DMEM培养基。在37 ℃和5% CO2条件下培养24 h。除去底部膜表面的细胞后,4%多聚甲醛固定,0.5%结晶紫染色,显微镜下观察,拍照。
1.12 流式细胞术检测细胞周期 收集转染48 h后的CC细胞,按照细胞周期试剂盒说明书,制备单细胞悬液,加入预冷的70%乙醇固定,4 ℃下过夜。PBS洗去固定液,1 000 r/min离心3 min,收集沉淀细胞。加入提前配制好的500 μL PI/RNase A染色工作液,室温避光30 min后,使用流式细胞仪检测细胞周期。
1.13 流式细胞术检测细胞凋亡 收集转染48 h后的CC细胞,按照细胞凋亡试剂盒说明书,用胰蛋白酶(不含EDTA)消化细胞,然后收集并重悬于PBS (4 ℃)中。1 000 r/min离心细胞并去除PBS后,加入Binding Buffer轻轻吹匀制备单细胞悬液。加入5 μL膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)混匀后,加入5 μL PI。室温下避光10 min,随后用流式细胞仪检测细胞凋亡率。
1.14 统计学处理方法 每次实验进行3次技术性重复,采用GraphPad Prism 8.0软件对数据进行分析。正态分布计量资料以表示,两组比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用Students’t检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-152-3p在CC中表达上调促进细胞恶性行为 从TCGA数据库中下载表达量数据集的数据[正常组织(n=8),肿瘤组织(n=457)]。对数据进行差异分析,相对于正常组织,miR-152-3p在肿瘤组织中显著上调(P<0.001),见图1A。qRT-PCR检测miR-152-3p在人正常结肠上皮细胞CCD841CON和人CC细胞HCT116、SW620、SW480中的表达情况,结果表明人CC细胞中miR-152-3p的相对表达量均显著高于人正常结肠上皮细胞(P<0.01),见图1B。选取相对表达较高的SW480细胞与mimic NC和miR-152-3p mimic进行转染。RT-qPCR检测转染后的两组SW480细胞miR-152-3p相对表达量,结果显示转染miR-152-3p mimic后的细胞miR-152-3p表达量显著增高(P<0.01),见图1C,证明转染效率较好,可用于后续实验。MTT实验结果显示,过表达miR-152-3p的SW480细胞增殖能力显著高于正常表达的细胞(P<0.01),见图1D。细胞划痕愈合实验结果显示,过表达miR-152-3p后细胞迁移能力较正常表达miR-152-3p的细胞显著增高(P<0.001),见图1E。Transwell实验结果显示,过表达miR-152-3p的细胞侵袭能力显著增高(P<0.01),见图1F。细胞周期实验结果显示,miR-152-3p过表达使G0/G1期细胞所占比例显著降低(P<0.01),见图1G。细胞凋亡实验结果显示,过表达miR-152-3p使SW480细胞凋亡率显著降低(P<0.01),见图1H。

图1 miR-152-3p在CC细胞中高表达且促进细胞恶性行为
2.2 miR-152-3p和KLF4 存在靶向结合关系 从TCGA数据库下载表达量数据集的数据[n(正常组织)=41,n(肿瘤组织)=480],分析得KLF4在肿瘤组织中显著下调(P<0.01),见图2A。相关性分析结果显示KLF4与miR-152-3p呈现显著负相关(P<0.01),见图2B。RT-qPCR和Western blot检测KLF4的mRNA和蛋白在人正常结肠上皮细胞CCD841CON和人CC细胞HCT116、SW620、SW480中的表达情况,结果显示,人CC细胞中KLF4的mRNA和蛋白相对表达量均显著低于人正常结肠上皮细胞(均P<0.01),见图2C。通过starBase数据库预测得miR-152-3p与KLF4存在结合位点(图2D)。为验证miR-152-3p和KLF4之间的关系,进行双荧光素酶报告基因检测和RIP实验。双荧光素酶实验结果显示过表达miR-152-3p显著降低了人CC细胞中野生型KLF4 报告基因的荧光活性 (P<0.01),而对突变型KLF4报告基因的荧光活性没有影响(P>0.05),见图2E,表明miR-152-3p和KLF4之间存在靶向关系。RIP实验表明,与IgG组相比,在anti-KLF4免疫沉淀中,miR-152-3p的表达量显著增加(P<0.01),见图2F,表明miR-152-3p可能直接与KLF4相互作用。随后,RT-qPCR和Western blot实验检测转染了mimic NC和miR-152-3p mimic的SW480细胞中KLF4的表达水平。结果显示,过表达miR-152-3p使细胞中KLF4的mRNA和蛋白相对表达量显著降低(P<0.01),见图2G,表明miR-152-3p与KLF4呈负相关性,与生物信息学分析的结果一致。
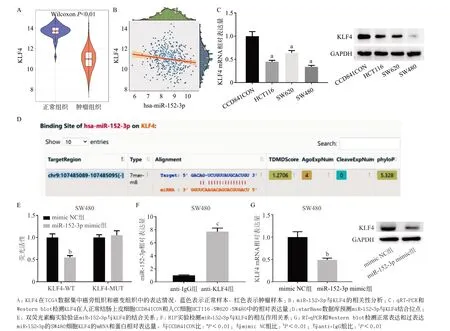
图2 miR-152-3p靶向下调KLF4的表达
2.3 KLF4在CC中抑制细胞恶性行为 选取相对表达量变化较大的SW480细胞与oe-NC和oe-KLF4进行转染。RT-qPCR和Western blot检测转染后的两组细胞KLF4的mRNA和蛋白相对表达量,结果显示转染了oe-KLF4的细胞KLF4的mRNA和蛋白表达量均显著增高(P<0.01),见图3A,转染效率较好。MTT实验结果显示,相较于较正常表达的细胞,过表达KLF4的细胞增殖能力显著降低(P<0.01),见图3B;划痕愈合实验结果显示,过表达KLF4的细胞迁移能力显著降低(P<0.01),见图3C;同样地,Transwell实验结果显示,过表达KLF4的细胞侵袭能力受到显著抑制(P<0.01),见图3D。细胞周期实验结果显示,过表达KLF4使SW480细胞中G0/G1期细胞所占比例显著升高(P<0.05),见图3E。细胞凋亡实验结果显示,过表达KLF4的细胞凋亡率显著上升(P<0.01),见图3F。
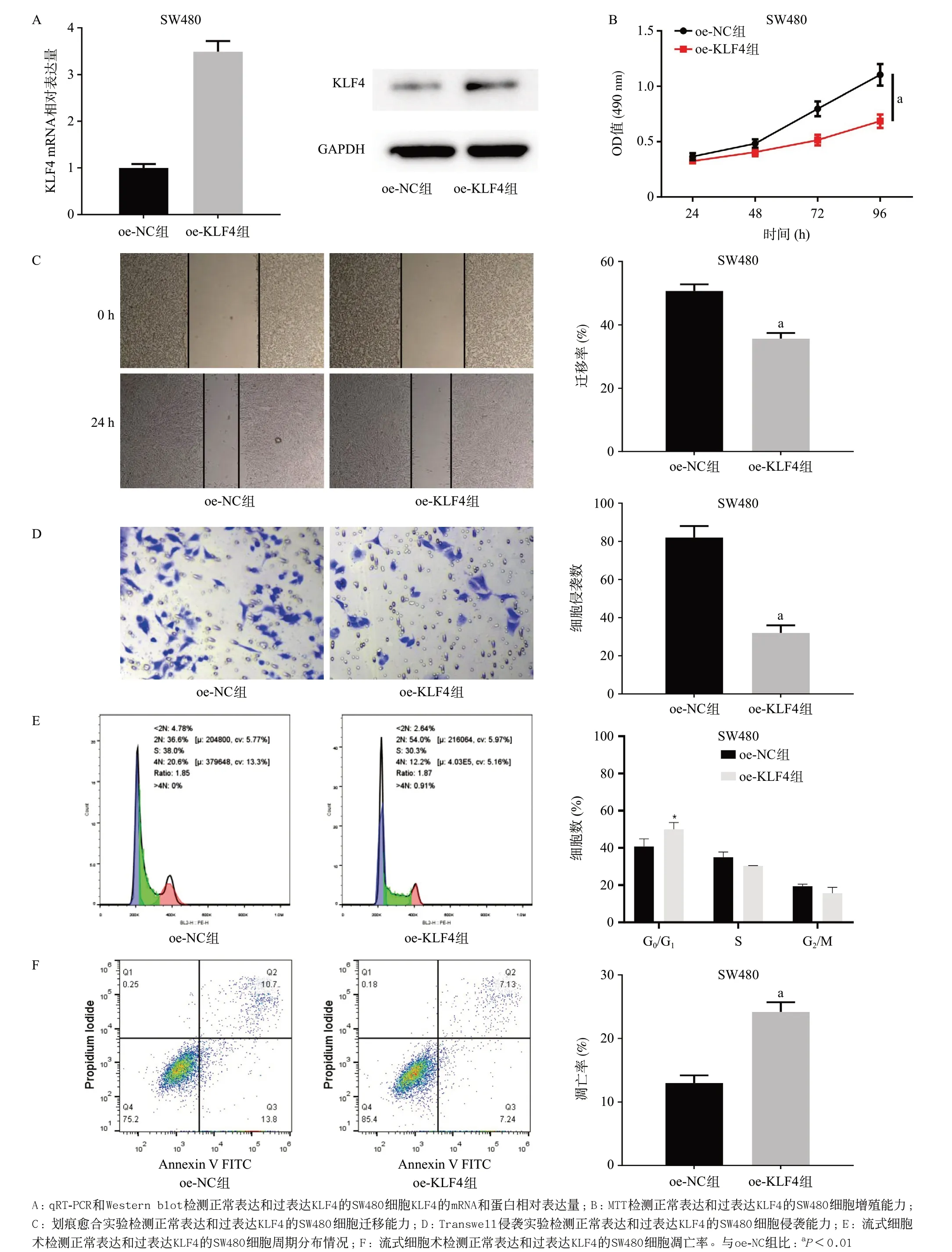
图3 KLF4抑制CC细胞的恶性行为
2.4 miR-152-3p通过负调控KLF4 促进CC细胞增殖、迁移和侵袭 构建以下分组:mimic NC+oe-NC、miR-152-3p mimic+oe-NC、mimic NC+oe-KLF4、miR-152-3p mimic+oe-KLF4。qRT-PCR和Western blot结果显示,相较于正常表达组,单独过表达miR-152-3p的细胞KLF4的mRNA和蛋白相对表达量均显著降低(P<0.01),而单独过表达KLF4后KLF4的mRNA和蛋白的相对表达量显著增高(P<0.01),同时过表达miR-152-3p和KLF4后,细胞中KLF4的表达情况得到恢复(图4A)。MTT实验中,单独过表达miR-152-3p的细胞增殖能力显著增高(P<0.01),而单独过表达KLF4的细胞增殖能力显著降低(P<0.01),两者同时过表达使增殖能力变化得到恢复(图4B)。划痕愈合和Transwell实验结果显示,单独过表达miR-152-3p后细胞的迁移能力和侵袭能力均显著增高(均P<0.01),而单独过表达KLF4的细胞迁移能力和侵袭能力均显著降低(均P<0.01),而同时过表达miR-152-3p和KLF4则使细胞的迁移和侵袭能力恢复到正常表达组的水平(图4C、图4D)。细胞周期和细胞凋亡实验中,单独过表达miR-152-3p的细胞处于G0/G1期的显著减少(P<0.01),且细胞凋亡率显著降低(P<0.01);单独过表达KLF4的细胞显著滞留于G0/G1期(P<0.01),细胞凋亡率也显著增高 (P<0.01);而两者同时过表达后则抑制了这些变化(图4E、图4F)。

图4 miR-152-3p通过靶向KLF4影响CC细胞的发生发展过程
3 讨论
越来越多的研究证明,miRNA在肿瘤发生发展过程中发挥关键作用。一些miRNA在多种肿瘤中表达异常,因此其可能被用于预测肿瘤患者的预后。有多个研究报道miR-152-3p在CC中表达异常[10-11,21], 但结果却不全一致。基于此,我们通过生物信息分析初步确定miR-152-3p在CC组织中的表达上调,随后在CC细胞系中进行实验检测验证了miR-152-3p的表达,miR-152-3p过表达促进CC细胞增殖、迁移和侵袭,抑制细胞凋亡,并增加G2/M细胞比例。这表明,本研究中miR-152-3p在CC中发挥促癌作用。
目前对于miR-152-3p的研究报道显示,其可以通过作用于多个靶基因发挥肿瘤调控作用,如 SLC7A5[22]、RAB14[23]和ITGA9[24]等。本研究中,我们通过生物信息分析预测到miR-152-3p与KLF4具有结合位点,并利用双荧光素酶和RIP实验验证了两者的靶向结合关系。接着我们对miR-152-3p和KLF4进行相关性预测分析,并通过qRT-PCR和Western blot实验验证了miR-152-3p与KLF4 呈负相关性。KLF4是一个锌指转录因子,通过上调p21WAF1/Cip1和下调cyclin D1来抑制结直肠癌细胞的增殖,在结直肠癌中确认为抑制肿瘤的基因[25]。本研究中KLF4过表达可抑制CC细胞增殖、迁移和侵袭,促进凋亡,并阻滞细胞周期在G0/G1期。在miR-152-3p过 表达的同时上调KLF4的表达,则可以减弱miR-152-3p过表达对CC细胞表型的促进作用。这表明在CC中,miR-152-3p通过靶向KLF4调控细胞表型。有研究发现,KLF4与干细胞分化有关[26]。MA等[14]研究发现KLF4与整合素β4结合后,通过维持癌症干细胞形状对神经胶质瘤发挥促进作用。此外,有研究报道,KLF4对上皮向间充质转化(epithelial mesenchymal transformation, EMT)诱导转录因子发挥抑制作用,进而对EMT的发生产生影响[27]。因而,我们猜测在CC中,miR-152-3p靶向KLF4对CC细胞增殖、迁移和侵袭等产生影响,其中KLF4 可能通过影响多种途径,比如细胞干性、EMT进程等对CC细胞发挥作用。当然,这还需要在未来的研究中继续探究。
综上所述,本研究明确了miR-152-3p在CC中为促癌因子,并参与调节肿瘤细胞的增殖、迁移和侵袭。本研究尚存不足之处,今后还需利用动物实验进行进一步验证,并纳入临床样本进行检测,使其能真正应用于临床。
