马尔堡病毒疫苗研究进展
2023-12-21吕永智张传师
樊 毅,李 萍,吕永智,张传师
马尔堡病毒(Marburg virus, MARV))可感染人及非人灵长类动物(nonhuman primates, NHP),造成严重的马尔堡出血热(Marburg hemorrhagic fever, MHF)。该病毒在1967年随感染的猴子由乌干达传播至欧洲,并首次发现于德国马尔堡、法兰克福和前南斯拉夫的贝尔格莱德[1]。据文献记载,马尔堡病毒在非洲等地先后暴发了16次,共造成400多人死亡,病死率高达88%[2]。研究发现,一些与人类有接触的蝙蝠,如北非果蝠(Rousettus aegyptiacus)是该病毒的天然宿主,病毒可由果蝠传染给人类,并在人类间传播。2014年同属丝状病毒科的埃博拉病毒在西非大流行,成为全球公共卫生紧急事件,使得人们高度关注丝状病毒。据估计,马尔堡病毒威胁着撒哈拉以南非洲约1.05亿人的健康,其流行覆盖范围比埃博拉病毒更广[3]。因此,世界卫生组织在2018年将马尔堡病毒确定为需要紧急研发疫苗的重点病原体。开展相关的研究对于疫病的防控在军事和社会方面具有重大意义[4-5]。近期,全球多地陆续出现人感染马尔堡病毒病例,且几内亚、加纳、赤道几内亚和坦桑尼亚均为首次出现人感染马尔堡病毒疫情,表明病毒有扩散趋势,为全球疫情防控再次敲响了警钟。虽然马尔堡病毒的病死率极高,但其较低的暴发率及感染病例限制了其疫苗的发展。因此,目前尚无针对马尔堡病毒的预防疫苗和特效治疗药物可供选择。本文对马尔堡病毒及其疫苗研究进展进行了综述,以期加深大众对马尔堡病毒的认识,为科学防控及疫苗的研发提供有价值的信息。
1 马尔堡病毒
1.1 病原学 马尔堡病毒属丝状病毒科,马尔堡病毒属,电镜下呈长丝状、卷曲状、棒状或者环状(图1A)。病毒长700~1 400 nm,直径在75~80 nm,是一种有包膜且不分段的单股负链RNA病毒。马尔堡病毒基因组长约19 kb,共编码7种蛋白,包括NP、VP35、VP40、GP、VP30、VP42及L蛋白(图1B)。根据病毒基因序列可将已知马尔堡病毒分为5种不同的谱系,其中4种可引起人类感染,即马尔堡病毒(MARV)、瑞士马尔堡病毒(Ravn virus, RAVV)、象牙海岸马尔堡病毒(Ivory Coast virus, CIEBOV)和桑吉尼马尔堡病毒(Sudan virus, SUDV),核酸序列差异仅7%,所以又将这5种不同谱系的马尔堡病毒分为感染人与非感染人两种谱系[6-7]。马尔堡病毒的糖蛋白GP位于病毒颗粒表面,是唯一介导病毒黏附和入侵宿主细胞的病毒蛋白,因此,大量研究以GP蛋白为靶点开展马尔堡病毒疫苗的设计[8-10]。
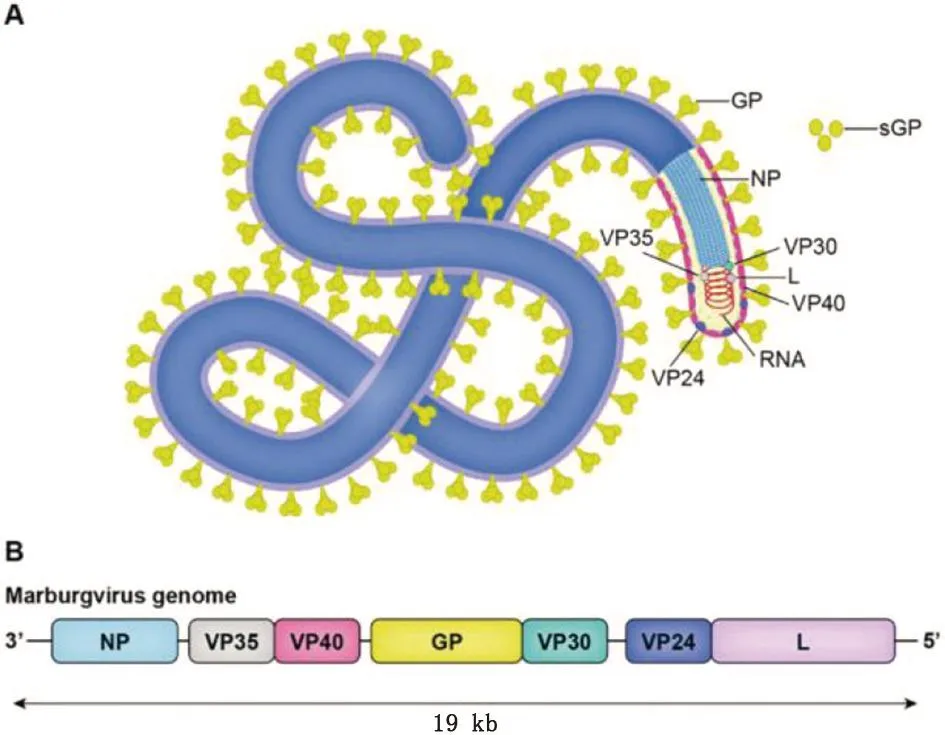
图1 马尔堡病毒的结构及基因组)
1.2 流行病学 马尔堡病毒首次发现于1967年的德国马尔堡、法兰克福和前南斯拉夫的贝尔格莱德3个城市,经过溯源发现病毒是从乌干达进口的实验用非洲绿猴传染给人类[11]。早期疫病主要呈散发的方式在非洲地区流行,未能引起足够的重视,随后在2005年安哥拉以及2012年乌干达先后暴发大规模马尔堡病毒疫情,病死率高达90%,这也显示了该病毒有引发大规模流行的潜力[12]。2021年8月几内亚西南部发现马尔堡病毒病例,该男子在发病8 d后死亡,这是西非已知的第1例马尔堡病毒病病例。随后在2022年9月加纳也发现数例马尔堡病毒感染病例。近来,2023年2月赤道几内亚8个省份中的4个省份(Centro Sur、Kié-Ntem、Litoral和 Wele-Nzas)的5个地区(Bata、Ebebiyin、Evinayong、NsokNsomo和Nsork)暴发了马尔堡病毒感染病例,已知确诊病例17例,其中12例感染者死亡。2023年3月坦桑尼亚确诊了首例马尔堡病毒病例,截至目前,已有8例确诊病例,其中已出现5例死亡,密切接触者多达160余人。目前,马尔堡病毒的流行呈扩散趋势,世界卫生组织正对其进行密切监测[13](见表1)。
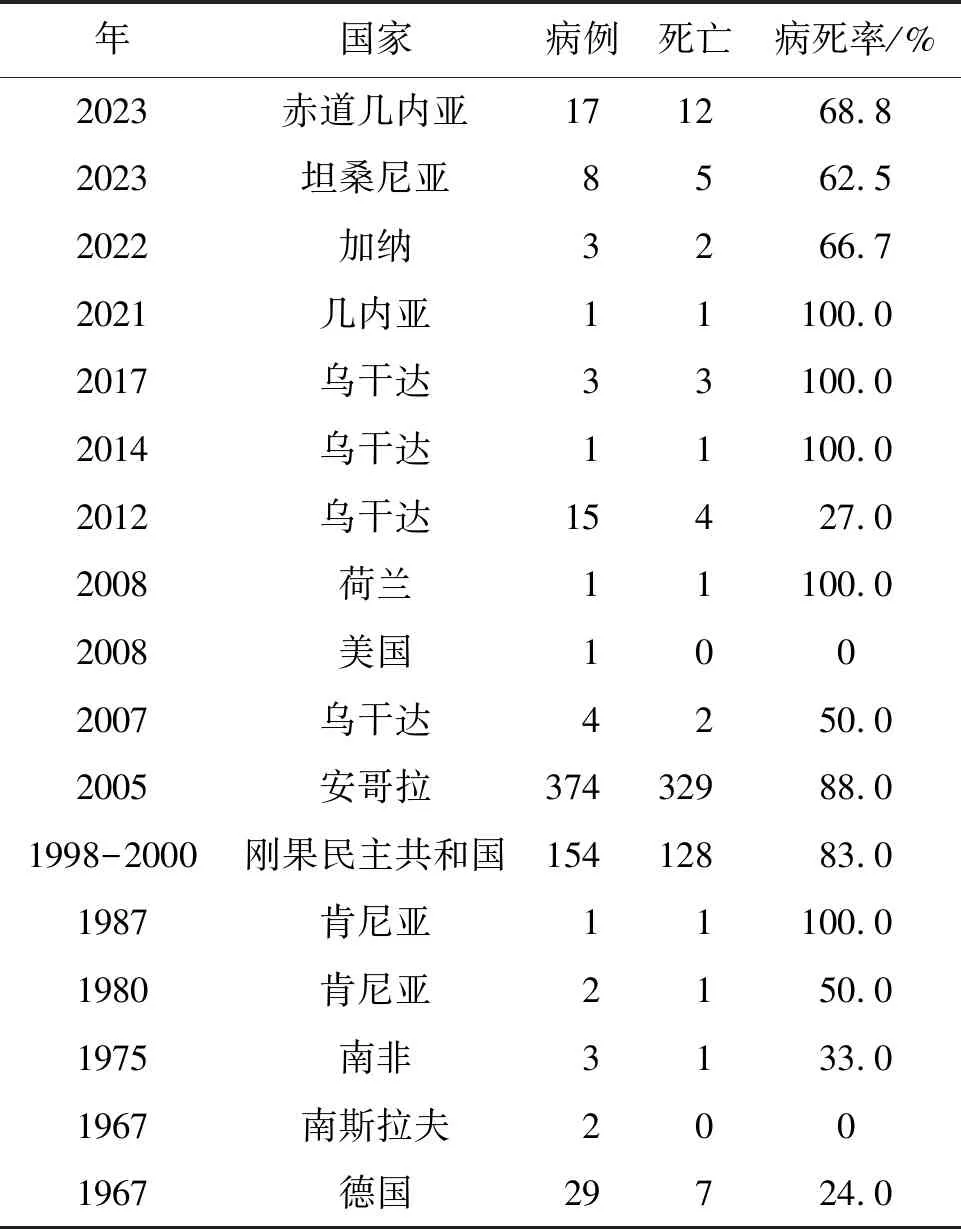
表1 马尔堡病毒流行情况
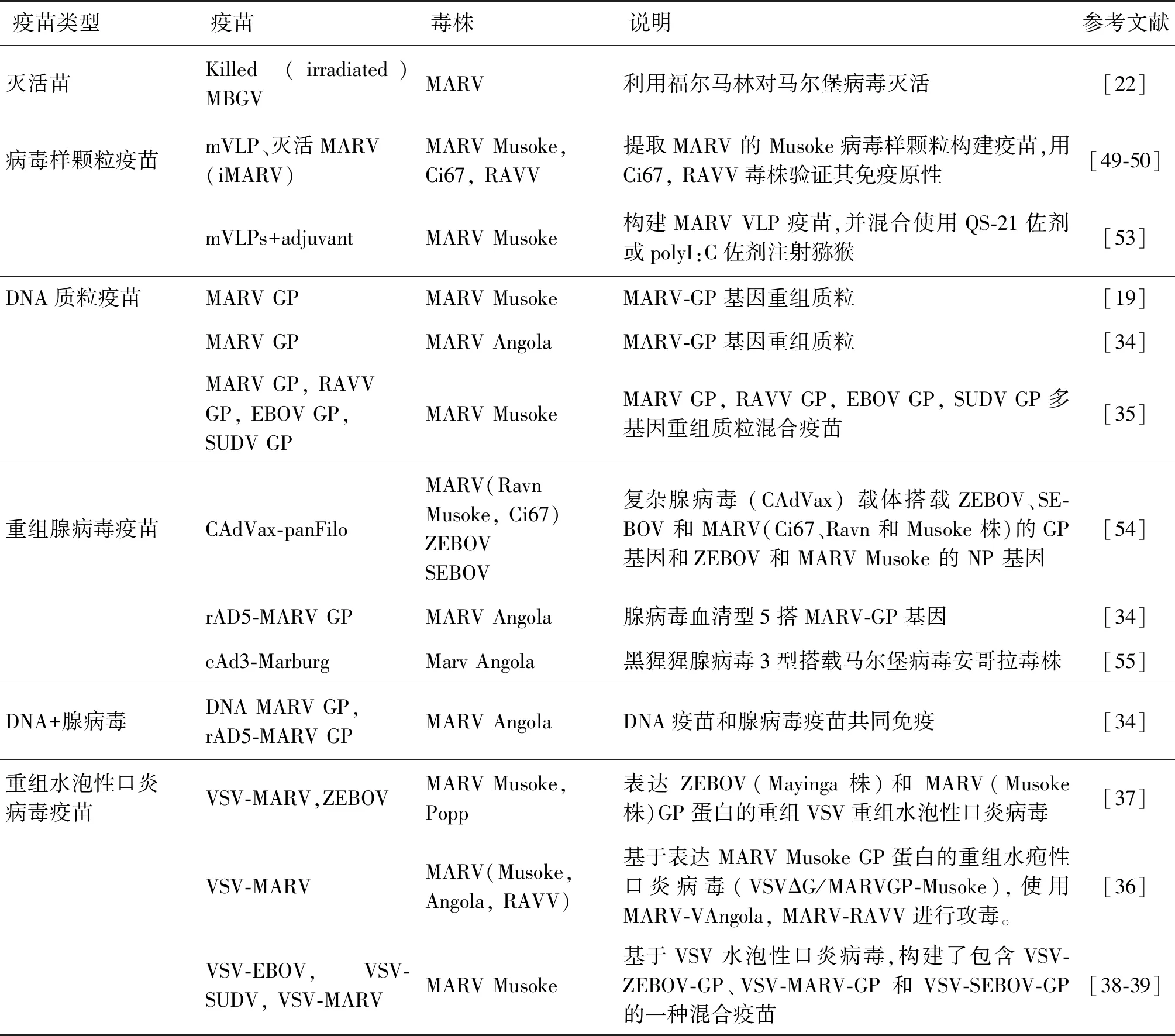
表2 马尔堡病毒病疫苗研究进展
研究显示,马尔堡病毒最初可能由蝙蝠或非灵长类动物传染给人类,可通过直接接触感染动物的血液、分泌物或体液感染进而发病[15-17]。2009年,科学家们成功从乌干达矿场捕获的健康埃及果蝠中分离出马尔堡病毒,表明果蝠是马尔堡病毒的病毒库和天然宿主[18]。此外,非洲绿猴和猪对丝状病毒具有易感性,它们作为宿主同时发挥着病毒放大器作用。马尔堡病毒在人与人之间可通过感染者的分泌物、血液及其他体液传播,也存在通过接触污染物表面进而感染的风险[19]。目前尚无研究证据发现马尔堡病毒可通过蚊子或其他节肢动物在人类之间传播[20]。
1.3 致病性马尔堡病毒的潜伏期 通常在2~21 d,最长潜伏期可达26 d。感染早期会出现突然高烧、发冷、头痛、吞咽痛等症状,皮肤伴有非瘙痒性的红斑和丘疹斑,从局部性病灶发展成弥散性或成片病灶区域。病程在第3 d通常会出现呕吐、腹痛,可能持续一周的水性腹泻,同时伴有严重的疲劳和嗜睡。病程发展5~7 d会出现严重的出血性皮疹及肾损伤,需进行透析来维持生命体征。严重者逐渐发展为低血压、休克和多器官衰竭而死亡[21]。大多数致命病例在发病第2周死亡。死者的呕吐物和粪便中通常有新鲜血液,鼻腔、牙龈或阴道等天然孔洞也会有出血情况[22]。部分感染者通过较长的恢复期逐渐好转,但往往伴有较多的后遗症,如肌痛、疲惫、多汗、皮肤脱屑、健忘症、睾丸萎缩、性欲减退和脱发等。
2 马尔堡病毒疫苗的研究进展
2.1 灭活疫苗 在马尔堡病毒最初发现时,受当时技术水平的限制,疫苗的研发主要以通过福尔马林试剂灭活马尔堡病毒而制备的灭活疫苗为主。动物实验数据显示,灭活疫苗仅能保护约40%的豚鼠和50%的非人灵长类动物免受同源性病毒的攻击[23-24],且在体内建立的体液免疫和细胞免疫差异性较大,难以提供较全面的的保护。由于灭活疫苗存在保护性不高、保护期时间比较短、危险性较高的缺点,所以研究人员将更多的精力投入到了其他分子基因工程疫苗[25-28]。
2.2 DNA疫苗 DNA疫苗具有易生产、无传染性、稳定等优点,并且DNA疫苗能够较好的诱导免疫机体产生体液和细胞免疫一直被作为疫苗研发的首选策略。丝状病毒类的相关DNA疫苗在小型动物模型中具有较好的免疫效果,可诱导高水平体液免疫和细胞免疫,但在非人灵长类动物模型中,单质粒DNA免疫诱导的保护力却不高[29-30]。目前大多数MARV-DNA疫苗研究主要是靶向病毒的糖蛋白GP。研究显示MARV-DNA疫苗可以完全保护小鼠和豚鼠免受病毒攻击,但在NHP体内实验中仅能提供部分保护[31-33]。Geisbert等人的研究中,通过Biojector方式接种启动子经修饰的DNA疫苗可以刺激机体产生更高的保护力。同时在猕猴免疫测试中发现,含有MARV-Musoke-GP和MARV-Angola GP的DNA疫苗可刺激实验动物产生高水平IgG,针对同源毒株的攻击具有较好的保护力。但所有免疫动物在病毒感染后均出现了一定的临床症状,这表明IgG可以降低病毒感染引起的死亡率,并不能完全抑制病毒在体内复制感染[34]。基于DNA疫苗初免,然后通过其他类型的疫苗进行加强免疫的策略研究已取得一定的成功。在用MARV-GP的DNA疫苗首免,后使用腺病毒载体疫苗rAd5-GP进行加强免疫,结果显示该免疫方案比单独注射其中任何一种疫苗所产生的免疫反应强度更高,可诱导更强的CD8+T细胞免疫反应,表达高水平肿瘤坏死因子α(TNF-α)和γ干扰素(IFN-γ),进而构筑更强的抗病毒免疫防线[34-36]。
2.3 水泡性口炎病毒载体重组疫苗 水疱性口炎病毒(Vesicular stomatitis virus, VSV)是弹状病毒科的一种负链RNA病毒。Jones, SM等人构建了基于减毒VSV病毒载体表达Zaire埃博拉病毒(ZEBOV)跨膜糖蛋白的重组水疱性口炎病毒疫苗VSVΔG/ZEBOVGP以及表达马尔堡病毒GP糖蛋白的VSVΔG/MARVGP,两种疫苗均能够保护猕猴免受EBOV和MARV的攻击。而VSVΔG/MARVGP疫苗诱导的体液免疫反应比细胞免疫反应更强。
随后,Jones SM团队又基于VSV病毒载体构建了表达MARV-Musoke株糖蛋白GP的重组水疱性口炎病毒疫苗 VSVΔG/MARVGP-Musoke,该疫苗可刺激猕候产生高水平抗MARV IgG抗体(≥1∶1 000),免受同源MARV-Musoke毒株的攻击,且免疫猕猴对致病性更强的Angola毒株和同源关系较远的Ravn毒株均表现出很好的保护力,所有猕猴均无发病症状,生命特征稳定。此外,疫苗对免疫动物无不良反应,表明该疫苗具有较好的保护性和安全性[37]。Geisbert等人基于VSV水泡性口炎病毒,构建了包含VSV-ZEBOV-GP、VSV-MARV-GP和VSV-SEBOV-GP的一种混合疫苗,该疫苗由等量的 VSV-SEBOV-GP、VSV-ZEBOV-GP 和 VSV-MARV-GP载体疫苗组成。在11只猕猴接种了混合疫苗,4个星期后,这些动物中的3只用MARV攻击,3只用CIEBOV攻击,3只用ZEBOV攻击,2只用SEBOV攻击。结果显示接种混合疫苗的猕猴均健康存活。这证明该疫苗可保护NHP免受所有人类致病性丝状病毒的代表性菌株的致命攻击[38]。另一项研究表明,猕猴在接种rVSV-MARV-GP疫苗 14个月后,进行攻毒实验,体内存在的IgG可以产生相应的保护作用[39]。基于该研究,在2014-2016年西非埃博拉病毒(Ebola virus, EBOV)流行期间,一种rVSV-EBOV疫苗成功研制并用于人体接种试验[40]。总而言之,以rVSV平台搭载MARV构建疫苗很有前景,在接触病毒后20~30 min内注射rVSV疫苗可有效保护50%~100%的猕猴免受丝状病毒攻击,保护水平取决于病毒株,但是目前还没有正在进行的一期临床试验的疫苗[41-43]。
2.4 病毒样颗粒疫苗 病毒样颗粒(Virus-Like Particle, VLP)由于不包含病毒核酸,没有感染与复制能力,所以具有较高的安全性,并且其形态结构与天然病毒相似,可以诱导机体产生免疫原性较好的细胞免疫和体液免疫应答,是目前病毒疫苗研发的热点[44-48]。Warfield等人使用马尔堡基质蛋白VP40和糖蛋白GP生产了马尔堡VLP (mVLP)疫苗,该疫苗产生的VLP在形态上与马尔堡病毒粒子相似[49]。Swenson等人针对MARV-Musoke毒株构建了VLP疫苗,在NHP中进行了测试,接种动物体内发生了免疫反应并产生抗体,4周后进行MARV-Musoke、MARV-Ravn和MARV-Ci67毒株攻击实验,所有NHP都表现出交叉保护,由此说明该疫苗具有较好的免疫原性[50]。盖微微等人通过使用杆状病毒表达系统共表达马尔堡病毒糖蛋白 (GP) 和基质蛋白 (VP40) 制成MARV-VLP疫苗。该MARV- VLP疫苗与佐剂茯苓多糖 (PCP-II) 混合接种恒河猴产生了高达1∶1 280的糖蛋白GP特异性IgG抗体滴度和1∶320的病毒中和抗体滴度。MARV-VLP还可以引发T细胞介导的干扰素-γ (IFN-γ)和白介素-4 (IL-4)分泌。这些数据表明,混合了佐剂PCP-II的MARV-VLP疫苗在恒河猴中具有优异的免疫原性,可能是一种很有前途的 MARV 候选疫苗[51-52]。John MD等人构建了MARV的GP、NP和VP40蛋白病毒样颗粒疫苗,并使用QS-21佐剂或polyI:C佐剂混合注射猕猴,结果表明用该疫苗接种后可以完全保护猕猴免受环境中MARV-Musoke毒株攻击[53]。目前研究中的MARV病毒样颗粒疫苗主要是通过在动物细胞共表达GP和VP40或者在昆虫细胞中通过共同感染 GP、VP40和NP组装形成VLPs,这些病毒样颗粒疫苗能够激活机体免疫反应,最终可以诱导体液免疫和细胞免疫应答。
2.5 腺病毒载体重组疫苗 腺病毒(adenovirus, Ad)是一种双链DNA病毒,具有感染性高、结构简单、易操作等特性,通过编辑插入外源基因,可用于细胞表达蛋白和抗体,并且重组腺病毒能够快速、大量生产,其连续传代后的基因组稳定。以腺病毒为载体构建重组毒株转导成功率较高,疫苗进入机体可以模拟病毒感染,刺激机体黏膜免疫,因此很多新发传染病疫苗的研发都是以改造好的腺病毒为载体来进行。
当前针对EBOV已经开展了几种腺病毒疫苗的研究,但是目前对MARV的研究有限,主流研究是将马尔堡病毒糖蛋白(GP)搭载在腺病毒血清型5平台上制成重组疫苗。在一项研究中,猕猴被给予单剂量MARV-GP的rAd5疫苗。4周后它们被同源MARV攻击,均没有出现临床疾病[34]。Swenson等人重组构建了包含EBOV、SUDV 和 MARV(Ravn、Musoke 和 Ci67)毒株的5种糖蛋白,以及 EBOV、MARV-Musoke的2种NP蛋白的腺病毒(CAdVax)。并给猕猴接种这种疫苗,后期通过接种EBOV、SUDV 和 MARV-Musoke/Ci67毒株进行攻毒实验,结果显示猕猴机体产生了针对所有5种丝状病毒的抗体,并且没有动物出现临床疾病[54]。Melinda J Hamer MD等人用有复制缺陷黑猩猩腺病毒3型(cAd3)为载体,构建了MARV-Angola腺病毒疫苗cAd3-Marburg。该疫苗目前已经开展人体一期临床实验,大多数参与者(n=27/40,68%)有轻度至中度注射部位疼痛或压痛。所有参与者的全身症状主要为轻度至中度,最常见的症状是不适(n=18/40,45%)、头痛(n=17/40,43%)和肌痛(n=14/40,35%)。没有出现与疫苗相关的严重不良事件。95%的参与者在单次疫苗接种后4周产生糖蛋白特异性抗体反应,T细胞产生大量的IFN-γ、IL-2和TNF。在48周时仍有70%的参与者产生糖蛋白特异性抗体反应。试验表明该药物是安全的且具有免疫原性,未来的将在加纳、肯尼亚和乌干达开展2期临床试验[55]。
3 小结与展望
马尔堡病毒发现至今已超过50多年,病毒致病力强,全球目前仍然没有治疗方法和预防药物。由于MARV病死率高达88%,属于生物安全四级病原微生物,因此其相关的致病机制和疫苗的研究受到一定的限制,研究进度缓慢。而目前非洲多国相继报道人感染马尔堡病毒病例,且疫情呈扩散趋势,加快马尔堡病毒的疫苗及药物研究迫在眉睫。目前,马尔堡病毒疫苗的研究中,腺病毒(CAdVax-panFilo、rAD5或cAd3)载体重组马尔堡病毒蛋白的病毒活载体疫苗具有较好发展和应用前景,其中cAd3-Marburg疫苗是目前唯一进入一期临床实验的疫苗。而水疱性口炎病毒重组疫苗技术也具有高效、快速的特点,目前以该技术构建的埃博拉病毒疫苗在西非已获得生产许可,其有效率高达97.5%,且具有很好的安全性,其在马尔堡病毒疫苗的运用上也具有较好的应用前景。其他种类疫苗如灭活疫苗、DNA疫苗及亚单位疫苗虽然各具优势,但其在免疫原等方面仍需要进一步优化。2018年世界卫生组织将马尔堡病毒确定为需要紧急研发疫苗的重点病原体,旨在加速全球马尔堡病毒疫苗的研发,完善疫苗评估,建立能够保护全世界人民的马尔堡病毒防控体系。
利益冲突:无
