系统性红斑狼疮患者血清C5a、HMGB1、sCD163水平变化及其临床意义
2023-12-20王磊王元元赵远
王磊,王元元,赵远
(洛阳市第一人民医院检验科,河南 洛阳 471000)
系统性红斑狼疮 (Systemic lupus erythematosus,SLE)是一种以累及多系统、多脏器的全身结缔组织炎症反应为表现的自身免疫性疾病。 一般认为与遗传、环境、免疫和内分泌异常等因素有关[1]。目前SLE 尚未治愈方法,随着病情发展,SLE 患者出现继发感染的比例也随之增加。 极大影响SLE患者的生命质量[2]。 血清过敏毒素由一个活性片段C5a 组成,其可在补体激活过程中产生并对炎症介质作出反应。 补体C5a 表达升高表示其可能参与到SLE 神经系统损害的过程而介导炎性反应。HMGB1 属于有致炎作用的核蛋白。 sCD163 属于CD163 的脱落形式,在炎症反应刺激下,外周血中sCD163 水平可明显升高。既往研究表明,当补体活化过程中出现炎症反应后,C5a 便趋化炎症细胞活化、聚集,引起血管扩张、支气管痉挛等炎症反应,阻挡线粒体代谢引导糖尿病、 肾病、 肾损伤[3]。HMGB1 在中枢神经系统中可介导中枢的炎性反应, 且可能成为自身免疫治疗的靶向分子[4]。sCD163 可能作为炎症介质参与SLE 的免疫病理机制[5]。 因此,本研究探究了系统性红斑狼疮患者血清C5a、HMGB1、sCD163 水平变化及其临床意义,旨在指导临床对诊断、评估SLE 活动度及疾病严重程度。
1 资料与方法
1.1 一般资料 选取2020 年1 月至2021 年1 月在本院确诊的71 例SLE 患者设置为SLE 组,男11 例,女60 例,年龄18~61 岁,平均(34.58±4.77)岁。 选取2020 年1 月至2021 年1 月在本院接受体检的健康志愿者35 例设置为对照组, 男4 例,女31 例,年龄18~55 岁,平均(34.29±4.29) 岁。
纳入标准:(1) 本研究所有SLE 患者均符合SLE 诊断标准[6];(2)年龄>18 岁,有一定认知能力;(3)经医院伦理委员会通过,研究对象及家属了解并知情同意。 排除标准:(1)本研究内SLE 患者合并其他类型自身免疫性疾病者;(2)伴有重要器官严重疾病者;(3) 在研究时间内伴有急慢性感染者;(4)伴有糖尿病、恶性肿瘤者。
选取2020 年1 月至2021 年1 月在本院确诊的71 例SLE 患者,根据SLE 活动性指标评分结果分组, 选取SLEDAI 评分<5 分的SLE 患者为无活动组(n=28 例),SLEDIA 评分≥5 分的SLE 患者为活动组(n=43 例),并选取同期在本院接受体检的健康志愿者为对照组(n=35 例)。无活动组男3 例,女25 例,年龄20~61 岁,平均(33.97±4.92)岁;病程4 个月~7 年,平均(3.17±0.66)年。 活动组男8例,女35 例,年龄18~59 岁,平均(34.98±4.67)岁;病程5 个月~8 年,平均(3.41±0.56)年。 对照组男4例,女31 例,年龄18~55 岁,平均(34.29±4.29)岁。所有研究对象年龄、 性别等一般资料无明显差异(P>0.05);无活动组与活动组患者病程无明显差异(P>0.05)。
1.2 检测方法
1.2.1 主要设备与试剂盒 设备: 德国Hettich MIKRO220/220R 离心机、超低温冰箱(深圳海思安生物技术有限公司)、ThermoFisher Multiskan GO全波长酶标仪 (450 nm)(北京赛百奥科技有限公司)、37 ℃恒温箱、蒸馏水或去离子水、高精度加样枪及枪头:0.5~10 μ L、2~20 μ L、20~200 μ L、200~1 000 μ L。
试 剂 盒:HMGB1 ELISA 试 剂 盒、sCD163 ELISA 试剂盒、 人补体片断5a (C5a)ELISA 试剂盒、96 孔 微 孔 酶 标 板,C5a 标 准 品0.3 mL*6 管、HMGB1 标准品400 ng/瓶, 人sCD163 酶标抗体、洗涤缓冲液、终止液、底物工作液、封板膜。
1.2.2 采集样本与标本处理 分别采集三组研究人员清晨空腹状态下外周静脉血。 将血清、血浆用蒸馏水作1:10 倍稀释 (取20 μ L, 加标本稀释液180 μ L,稀释10 倍)得到标本稀释液。采用浓缩洗涤液与重蒸水配比呈1:20, 稀释20 倍得到洗涤液。 配制标准品在使用前加入1 mL 蒸馏水混匀,得到400 ng/mL 的标准品液。
补体C5a: 选择EDTA 或肝素作为抗凝剂,在标本采集30 min 内位于2~8 ℃离心15 min, 取上清液置于-80 ℃或-20 ℃保存。
HMGB1:选择EDTA 作为抗凝剂,在2~8 ℃保存48 h, 在-20 ℃或-70 ℃保存更长时间。 选取8根管作为标准管。 第一管加入标本稀释900 μ L,第二至第八管加入标本稀释500 μ L。 将100 μ L的400 ng/mL 标准溶液加入第一管, 混合均匀,然后用取样器吸出500 μ L,移至第二管。 重复这样做多次稀释,从第七管虹吸出500 μ L 并弃掉。 第八管是空白对照。
sCD163:选择EDTA 或柠檬酸钠作为抗凝剂,混合10~20 min 后2 000~3 000 r/min 离心20 min。 收集血清,如在储存过程中发生沉淀,应再次离心。
1.2.3 检测步骤 补体C5a:取出恒温下板条,在预先包被人C5a 捕获抗体的包被微孔中,加入标本、不同浓度标准品,用封板胶纸封住反应孔,经37 ℃恒温箱孵育90 min 并彻底洗涤。洗板5 次,空白孔加入HRP 标记的检测抗体稀释液和抗体工作液,用新封板胶纸封住反应孔,37 ℃恒温箱孵育60 min。洗板5 次,在空白孔中加入酶结合稀释剂,在其他孔中加入酶结合工作液。 用新封板胶纸封住反应孔,37 ℃恒温箱,避光孵育30 min。洗板5 次,采用底物TMB 显色,避光36 ℃孵箱,避光孵育15 min。加入终止液混匀,采用酶标仪(450 nm)测定吸光度(OD 值),并计算最终标本浓度。
sCD163: 采用双抗体夹心酶联免疫法检测sCD163 水平。 人sCD163 抗体预涂于微孔板上,再将标准品、样品依次加入一排七孔中,一孔只加入标准稀释液,其余孔加入待测样品。 胶条覆盖,室温孵育2 h,每孔加入sCD163 与抗体结合,采用洗涤液洗板5 次,去除未结合的物质后,将人sCD163 hrABS 添加到每个微孔中,形成抗体-抗原-hrABS复合物,胶条覆盖,室温孵育2 h。 采用洗涤液洗板5 次后,再加入底物溶液,室温避光孵育30 min 使之显色。 采用酶标仪(450 nm)测定OD 值,并计算最终标本浓度。
HMGB1:采用双抗体夹心ABC-ELISA 法检测HMGB1 水平。 每孔加入标准品或待测样品,充分混合反应板,37 ℃静置2 h。采用洗涤液洗板5 次,在滤纸上晾干。 在每孔中加入第一份抗体工作液。反应板充分混合,37 ℃静置1 h。洗涤液洗板5 次。在每孔中加入酶标抗体工作液。 反应板37 ℃放置30 min。洗涤液洗板5 次。每孔加入基材工作液,置于37 ℃黑暗中15 min。 每孔加入终止液后,采用酶标仪(450 nm)测定OD 值,并计算最终标本浓度。
1.3 观察指标 采用双抗体夹心ELISA 法测定血清补体C5a、sCD163、HMGB1 水平。 本研究内所有研究对象均收集24 h 尿液(二甲苯防腐剂),采用全自动生活分析仪和免疫比浊法测定尿总蛋白浓度并计算24 h 尿蛋白水平。 采用间接免疫荧光法测定抗双链DNA 抗体(抗dsDNA);采用比浊法测定补体C3、C4 水平。 采用系统性红斑狼疮疾病活动度评分表(SLEDAI)评价SLE 患者基本活动度。
1.4 统计学处理 采用SPSS 18.0 统计学软件分析数据,满足正态分布的计量资料采用(±s)表示,两样本独立t检验比较组间差异,单因素方差分析比较三组间差异,SNK-q 法比较三组两两组间差异;计数资料用率表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 SLE 组患者与对照组的C5a、sCD163、HMGB1水平比较 SLE 组患者C5a、sCD163、HMGB1 水平明显高于对照组(P<0.05),见表1。
表1 两组研究对象的C5a、sCD163、HMGB1 水平比较(±s)
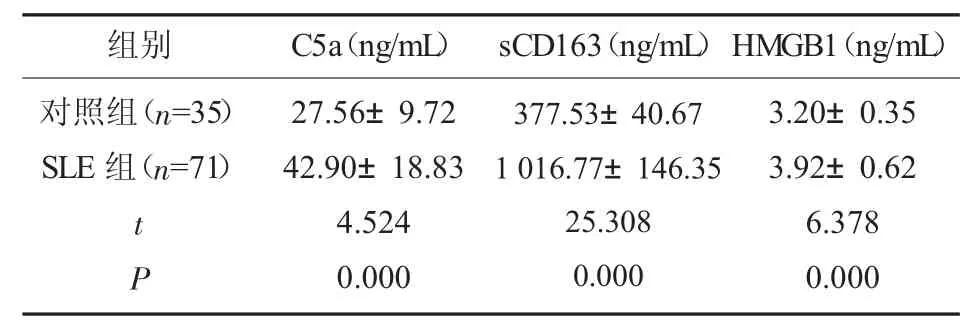
表1 两组研究对象的C5a、sCD163、HMGB1 水平比较(±s)
组别对照组(n=35)SLE 组(n=71)t P C5a(ng/mL) sCD163(ng/mL)27.56±9.72 42.90±18.83 4.524 0.000 377.53±40.67 1 016.77±146.35 25.308 0.000 HMGB1(ng/mL)3.20±0.35 3.92±0.62 6.378 0.000
2.2 三组研究对象的C5a、sCD163、HMGB1 水平比较 活动组患者C5a、sCD163、HMGB1 水平明显高于无活动组、 对照组(P<0.05); 且无活动组患者C5a、sCD163、HMGB1 水平明显高于对照组 (P<0.05); 活动组患者SLEDAI 评分明显高于无活动组患者(P<0.05);见表2。
表2 三组研究对象的C5a、sCD163、HMGB1 水平比较(±s)
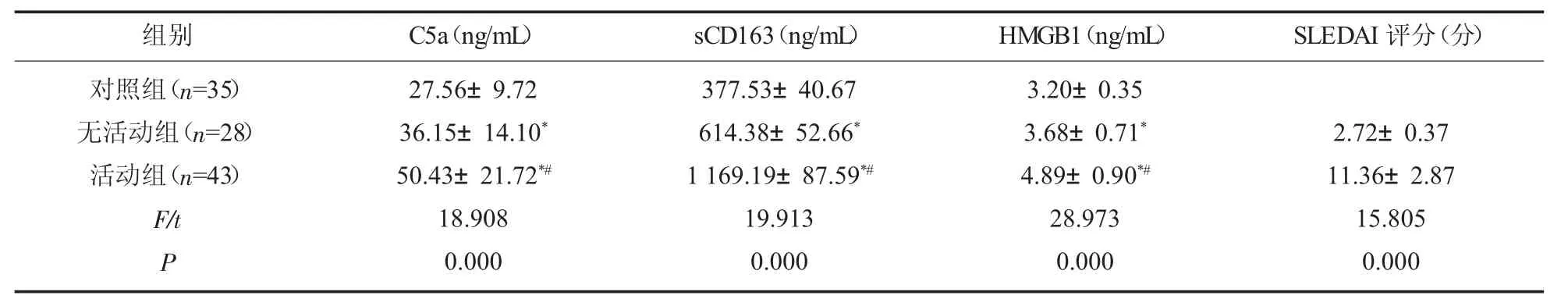
表2 三组研究对象的C5a、sCD163、HMGB1 水平比较(±s)
注:与对照组比较,*P<0.05;与无活动组比较,#P<0.05。
组别 C5a(ng/mL) sCD163(ng/mL) HMGB1(ng/mL) SLEDAI 评分(分)对照组(n=35)无活动组(n=28)活动组(n=43)F/t P 27.56±9.72 36.15±14.10*50.43±21.72*#18.908 0.000 377.53±40.67 614.38±52.66*1 169.19±87.59*#19.913 0.000 3.20±0.35 3.68±0.71*4.89±0.90*#28.973 0.000 2.72±0.37 11.36±2.87 15.805 0.000
2.3 三组研究对象的补体C3、C4、 抗dsDNA、24 h尿蛋白定量比较 活动组患者C3、C4 水平明显低于无活动组、对照组(P<0.05);活动组患者抗dsDNA、24 h 尿蛋白定量明显高于无活动组、 对照组(P<0.05);见表3。
表3 三组研究对象的补体C3、C4、抗dsDNA、24 h 尿蛋白定量比较(±s)

表3 三组研究对象的补体C3、C4、抗dsDNA、24 h 尿蛋白定量比较(±s)
注:与对照组比较,*P<0.05;与无活动组比较,#P<0.05。
组别 C3(g/L) C4(g/L) 抗dsDNA(IU/mL) 24 h 尿蛋白定量(g/24 h)对照组(n=35)无活动组(n=28)活动组(n=43)FP 1.37±0.48 1.10±0.40*0.82±0.36*#17.149 0.000 1.42±0.60 0.96±0.33*0.70±0.14*#22.452 0.000 243.51±43.39 324.64±62.19*362.55±82.73*#25.446 0.000 0.62±0.11 1.22±0.37*1.43±0.54*#26.391 0.000
2.4 SLE 组患者与对照组的C5a、sCD163、HMGB1水平ROC分析 C5a、sCD163、HMGB1 与三者联合检 测SLE 的AUC分 别 为0.778、0.824、0.782 及0.917(P<0.05);见表4 及图1。

图1 C5a、sCD163、HMGB1 诊断SLE 的ROC 曲线
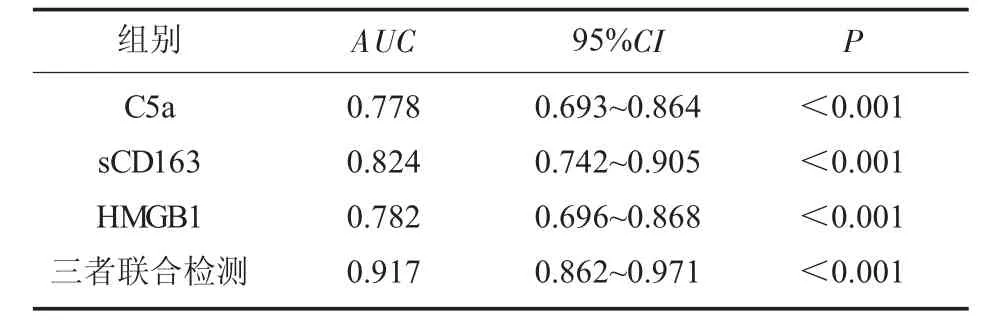
表4 C5a、sCD163、HMGB1 诊断SLE 的ROC 特征
2.5 C5a、sCD163、HMGB1 水平与补体C3、C4、抗dsDNA、24 h 尿蛋白定量的相关性 C5a、sCD163、HMGB1 与补体C3、C4 呈负相关 (P<0.05);C5a、sCD163、HMGB1 与抗dsDNA、24 h 尿蛋白定量呈正相关(P<0.05);见表5。
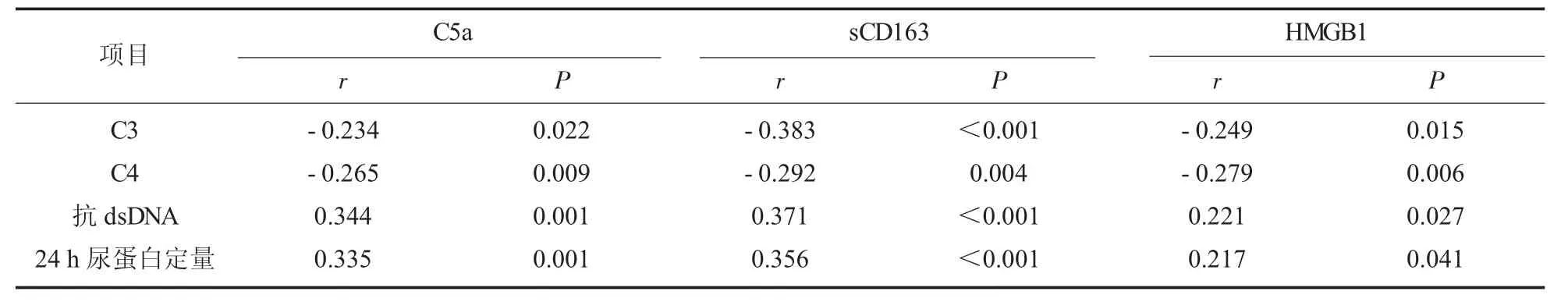
表5 C5a、sCD163、HMGB1 水平与补体C3、C4、抗dsDNA、24 h 尿蛋白定量的相关性
2.6 C5a、sCD163、HMGB1 水平与SLEDAI 评分的相关性 C5a、sCD163、HMGB1 水平与SLEDAI 评分均呈正相关(P<0.05),见表6。
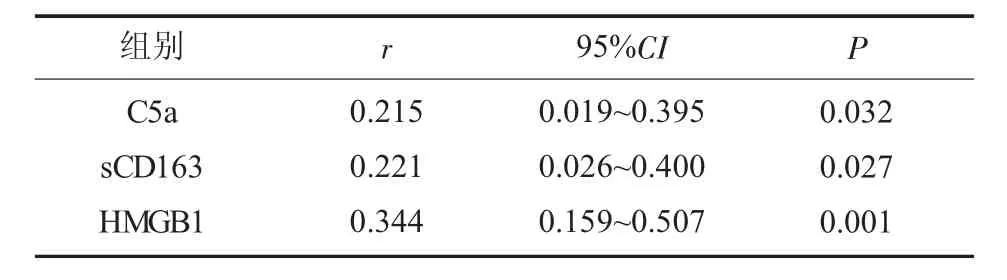
表6 C5a、sCD163、HMGB1 水平与SLEDAI 评分的相关性
3 讨论
SLE 是一种常发生在年轻女性的自身免疫性炎症结缔组织疾病。 患者体内产生大量自身抗体增殖、活化。 HMGB1 在细胞外可介导炎症反应,在类风湿患者的关节液及狼疮性肾炎小鼠模型的肾组织中均发现HMGB1 异常增高[9]。 如不能及时发现SLE 的疾病活动,出现多系统损害,将严重影响患者的生活质量和生存率, 为社会和家庭带来巨大的负担。 故本研究观察并探讨了系统性红斑狼疮患者血清C5a、HMGB1、sCD163 水平变化及其临床意义,旨在为临床早期诊断、及时监测疾病活动度,控制病情提供帮助。
本研究结果显示,SLE 组患者C5a、sCD163、HMGB1 水平明显高于对照组;ROC曲线显示C5a、sCD163、HMGB1 及 三 者 联 合 检 测SLE 的AUC分别为0.778、0.824、0.782 及0.917。有学者研究报道, 健康对照组患者的血清C5a 水平显著低于SLE 患者[10],且有研究发现,血浆C5a 水平可反映患者病情程度[11];有研究学者以C5a 为靶点,补体C5a 单克隆抗体可有效治疗C5a 介导的炎症疾病[12]。 经治疗后的SLE 患者的血清sCD163 明显降低[13]。 SLE 患者的血清sCD163 明显多于正常健康组, 且其皮肤、 肾脏中CD163 巨噬细胞也明显增高;巨噬细胞也可直接参与炎症反应;这些结果提示表达异常的巨噬细胞表面标志物水平可能与SLE 的发病有关[14]。有研究报道,活动期患者HMGB1导致免疫系统攻击自身组织。 C5a 是一种包含74个氨基酸的糖蛋白, 具有过敏毒素样及趋化炎性因子的作用。 研究显示SLE 生物标志物C5a 参与SLE 发病过程,趋化炎症细胞向肾脏迁移,参与炎症反应[7]。 sCD163 是清道夫受体CD163 的脱落形式, 可溶于血清。 在炎性反应刺激下, 外周血sCD163 水平明显升高[8],且能抑制T 淋巴细胞的水平明显高于健康对照组[15],与本研究结果一致;报道内仍显示稳定期患者与健康对照组的HMGB1 水平无明显差异, 与本研究结果不一致,可能与样本数量或采集方法有关。 但仍提示临床C5a、sCD163、HMGB1 参与SLE 发病过程且在诊断SLE 上具有一定价值。
本研究结果显示, 活动组患者C3、C4 水平明显低于无活动组、对照组;活动组患者抗dsDNA、24 h 尿蛋白定量明显高于无活动组、对照组;C5a、sCD163、HMGB1 与 补 体C3、C4 呈 负 相 关;C5a、sCD163、HMGB1 水平与抗dsDNA、24 h 尿蛋白定量、SLEDAI 评分呈正相关。 狼疮肾炎是SLE 最普遍发生的并发症, 其诊断标准包括蛋白尿持续大于3+,提示24 h 尿蛋白定量与肾炎发生有关。C3、C4 曾作为实验室评估SLE 活动的“金标准”,也较好反映SLE 的活动程度。 抗dsDNA 的存在对SLE的诊断价值非常大, 且狼疮肾炎特征之一为自身存在抗dsDNA。 故抗dsDNA 可作为反应疾病活动度及肾脏受累的指标。 既往研究显示,SLE 患者血清补体C5a 与SLEDAI 评分呈正相关[16]; 活动期SLE 患者血清C5a 水平与SLEDAI 评分的相关性高于C3 与SLEDAI 评分相关性[17],结果提示,与补体C3 和C4 相比,C5a 可作为更敏感的SLE 疾病活动性指标。 HMGB1、C5a 水平与24 h 尿蛋白定量、 抗dsDNA 呈正相关,HMGB1 水平与补体C4呈负相关[18-19],且国内外研究结果均显示狼疮肾炎发生与抗dsDNA 水平有关[20-21],提示HMGB1 可能与抗dsDNA 抗体诱导的肾小球免疫复合物结合,进而在狼疮肾炎的发病机制中发挥作用。 既往研究结果与本研究结果一致, 提示HMGB1、C5a 与24 h 尿蛋白定量、抗dsDNA 同样可反映SLE 肾脏受累情况。 抗dsDNA 抗体≥800 IU/mL 的SLE 患者血清sCD163 水平明显升高,经治疗后SLE 患者SLEDAI 评分明显减少[22]。 同样提示血清sCD163具有一定评估SLE 严重程度的意义。
综上所述,C5a、sCD163、HMGB1 可作为诊断SLE 的重要指标;且C5a、HMGB1 可较好评估SLE疾病活动度及肾损伤;sCD163 能反映SLE 疾病严重程度。 本研究仅初步探讨了血清C5a、HMGB1、sCD163 水平在SLE 疾病不同活动度与健康对照组的变化,尚需进一步深入研究。
