血清SF、IGF-1、UBE2C 在乳腺疾病良恶性诊断中意义及与临床病理参数关联性
2023-12-20张云帆崔亚飞
张云帆,崔亚飞
(1.郑州人民医院检验科,河南 郑州 450000;2.郑州儿童医院检验科,河南 郑州 450000)
近年来,乳腺癌发病率呈明显增长、年轻化趋势[1],流行病学调查显示,到2021 年,乳腺癌发病率预计将增加到每10 万名女性中85 人[2],已成为严重危害女性健康的主要疾病之一。 乳腺癌早期无典型性临床症状,仅利用影像学检查,难以获得较高检出率。 随生物学方向对乳腺癌遗传及表观遗传的深入研究, 生物标志物在乳腺疾病早期诊断中的价值逐渐受到临床关注。 铁蛋白(SF)可参与多种组织细胞代谢,参与恶性肿瘤发生、进展过程[3]。 胰岛素样生长因子-1(IGF-1)能刺激肿瘤细胞分裂,增加其恶性程度,提高其转移潜力[4]。 泛素偶联酶E2C(UBE2C)可调控细胞有丝分裂,调节细胞周期进展,其水平高表达参与恶性肿瘤增殖、侵袭、转移[5]。本研究探讨了血清SF、IGF-1、UBE2C在乳腺疾病良恶性诊断中意义及与临床病理参数关联性。
1 资料与方法
1.1 一般资料 前瞻性选取2013 年8 月至2016年12 月我院乳腺癌患者96 例为恶性组, 其中临床分期Ⅰ~Ⅱ期56 例, Ⅲ期40 例;68 例乳腺良性疾病患者为良性组,其中乳腺炎14 例,乳腺增生23 例,乳腺纤维瘤19 例,乳腺囊肿12 例,另选取同期健康体检者68 例为健康组。3 组年龄、绝经状态、体质量指数比较无统计学差异(P>0.05),恶性组血清肿瘤标志物[糖类抗原153(CA153)、糖类抗原125(CA125)、癌胚抗原(CAE)]水平高于良性组(P<0.05)。见表1。本研究经医院伦理委员会批准。
表1 3 组一般资料比较(±s)[n(%)]
注:“-”表示无需进行该指标对比。
一般资料 恶性组(n=96) 良性组(n=68) 健康组(n=68) F/χ2 P年龄(岁)体质量指数(kg/m2)绝经49.18±5.33 22.19±1.50 48.79±5.01 21.98±1.42 47.33±8.24 21.65±2.09 1.835 2.073 0.162 0.128是否血清肿瘤标志物CA125(U/ml)CAE(μg/L)CA153(U/ml)31(32.29)65(67.71)155.98±32.49 12.08±4.01 17.50±3.64 21(30.88)47(69.12)47.18±10.09 9.70±2.26 8.87±1.49 19(27.94)49(72.06)26.31±5.69 3.09±1.33 2.67±0.92 0.358 853.866 190.282 707.732 0.836<0.001<0.001<0.001
1.2 纳入排除标准
1.2.1 纳入标准 (1)恶性组均经手术病理学检查证实为乳腺癌, 良性组均经B 超等影像学检查确诊为乳腺良性疾病;(2) 患者及家属均签署知情同意书。
1.2.2 排除标准 (1)肝肾等重要脏器器质性病变者;(2)Ⅳ期乳腺癌等不符合手术指征者;(3)凝血机制紊乱或活动性内出血者;(4)严重心脑血管疾病者;(5)其他部位恶性肿瘤者;(6)精神行为异常者。
1.3 检测方法 空腹取3 mL 静脉血,离心12 min,3 000 r/min,分离取血清。(1)采用酶联免疫吸附试验检测血清IGF-1、UBE2C 水平,试剂盒购自深圳市科润达生物工程有限公司, 操作步骤: 设空白孔、标准孔、待测样品孔。 酶标包被板上标准孔加入50 μL 样品, 待测样品孔分别加入40 μL 样品稀释液、10 μL 待测样品,轻轻摇匀,封板,置于37 ℃温水中,促使抗体与抗原充分反应。温育30 min 后每孔均加入洗涤液, 重复洗涤5 次, 拍干后加50 μL 酶标试剂,并置于37 ℃温水温育30 min。 重复洗涤5 次,拍干,加显色剂。37 ℃避光显色10 min,于每孔加50 μL 终止液,终止反应。15 min 内450 nm 波长依序测量各孔吸光度。 (2)采用E-170 电化学发光分析仪及配套试剂盒检测血清SF 水平,严格按照德国罗氏诊断有限公司提供的仪器及配套试剂盒说明书操作。
1.4 治疗方法 恶性组均实施改良乳腺癌根治术,良性组则予以弧形切口切除手术。
1.5 统计学方法 采用SPSS 22.0 软件分析处理数据,符合正态分布的计量资料采用(±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验,不符合正态分布的计量资料采用中位数表示,非参数秩和检验,计数资料用n(%)表示,组间比较采用χ2检验, 采用Spearman进行相关性分析,采用受试者工作特征曲线 (Receiver operating characteristic,ROC) 分析诊断价值,P<0.05 为差异有统计学意义。
2 结果
2.1 3 组血清SF、IGF-1、UBE2C 水平比较 恶性组血清SF、IGF-1、UBE2C 水平高于良性组、 健康组,差异有统计学意义(P<0.05)。 见表2。
表2 3 组血清SF、IGF-1、UBE2C 水平比较(±s)

表2 3 组血清SF、IGF-1、UBE2C 水平比较(±s)
组别 n恶性组良性组健康组96 68 68 FP SF(ng/mL) IGF-1(ng/mL)128.37±36.92 70.02±24.15 51.97±20.64 154.827<0.001 204.29±41.30 116.94±29.42 79.28±24.65 299.789<0.001 UBE2C(pg/mL)837.32±164.19 304.08±69.05 267.91±54.02 638.386<0.001
2.2 血清各指标水平与乳腺癌患者血清肿瘤标志物关联性Spearman相关性分析显示, 血清SF、IGF-1、UBE2C 水平与乳腺癌患者血清CA153、CA125、CAE 水平呈显著正相关(P<0.05)。 见表3。

表3 血清各指标与乳腺癌患者血清肿瘤标志物关联性
2.3 血清指标单一诊断乳腺疾病良恶性ROC曲线通过绘制ROC曲线可知,血清UBE2C 诊断乳腺疾病良恶性曲线下面积(AUC)为0.813,明显大于SF(0.804)、IGF-1(0.733)。 见表4、图1。

图1 血清指标单一诊断乳腺疾病良恶性ROC 曲线
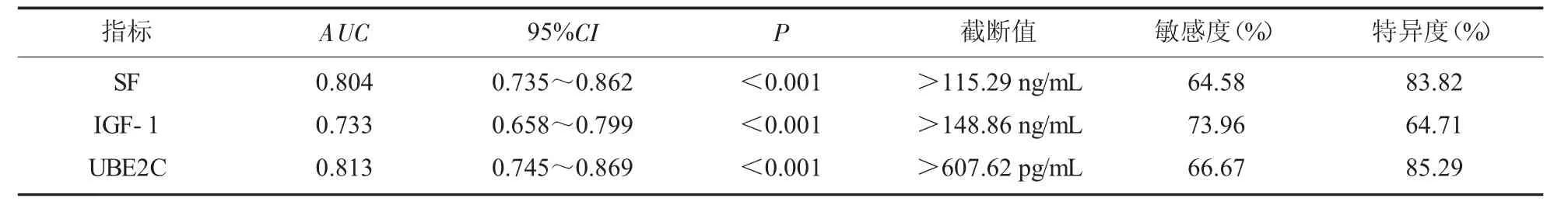
表4 血清指标单一诊断乳腺疾病良恶性ROC 曲线分析
2.4 血清指标联合诊断乳腺肿瘤良恶性的ROC曲线 血清SF、IGF-1、UBE2C 联合诊断时采取Logistic二元回归拟合,返回预测概率logit(p),将其作为独立检验变量绘制ROC曲线, 得出各指标联合诊断乳腺肿瘤良恶性的AUC为0.875,95%CI为0.814~0.921,敏感度为72.92%,特异度为86.76%。见图2。
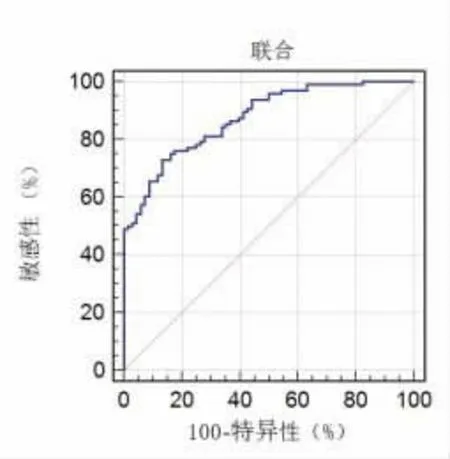
图2 血清指标联合诊断乳腺肿瘤良恶性的ROC 曲线
2.5 恶性组不同临床病理参数患者血清SF、IGF-1、UBE2C 水平比较 不同肿瘤大小患者血清SF、IGF-1、UBE2C 水平相比, 差异无统计学意义(P>0.05); Ⅲ期、 中低分化、 有淋巴结转移患者血清SF、IGF-1、UBE2C 水平高于Ⅰ~Ⅱ期、高分化、无淋巴结转移患者(P<0.05)。 见表5。
表5 恶性组不同临床病理参数患者血清SF、IGF-1、UBE2C 水平比较(±s)
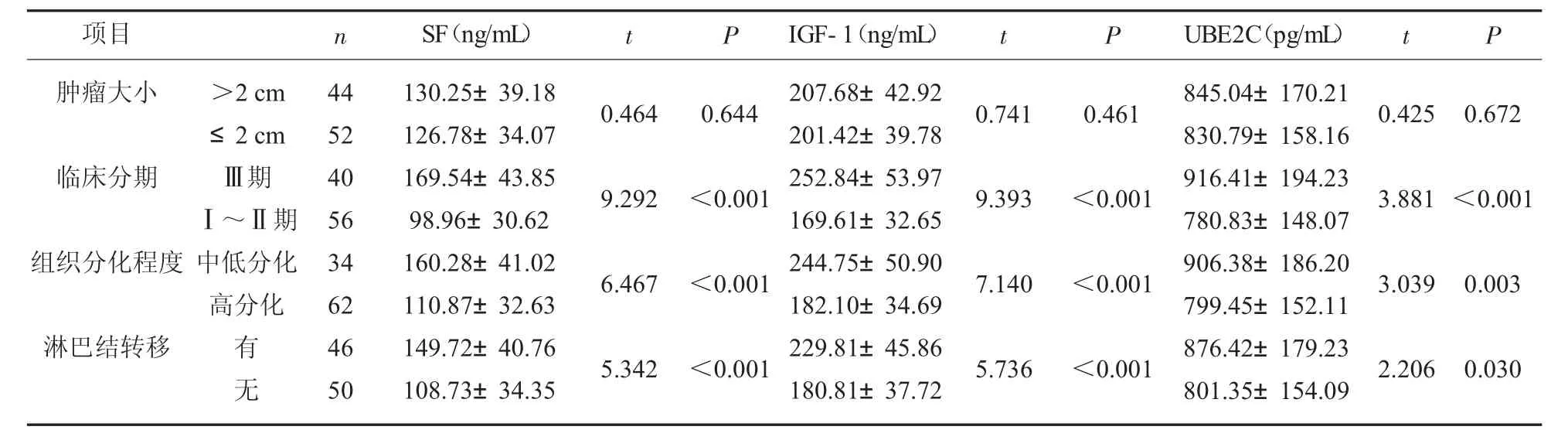
表5 恶性组不同临床病理参数患者血清SF、IGF-1、UBE2C 水平比较(±s)
项目 n SF(ng/mL) t P肿瘤大小t P IGF-1(ng/mL) t P UBE2C(pg/mL)0.464 0.644 0.741 0.461 0.425 0.672临床分期9.292<0.001 9.393<0.001 3.881<0.001组织分化程度>2 cm≤2 cmⅢ期Ⅰ~Ⅱ期中低分化高分化6.467<0.001 7.140<0.001 3.039 0.003淋巴结转移有无44 52 40 56 34 62 46 50 130.25±39.18 126.78±34.07 169.54±43.85 98.96±30.62 160.28±41.02 110.87±32.63 149.72±40.76 108.73±34.35 5.342<0.001 207.68±42.92 201.42±39.78 252.84±53.97 169.61±32.65 244.75±50.90 182.10±34.69 229.81±45.86 180.81±37.72 5.736<0.001 845.04±170.21 830.79±158.16 916.41±194.23 780.83±148.07 906.38±186.20 799.45±152.11 876.42±179.23 801.35±154.09 2.206 0.030
2.6 血清各指标与乳腺癌患者临床病理参数关联性 以乳腺癌患者临床病理参数为因变量, 血清SF、IGF-1、UBE2C 表达为自变量进行的Spearman相关性分析显示, 上述血清指标与患者肿瘤大小无明显相关性(P>0.05);上述血清指标与患者临床分期、淋巴结转移呈显著正相关,与组织分化程度呈显著负相关(P<0.05)。 见表6。
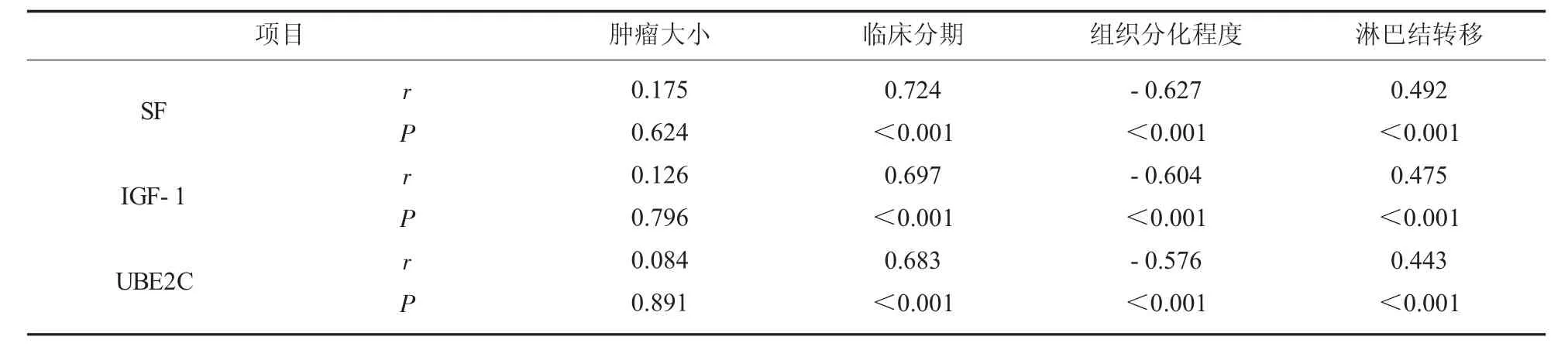
表6 血清SF、IGF-1、UBE2C 与乳腺癌患者临床病理参数关联性
3 讨论
数据显示,30.0%左右乳腺癌患者确诊时已处于中晚期,丧失最佳手术时机[6]。 同时乳腺癌病程较长, 术后5 年生存率<30.0%[7]。 CA153、CA125、CAE 为临床常用诊断乳腺癌的血清肿瘤标志物[8],但其特异性较差。 因此研究新的高特异性血清肿瘤标志物,探索乳腺癌发生、发展机制是目前临床亟待解决问题之一。
SF 主要生物学功能为贮存铁和调节肠黏膜对铁的吸收,可有效反映机体铁储备含量,促进肿瘤细胞增殖[9]。通过研究96 例乳腺癌患者、68 例乳腺良性疾病患者可知,血清SF 水平与乳腺癌患者血清CA153、CA125、CAE 水平存在明显正相关关系,与王军梅等[10]研究相似。 SF 水平升高会导致含铁黄素在组织中大量沉积,引发氧化损伤,乳腺癌细胞异常增殖[11]。
UBE2C 是泛素结合酶家族的重要成员, 在泛素蛋白酶途径(UPS)中具有重要作用[12]。 UPS 通路失调会异常降解一些癌基因及肿瘤抑制基因编码蛋白,造成体内蛋白蓄积,参与癌症病程进展[13]。本研究结果显示,血清UBE2C 水平在乳腺癌患者中呈高表达,与魏震[14]观点一致,并与乳腺癌患者临床分期、淋巴结转移存在正相关性,与组织分化程度存在负相关性。ROC曲线显示,UBE2C 诊断乳腺疾病良恶性AUC最大, 为0.813, 且特异度高达85.29%,提示UBE2C 有望成为鉴别乳腺疾病良恶性的特异性血清标志物。
研究结果显示,IGF-1 可作用于乳腺细胞基质,刺激乳腺癌患者雌激素活性,提高机体雌激素水平,异常增生乳腺导管上皮细胞,促进乳腺癌发生、发展[15]。Spearman相关性分析显示,血清IGF-1与乳腺癌患者临床分期、淋巴结转移、组织分化程度存在一定相关性。
本研究采用联合应用模式, 结果显示, 血清SF、IGF-1、UBE2C 联合诊断乳腺肿瘤良恶性的AUC为0.875,特异度可达86.76%,可见血清SF、IGF-1、UBE2C 联合诊断具有成为乳腺良恶性疾病诊断指标的潜力。
