铁死亡相关基因KIF20A对肾上腺皮质癌患者预后的影响
2023-12-20杨欣睿冯源康贾占奎
杨欣睿 冯源康 贾占奎△
郑州大学第一附属医院1)医务处; 2)泌尿外科 郑州 450000
肾上腺皮质癌(adrenocortical carcinoma,ACC)是一种罕见的泌尿系肿瘤,它具有一定的内分泌功能,通常预后不好[1]。1~4岁和40~50岁的女性患病率较高。在西方国家,ACC发病率为每年0.7~2/百万人[2],我国的预估发病率约为0.7×106~2.0×106例/年[3]。对局限性ACC患者,手术是其他治疗手段的基础;对晚期ACC患者,减瘤手术可使激素控制和后期系统治疗提供可能[4]。依托泊苷、阿霉素和顺铂加口服米托坦(EDP-M方案)是目前常用的治疗ACC的方案[2],但其具有一定的局限性。鉴于ACC的不良预后,探索一种ACC患者的预后预测模型显得尤为重要。铁死亡是近些年新发现的细胞的程序性死亡方式,其更依赖于铁离子和活性氧发挥作用。有研究发现,ACC中铁死亡标志物GPX4的表达升高,提示ACC对铁死亡的敏感性更高[5]。我们运用生物信息学技术,寻找与ACC预后密切相关的铁死亡相关基因,并以其为基础,建立预测ACC患者生存率的列线图。
1 资料与方法
1.1数据准备从肿瘤基因组图谱(the cancer genome atlas,TCGA)数据库获得77例ACC患者的RNA-seq测序数据和临床信息。从GTEx数据库中获得128例正常肾上腺组织的RNA-seq测序数据。从高通量基因表达数据库(gene expression omnibus data base,GEO)筛选获得芯片数据GSE33371数据集(正常组织=10例,肿瘤组织=33例)和GSE14922数据集(正常组织=4例,肿瘤组织=4例)。从FerrDb数据库中获得铁死亡驱动基因264个和铁死亡抑制基因238个。使用在线生物信息学分析工具GEPIA 2获得ACC肿瘤中差异表达的基因和总生存分析排名前500的基因。
1.2关键基因的选择用“venn”包将ACC肿瘤中生存分析排名前500的基因、ACC癌组织中高表达的基因和铁死亡抑制基因进行交集得到ACC肿瘤中高表达的铁死亡抑制基因;将ACC肿瘤中生存分析排名前500的基因、ACC癌组织中低表达的基因和铁死亡驱动基因进行交集得到ACC肿瘤中低表达的铁死亡驱动基因。
1.3关键基因的验证对TCGA数据库ACC的KIF20A表达量和GTEx中正常肾上腺的KIF20A进行t检验验证。对GSE33371数据集和GSE14922数据集中正常组织和ACC组织中KIF20A的表达量进行t检验验证。为了进一步验证KIF20A的作用,在不同分期的ACC组织中对KIF20A的表达量进行方差分析。
1.4关键基因的生存分析用“pROC”包绘制KIF20A表达量的ROC曲线,以KIF20A表达量的最佳截断值为界,将ACC分为高表达组和低表达组。加载“survival”包绘制生存曲线,采用 Log-Rank检验组间的差异性。通过“SurvivalROC”包绘制的时间受试者工作曲线(time-dependent ROC)进行验证。
1.5相关性分析以KIF20A表达量的最佳截断值为界,将ACC分为高表达组和低表达组,分别与各个临床指标进行卡方检验和Logistic回归分析,验证与KIF20A表达相关的临床指标。
1.6列线图模型建立将KIF20A的表达量和各个临床指标分别进行单因素和多因素COX回归,当指标在单因素和多因素回归中均满足P<0.05时,被认为是患者的预后独立影响因素。联合各个指标通过“rms”包绘制出列线图,用于评估患者的1a、3a、5a生存率。
2 结果
2.1关键基因ACC肿瘤中生存分析排名前500的基因、ACC癌组织中高表达的基因和铁死亡抑制基因进行交集得到ACC肿瘤中高表达的铁死亡抑制基因1个:KIF20A;将ACC肿瘤中生存分析排名前500的基因、ACC癌组织中低表达的基因和铁死亡驱动基因进行交集得到ACC肿瘤中低表达的铁死亡驱动基因0个。见图1A、B。

图1 A:ACC肿瘤中生存分析排名前500的基因、ACC癌组织中高表达的基因和铁死亡抑制基因进行交集。B:ACC肿瘤中生存分析排名前500的基因、ACC癌组织中低表达的基因和铁死亡驱动基因进行交集
2.2关键基因的验证TCGA中ACC的KIF20A表达量和GTEx中正常肾上腺组织KIF20A表达量的t检验结果显示,KIF20A在ACC中明显低表达(P<0.05),见图2A。GSE33371数据集和GSE14922数据集结果显示,ACC中KIF20A的表达量明显低于正常组织(P<0.05),见图2B、C。随着Stage分期的升高,KIF20A的表达量逐渐升高(F=8.19,P<0.05),见图2D。
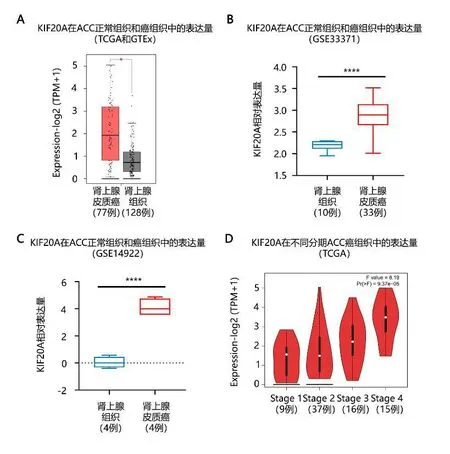
图2 A:TCGA和GTEx数据库中KIF20A的表达情况。B:GSE33371中ACC和正常肾上腺组织中 KIF20A的表达情况。C:GSE14922中ACC和正常肾上腺组织中 KIF20A的表达情况。D:KIF20A在不同Stage分期中的表达情况
2.3关键基因的生存分析ROC结果显示,最佳截断值为784.5,见图3A。以最佳截断值为界,生存分析结果显示,高表达KIF20A组的肿瘤患者生存率更低,见图3B。时间依赖的ROC曲线显示,1a、3a、5a的AUC分别为0.808、0.893、0.815,见图3C。
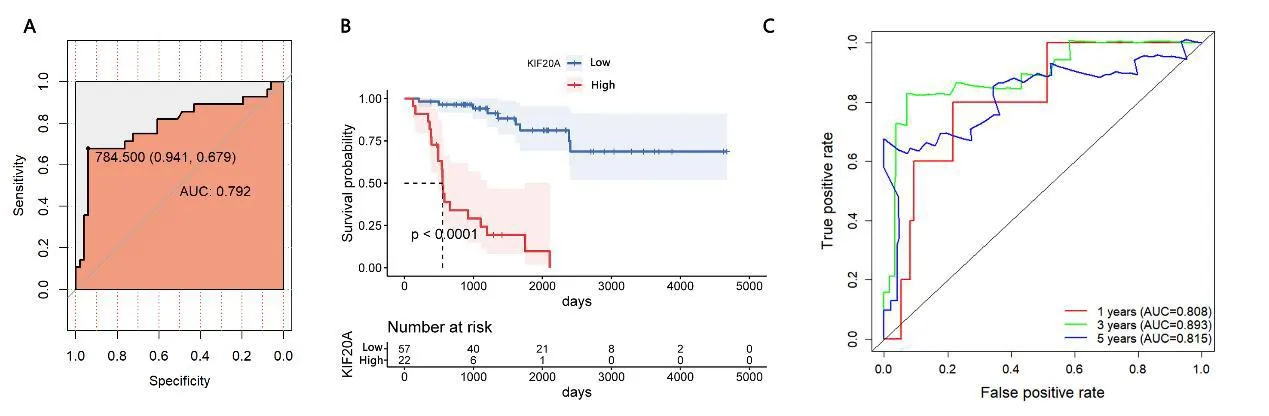
图3 A:KIF20A的ROC曲线。B:KIF20A不同表达量情况下的生存曲线。C:时间依赖的ROC曲线
2.4关键基因表达的影响因素卡方检验结果显示,患者的M分期、N分期、T分期、Stage分期和化疗是影响KIF20A表达的因素(P<0.05),见表1。Logistic分析显示,M分期和T分期是影响KIF20A表达的独立危险因素(P<0.05),见表2。
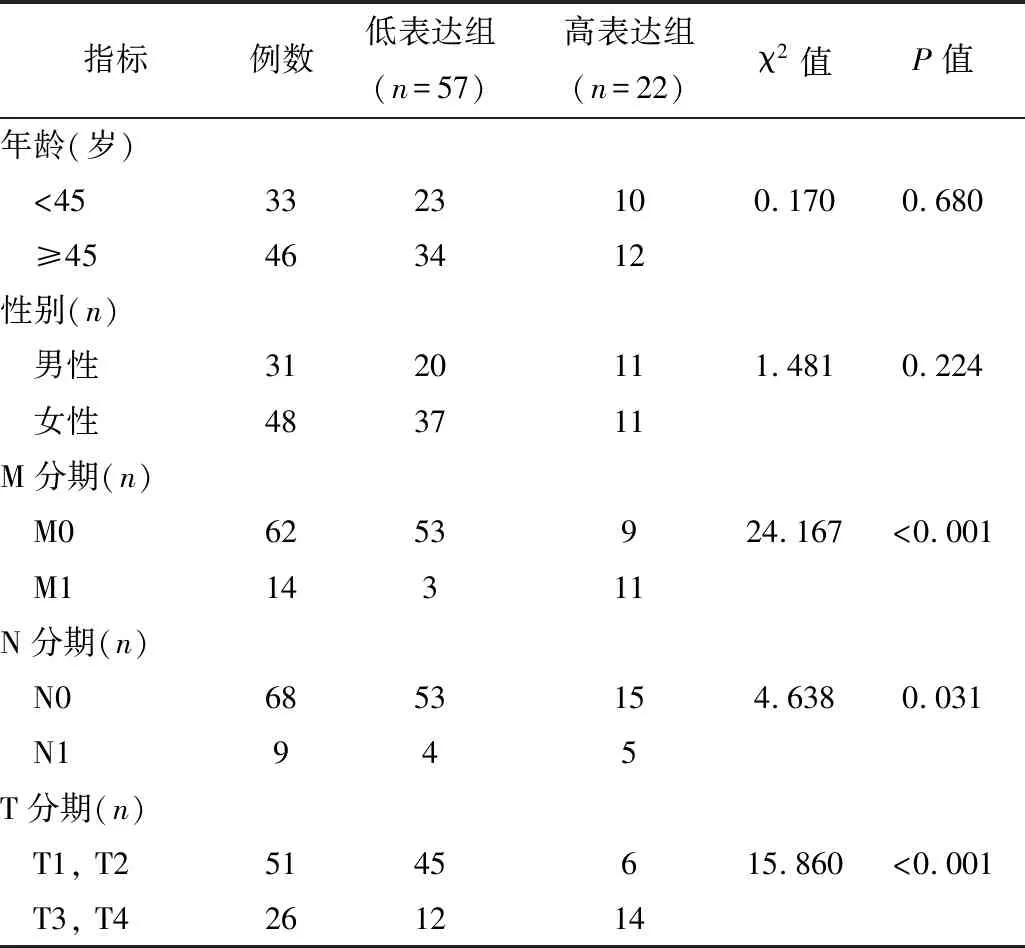
表1 KIF20A的表达量和各个临床指标之间的相关性

表2 KIF20A相关临床指标的Logistic回归分析
2.5列线图模型建立单因素COX回归分析结果显示,KIF20A表达情况、M分期、T分期、Stage分期和化疗是影响ACC患者预后的影响因素(P<0.05),见图4 A;多因素COX回归分析结果显示,KIF20A是ACC患者预后的独立影响因素(P<0.05),见图4 B。以KIF20A表达情况和各个临床指标为基础,绘制列线图用于ACC患者生存情况的预测,并使用校准曲线对列线图进行评估,见图4 C、D。
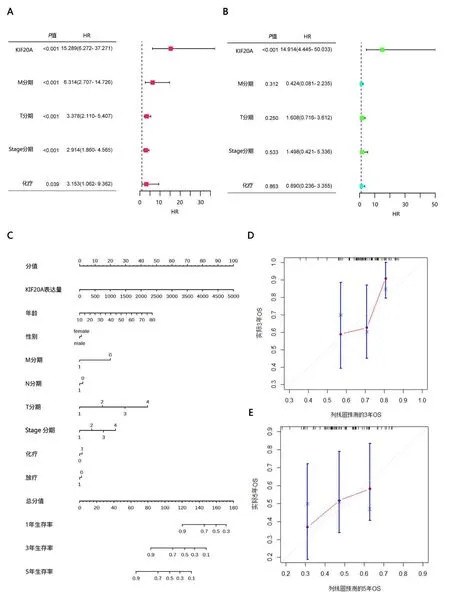
图4 A、B:分别为单因素和多因素COX回归。C:评估患者预后的列线图模型。D、E:该模型的校准曲线,横坐标为预测的事件发生率,纵坐标为观察到的实际事件发生率。
3 讨论
ACC是一种起源于肾上腺皮质的侵袭性肿瘤,该疾病具有明显的异质性,但大多数患者的结局较差,并且缺乏有效的药物治疗选择[6]。在体液中检测到特定的基因产物,有可能作为ACC患者的新的诊断方式。p53-RB和WNT-β-连环蛋白通路是ACC中常见的疾病驱动因素。但是,这些途径很难通过靶向治疗来进行干预。因此,探索一种新的分子靶标对于ACC的诊断和治疗都具有重要的临床意义。
谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)和长链脂肪酸CoA连接酶4(long-chain-fatty-acid CoA ligase 4,ACSL4)基因是铁死亡的关键基因,在细胞的铁死亡进程中发挥着不可替代的作用。有学者指出,GPX4和ACSL4在ACC中高表达,这表明铁死亡在ACC的发生和进展中被明显抑制[7]。本研究发现,铁死亡抑制基因KIF20A在ACC中表达明显升高,这提示我们KIF20A可能在ACC的发生和进展中起到重要作用。
KIF20A是驱动蛋白家族中的一员,它能够启用蛋白激酶结合活性并参与微管束形成、中体脱落和细胞分裂的调节[8]。KIF20A/MKLP2能够调节神经祖细胞的分裂模式[9];KIF20A也能够调节小鼠精子发生中的中心纺锤体组装和顶体的生物发生[10]。有学者指出,KIF20A与前列腺癌、肾癌和结肠癌等癌症的进展密切相关[11-13]。在铁死亡方面,KIF20A能够通过影响GPX4的表达而抑制结直肠癌中的铁死亡[13]。本研究通过生存分析发现,随着M分期和T分期的升高,KIF20A的表达量也明显升高,同时KIF20A与ACC患者的预后明显相关,这表明,KIF20A在ACC的诊断和预后判断中具有一定的临床价值。
列线图,又称诺莫图(Nomogram),它是建立在各种多因素回归分析的基础上,使用生物属性、基因表达情况或者多个临床指标,然后采用带有分数高低的线段,从而达到研究者所设置的研究目的:基于多个因变量的值来判断一定的临床结局或者某类事件发生的概率[14-16]。本研究将患者的性别、年龄、TNM分期、Stage分期、放化疗情况和KIF20A作为因变量,绘制列线图来判断患者的预后情况,这对于临床ACC的诊断、治疗和预后判断都具有重要意义。
本研究发现KIF20A是ACC预后的影响因素,但是上述结果是基于ACC与正常肾上腺组织间基因表达水平的差异,可能忽略了肿瘤进展过程中的调控关系;而且本研究主要是采用生物信息学的方法,缺少基础实验验证。在今后的研究中我们将着重研究KIF20A的上下游调控关系,完善ACC中KIF20A的作用机制,同时探索能够靶向KIF20A的化学药物,为铁死亡药物用于临床ACC患者的治疗提供一定的理论依据。
