肿瘤相关基因ADAM15在结肠癌中一个非同义变异对细胞黏附及侵袭的影响
2023-12-19贺礼兵张国燕刘筱涵
王 晶 贺礼兵 张国燕 刘筱涵 程 杉*
(1.首都医科大学基础医学院医学遗传学与发育生物学学系,北京 100069; 2.北京市十一学校,北京 100039)
结肠癌是全球第三常见的癌症,据报道[1],2020年中国结肠癌新发病例达55.5万,死亡病例 28.6万,分别位居恶性肿瘤的第2位和第5位。结肠癌有高度侵袭性,其可渗透到结肠和直肠组织的深层,通过淋巴系统和血液循环扩散转移[2]。其恶性侵袭和转移是当前临床治疗的极大挑战。
结肠癌是一种复杂的疾病,其发病不仅与生活方式、饮食习惯等多种环境因素相关,也与遗传因素密切相关。众多参与肿瘤发生的癌基因及抑癌基因也与结肠癌的发生发展密切相关。去整合素和金属蛋白酶(a disintegrin and metalloproteinase,ADAM)家族,作为一类跨膜蛋白,包括多个成员,与包括结肠癌在内的多种癌症的侵袭和转移过程密切相关[3-4]。
ADAM家族蛋白主要包括金属蛋白酶[metalloproteinase,adamalysin 2_like peptidase(reprolysin)]域、重复脯氨酸前体肽[reprolysin propeptide(Pep_M12B_propep)]域、去整合素(disintegrin)域以及富含半胱氨酸[ADAM cysteine-rich(ADAM_CR)]域等功能域[5]。其中金属蛋白酶域作为ADAM家族最重要的功能域,其主要负责切割和处理细胞表面蛋白质,在和其他功能域的协调与配合下,完成调控细胞黏附、蛋白信号转导等功能[6]。
作为ADAM家族的基因之一,ADAM15所编码的跨膜蛋白(即ADAM15),在细胞黏附、迁移、增殖、凋亡,以及调控细胞炎症反应和免疫微环境等方面具有广泛作用[7-8]。已有文献[9]报道,ADAM15基因在乳腺癌、肺癌、结肠癌和膀胱癌等组织中异常表达,提示ADAM15的异常表达与肿瘤预后不良相关。因此,本研究选取具有侵袭表型的结肠癌患者的临床肿瘤组织样本,通过全外显子组测序(whole exome sequencing,WES)发现并验证了ADAM15基因非同义单核苷酸变异(single nucleotide variation,SNV) rs6427128(NM_207194:exon6:c.A572C:p.K191T),进一步通过细胞功能实验揭示该SNV对结肠癌细胞增殖、黏附、侵袭及转移等恶性表型的影响。
1 材料与方法
1.1 临床样本收集
本研究采集首都医科大学附属北京友谊医院4例结肠癌患者的肿瘤组织(T1~T4),以及与肿瘤配对的2例癌旁组织(N1~N2),临床样本资料详见表1。本研究通过首都医科大学附属北京友谊医院伦理委员会审批(审批号:2017-P2-013-03)。

表1 研究纳入结肠癌患者临床信息Tab.1 Clinical Information of Included Patients
1.2 细胞培养
人结肠癌细胞HCT-8购自美国模式菌种收集中心,使用含10%(体积分数)胎牛血清的RPMI-1640完全培养基,培养于37 °C、5% (体积分数)CO2培养箱中。以对照质粒pcDNA3.1、ADAM15过表达质粒Flag-ADAM15wt-pcDNA3.1、ADAM15突变体表达质粒Flag-ADAM15mt-pcDNA3.1(通用生物)转染HCT-8细胞,用于后续实验。
1.3 Western blotting
细胞裂解液首先通过SDS-PAGE聚丙烯酰胺凝胶电泳使蛋白质样本分离,再将凝胶上的蛋白电泳转移到固相载体PVDF膜上,封闭液(脱脂牛奶)室温封闭1 h;加入一抗(ADAM15,ab137387,Abcam公司,英国)和内参GAPDH抗体(TA-08,北京中杉金桥生物技术有限公司)孵育过夜,摇床充分洗涤后加入相应二抗室温孵育1 h,充分洗涤后加入ECL发光液,曝光,数码凝胶图像处理系统扫描图像。
1.4 细胞增殖实验
细胞以2.0×103个/孔接种于96孔板中,培养箱中培养1~5 d;96孔板中加入用双无培养基稀释10倍的CCK-8溶液,100 μL/孔;孵育0~2 h;用酶标仪在450 nm波长处检测吸光度值(OA值)。
1.5 细胞黏附实验
96孔板铺入4 μL Matrigel,过夜烘干。加入无血清培养基水化40 min后,2×105个细胞/孔接种细胞。培养箱孵育40 min后去除培养基,PBS清洗3次;黏附于基底膜上的细胞固定染色,光学显微镜下观察、拍照。计数黏附的细胞数,结果取均值。
1.6 细胞侵袭实验
将Transwell小室置于24孔培养板中,铺入40 μL Matrigel,过夜烘干。小室中加入无血清培养基水化基底膜40 min后,在小室下层加入600 μL含20%(体积分数)胎牛血清的RPMI-1640培养基,上层加入200 μL细胞悬液。培养48 h后取出小室,固定染色,光学显微镜下观察、拍照。随机选取3个视野(放大40倍),计数穿过小室的细胞数,结果取均值。
1.7 细胞迁移功能检测
1.5×106个/孔细胞接种6孔板,使细胞在培养过夜后融合率达到100 %;以200 μL枪头在每个孔中划一条直线,用PBS清洗掉划线时脱落的细胞,加入含10 %(体积分数)胎牛血清的RPMI-1640培养基;培养箱中培养不同时间点,在显微镜下观察划痕生长情况并拍照。Image J软件测量划痕宽度,结果取均值。
1.8 WES
从癌/癌旁组织样本中提取总DNA。将提取的DNA样本进行机械消化,将DNA分成150 bp左右。使用SureSelect Human All Exon V8进行外显子捕获;将捕获的外显子DNA片段连接到测序适配器上,形成DNA文库,扩增文库,使用Illumina Hiseq X10平台对文库进行双末端测序(2×150 bp)。
1.9 全转录组测序
提取细胞总RNA。使用Nanodrop ND1000分光光度计(Thermo Scientific公司,美国)确定RNA浓度。VAHTS Universal V6 RNA-seq文库试剂盒、VAHTS RNA Multiplex Oligos Set1- Set2 for Illumina、VAHTS DNA Clean Beads、以及VAHTS mRNA Capture Beads(南京诺唯赞生物科技股份有限公司)进行质量评估和mRNA测序文库制备。使用Illumina Hiseq ×10平台进行成对末端多重测序(2×150 bp)。
1.10 高通量数据分析
(1)WES数据:使用Trimmomatic(版本:0.39)用于输入Fasta序列进行成对匹配和筛选,去掉测序接头。使用BWA(版本:1.5)读段拼接和比对。使用SAMtools(版本:1.15.1)进行二进制格式转换和排序。使用PICARD(版本:2.2.1)软件标记重复,去除聚合酶链反应(polymerase chain reaction, PCR) 重复。使用GAKT(版本:4.0)进行变异检测。使用Annova进行功能注释。
(2)全转录组测序数据:使用Trimmomatic(版本:0.39)用于输入Fasta序列进行成对匹配和筛选,去掉测序接头。使用HISAT2(版本:HISAT2 2.2.0)对处理后数据读段进行参考基因组比对。使用SAMtools(版本:1.15.1)进行二进制格式转换和排序。使用DESeq2(版本:1.40.2)进行RNA-seq差异表达基因分析。对基因功能和通路分别进行基因本体(Gene Ontology,GO)(https://go.princeton.edu/)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)(https://www.kegg.jp/kegg/kegg1d.html)富集通路分析。
2 结果
2.1 WES检出ADAM15基因非同义SNV
首先对4例癌组织及2例癌旁组织进行2×150 bp双端WES,筛选外显子区域SNV,平均每例样本携带24 212个变异,其中平均携带同义变异(synonymous SNV)11 981个,非同义变异(nonsynonymous SNV)11 709个,插入缺失(In/Del)395个,无义变异(stop gain)115个,以及终止缺失变异(stop loss)11个(图1A表示每个样本不同类型变异携带数)。
在肿瘤侵袭表型关联基因ADAM15基因中,共计检出3个变异,分别为①非同义变异NM_207194:exon6:c.G484C:p.G162R(T1,N1携带);②非同义变异NM_207194:exon6:c.A572C:p.K191T,rs6427128(全部6例样本均携带);③同义变异NM_207194:exon19:c.G2277A:p.K759K(T2,N2携带)。其中rs6427128位于ADAM15基因6号外显子,位于重复脯氨酸前体肽Pep_M12B_propep域和ADAM15最关键的结构与金属蛋白酶Reprolysin域之间(图1A)。无独有偶,查找公共数据库TCGA(https://www.cancer.gov/ccg/research/genome-sequencing/tcga)显示,结肠癌患者中聚集重复出现一些ADAM15基因的SNV(图1A)。
此外,除了SNV的贡献外,ADAM15基因的表达量也与预后潜在相关,分析TCGA数据库中结肠癌患者的ADAM15表达量与生存时间的关系,可知,相对于ADAM15低表达组,高表达组的结肠直肠癌患者在50个月后的生存率显著下降(图1B),但GEO数据库中收录的数据又呈现不同趋势结果,如图1C所示,以“转移”为观察指标,相对于ADAM15低表达组,同时期高表达组的结肠直肠癌患者的转移率较低,提示该基因与结肠癌病程具体表型的关联仍需探索。
2.2 细胞功能实验显示ADAM15基因非同义SNV影响肿瘤细胞的黏附及侵袭功能
2.2.1 Western blotting
用带有FLAG标签的ADAM15过表达质粒转染至结肠癌HCT-8细胞中24 h后,采用Western blotting验证ADAM15的转染效率(图2A)。
2.2.2 细胞增殖实验
利用CCK8法检测ADAM15野生型和突变型过表达的HCT-8细胞的增殖能力,发现相对于野生型ADAM15,突变型ADAM15过表达的HCT-8细胞的增殖能力并未显著提高(图2B)。
2.2.3 细胞黏附实验
野生型及突变型ADAM15均显著促进了HCT-8细胞的黏附能力(P<0.000 1);而突变型ADAM15呈现更强的促HCT-8细胞的黏附能力,相对于野生型ADAM15增加了26%(P<0.05)(图2C)。
2.2.4 细胞侵袭实验
相对于空载体,野生型及突变型ADAM15都显著提高了细胞的侵袭能力(P<0.001),但rs6427128 SNV变异削弱了ADAM15促细胞侵袭的能力,相对于野生型ADAM15降低了80%(P<0.05)(图2D)。
2.2.5 细胞迁移实验
细胞划痕实验结果显示,野生型及突变型ADAM15并未促进HCT-8细胞的迁移能力(图2E)。
2.3 ADAM15基因非同义SNV通过多种途径影响结肠癌细胞的恶性表型
全转录组测序结果显示,与野生型ADAM15细胞相比,突变型ADAM15细胞,共计累积363个差异表达基因[log2(Fold Change)>0.585,Padj(FDR)<0.05],其中表达上调基因285个,表达下调基因78个(图3A,3B)。
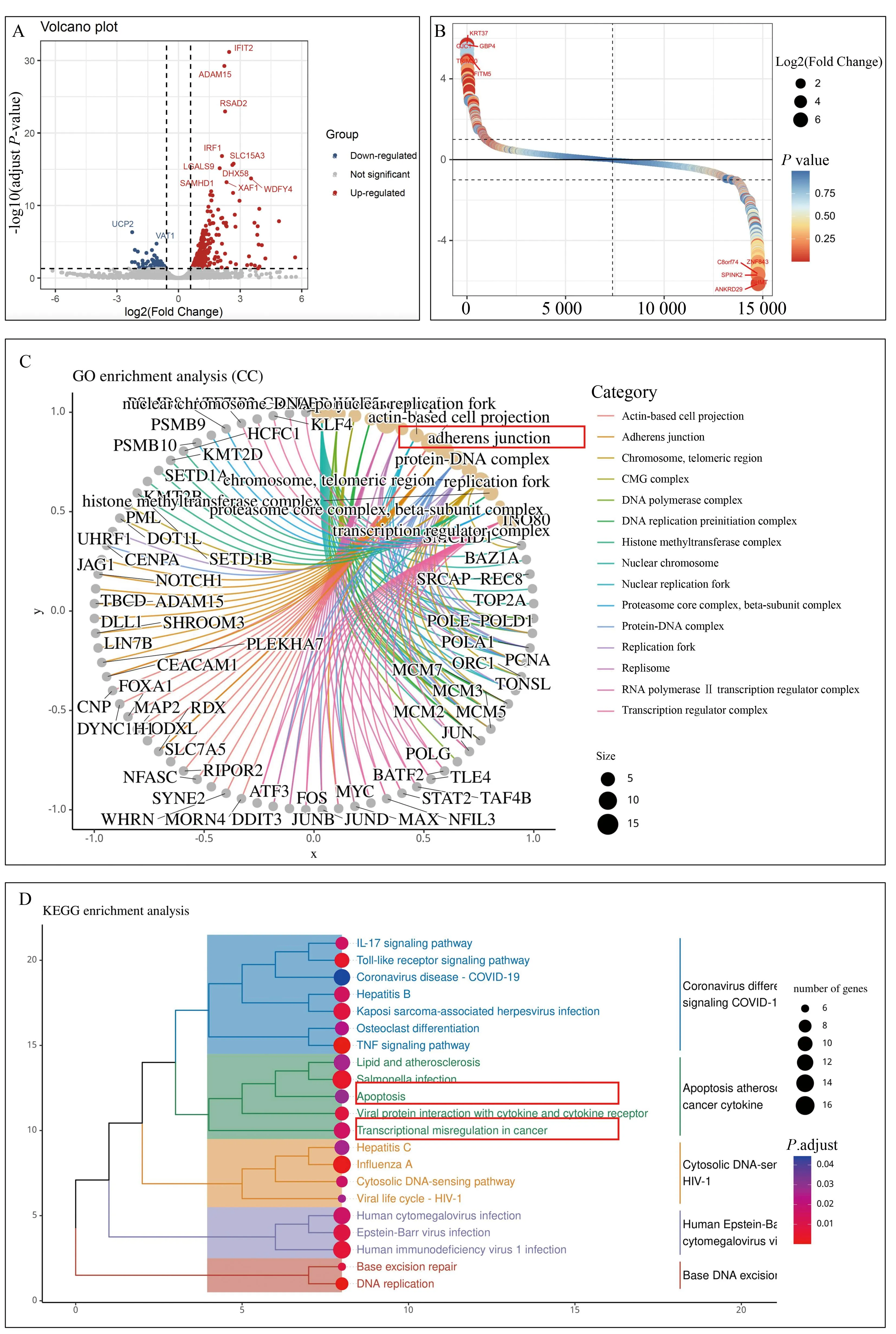
图3 ADAM15野生型和突变型细胞系转录组分析Fig.3 Transcriptome analysis of wild-type and mutant ADAM15 cell lines
GO分析显示,差异基因群分别富集在185条生物学过程(biological process,BP)、29条分子功能(molecular function,MF)及22条细胞组分(cellular component,CC)相关通路。在CC的富集分析中,差异基因显著聚集在细胞黏附功能相关通路[Padj(FDR)=0.009 6],而BP分析显示主要富集在DNA复制转录活跃度(Padj(FDR)=0.000 32]及炎症反应[Padj(FDR)=0.003 9]等通路;MF方面显示主要富集在解旋酶活性[Padj(FDR)=0.000 62]、趋化因子活性[Padj(FDR)=0.002 8]等通路(图3C)。
KEGG分析结果显示,差异基因群主要在27个通路呈现显著富集,包括癌症转录失调[Padj(FDR)=0.012]以及细胞凋亡[Padj(FDR)=0.023]等(图3D)。
3 讨论
ADAM15基因作为ADAM家族中的一员,已经被证明在多种癌症中过表达,并与预后不良有关,已有研究[10-11]结果显示,异常表达的ADAM15可能影响结肠癌细胞的侵袭和黏附,而ADAM15基因的一些潜在功能性SNV可能影响其蛋白功能。
本研究首先选取已表现出侵袭表型的结肠癌患者的肿瘤组织和癌旁组织,通过外显子组测序进行了全面的遗传分析。检测并关注到ADAM15基因中的非同义SNV rs6427128。分析在TCGA数据库结肠癌癌数据中收录的26个SNV在ADAM15基因上的位置分布可以发现,虽然包括了氨基酸链249位置的p. F249L及X249_splice在内的8个位于已知重要功能结构域内的变异,但更多的变异是如本研究聚焦的rs6427128一样,分布在各个重要功能结构域周边,这些变异对ADAM15基因功能的影响需要通过更有针对性地设计及更细致的实验方法重现和解析。因此,本研究揭示的位于重复脯氨酸前体肽和金属蛋白酶结构域之间的rs6427128对细胞表型的影响为此类研究提供了具体实例及有益提示。
本研究显示,野生型ADAM15具有增强细胞黏附和细胞侵袭的能力,而携带ADAM15基因非同义SNV rs6427128,呈现了更强的促进肿瘤细胞黏附的能力,尽管这可能会牺牲它的一些促侵袭能力。虽然已有文献[12]报道在人膀胱癌异种移植模型中,与对照组相比,敲除ADAM15可抑制45%肿瘤生长。但本研究结果显示,过表达野生型或突变型ADAM15,均未显现增加细胞增殖能力,提示结肠癌中过表达ADAM15对细胞增殖的影响有限。
癌细胞与肿瘤微环境之间的相互作用影响肿瘤的进展及其对治疗的反应。ADAMs家族的重要功能之一,即参与水解及释放肿瘤微环境中的可溶性因子和信号受体。研究[13]表明,在肝细胞癌组织中,ADAM15高表达组的通路富集在细胞凋亡、细胞黏附通路。数字空间蛋白质检测技术分析野生型和ADAM15敲除的小鼠结肠癌细胞系研究提示,ADAM15敲除可能通过促进免疫细胞向肿瘤组织的浸润,进而增加肿瘤细胞的凋亡[14]。rs6427128 SNV可能通过影响肿瘤细胞的黏附能力,影响了结肠癌细胞与微环境中其他细胞及因子的互作,参与调节了肿瘤微环境的改变。细胞转录组学分析也显示,野生型及突变型ADAM15过表达HCT-8细胞的差异表达基因,除了主要富集在DNA复制转录、细胞凋亡以及细胞黏附等肿瘤相关重要的信号通路,也在炎症反应相关通路显著富集。提示ADAM15基因的非同义SNV可能通过影响ADAM15的功能,参与了肿瘤微环境的调节,影响结肠癌的进展。
然而,需要指出的是,本研究还存在一些不足。首先,研究样本量相对较小,未来需要更大规模的样本研究来验证该发现。第二,虽然本研究选取了具有侵袭表型的结肠癌患者肿瘤样本进行WES,并检出了rs6427128位点,但细胞功能实验结果表明,与野生型相比,rs6427128可能在结肠癌的黏附中发挥了重要作用,但不具备对肿瘤侵袭能力的促进作用,这些结果也说明肿瘤的发生发展是非常复杂的,其在体的侵袭表型受多基因、多信号通路,以及细胞间相互作用、肿瘤微环境、免疫内生态等多种因素共同调控。rs6427128的影响可能在特定的条件下才能显现,而体外的细胞实验难以完全模拟肿瘤微环境。此外,在结肠癌遗传影响的研究方面,除了如MLH1、MSH2等一系列错配修复基因导致的遗传性非聚集性多脏器癌症综合征(Lynch综合征)[15]外,更多的基因通过多基因致病的模式,以“微效基因”的方式,影响结肠癌的进展。因此,未来的研究需要更多地关注到类似ADAM15基因rs6427128在结肠癌整体疾病研究中的潜在价值。
本研究以具有侵袭表型的结肠癌患者的肿瘤样本入手,从遗传变异的角度出发,提供了有关ADAM15基因非同义SNV在结肠癌中的作用机制的初步线索。ADAM15基因及其SNV rs6427128显著促进了结肠癌细胞的黏附和侵袭能力;ADAM15 rs6427128可能通过促进结肠癌细胞黏附,参与调节肿瘤微环境重塑,影响结肠癌的进展。未来的研究需要更多地关注到类似ADAM15基因rs6427128这样的“微效基因”在结肠癌整体疾病研究中的潜在价值。以期为结肠癌患者的个体化诊断和治疗提供更多的选择,以改善结肠癌患者预后。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明王晶:实验数据获取、分析,论文撰写;贺礼兵:实验数据获取、分析;张国燕:数据分析;刘筱涵:实验数据获取;程杉:研究命题的提出、设计。
