草莓茎尖组培繁育体系优化及SRAP遗传稳定性检验
2023-12-19王培李军见王高奇耿腾飞
王培,李军见,王高奇,耿腾飞
(西安市农业科学研究所,西安 710061)
0 引言
草莓病毒病在世界各地分布广泛,目前已报道的可侵染草莓的病毒有20 多种,草莓受侵染后,主要表现为叶片失绿、畸形、生长量减少、植株矮化、产量下降、品质变劣等现象,严重时可引起毁灭性灾害[1]。在中国危害严重的主要有草莓轻型黄边病毒(SMYEV)、草莓皱缩病毒(SCV)、草莓镶脉病毒(SVBV)和草莓斑驳病毒(SMoV)4 种草莓病毒,目前尚无有效化学药剂进行防治,最好的解决办法是采用脱毒种苗进行无病毒栽培[2]。因此,众多学者在草莓种苗脱毒方面进行了大量的研究,建立了以草莓茎尖组织培养为主体,结合热处理脱毒、超低温脱毒或化学试剂脱毒等方法为补充的多种脱毒体系[1,3-5]。随着草莓组培技术的发展,生产中组培苗开始大量使用,但有时会出现种性变异、花而不实等现象,针对该现象学者们也开展了草莓离体培养条件下遗传变异方面的研究。苗徐静等[6]通过对草莓试管苗DNA甲基化的MSAP检测发现,随继代次数的增加,组培苗DNA甲基化敏感多态性整体呈下降趋势。代雄伟[7]研究发现,整个组培过程黄毛草莓甲基化水平呈现降低和升高交替出现的动态变化趋势,这与组培过程中细胞功能分化、激素的使用以及外界环境的影响密切相关。刘振[8]研究发现,培养基中添加NAA 对草莓叶片分化的再生植株的遗传稳定性影响较大。王国平等[9]认为,在草莓离体培养过程中,生长调节剂的种类和含量、继代次数以及组织培养的时间都有可能会导致染色体数目或性状畸变的出现。赵密珍[10]认为,离体培养过程中加入的某些植物生长调节剂可能是引起草莓的组培苗茎数、花序数增多等现象的原因。Haque 等[11]认为,大量变异会对生产产生不利影响,如造成果实产量下降和畸形果的产生等。因此,草莓组培过程中,关注组培苗的遗传变异情况非常必要,但很少有对现有报道的草莓组培繁育体系进行遗传稳定性的检验。本研究采用草莓茎尖组织培养,设置植物生长调节剂浓度梯度、调整培养基基础配方,调查茎尖分化情况、增殖苗形态、增殖系数、生根苗叶片和根系等性状,比对组培前后植株DNA的相关序列扩增多态性(sequence- related amplified polymorphism,SRAP)标记条带的差异,旨在以组培苗遗传稳定和健壮为标准,优化草莓茎尖组培繁育体系,为草莓工厂化育苗提供技术依据。
1 材料与方法
1.1 材料
供试材料见表1。MS 和1/2MS 培养基购自阜阳曼林生物技术有限公司,琼脂、琼脂糖购自北京奥博星生物技术有限责任公司,蔗糖购自天津市科密欧化学试剂公司,硝酸钙(分析纯)购自天津市天力化学试剂有限公司,6-BA、NAA购自Sigma公司,快捷型植物基因组DNA 提取系统(DP321)、2×Taq PCR Mix(KT201)购自天根生化科技有限公司。引物由生工生物工程(上海)股份有限公司合成。组培和SRAP遗传稳定性检验试验于2021年11月—2022年11月在西安市现代农业展示中心组培及分子实验室进行。

表1 试验材料
1.2 试验方法
1.2.1 组培方法
(1)取样。在设施内,剪取草莓植株上生长充实、小叶尚未展开且带有未粘泥土顶芽的匍匐茎(茎粗2~4 mm、长约10~15 cm),将匍匐茎装入塑料袋并密封,放入冰箱4℃冷藏备用。
(2)培养条件。培养基以MS 或1/2MS 为基础培养基,琼脂5.2 g/L,蔗糖30 g/L,根据不同培养阶段加入不同种类和浓度的植物生长调节剂以及硝酸钙。培养基pH 5.8,121℃高压蒸汽灭菌20 min。培养室温度(25±2)℃,相对湿度45%~60%,光照强度2000~3000 lx,光照时长12 h/d。
(3)外植体处理。剪取草莓匍匐茎顶端顶芽,先用加入洗衣粉或洗洁精的水溶液震荡浸泡5 min,再用自来水流水冲洗30 min。之后在超净工作台上,用75%酒精表面消毒0.5~1.0 min,无菌水冲洗3 遍,0.20% HgCl2浸泡8~11 min,无菌水冲洗3 遍,放入无菌水中待用。
(4)初代培养。设计正交试验,在MS基础培养基中,添加不同浓度的植物生长调节剂,设置15 个处理(表2)。每个处理每个品种接种10 瓶,每瓶1 个茎尖。在体式显微镜下,切取0.1~0.3 mm已消毒的茎尖生长点,接种在初代培养基上,培养30 d。
(5)增殖培养。设计单一变量试验,在MS基础培养基中,添加不同浓度的6-BA,设置3 个处理(表3)。每个处理每个品种接种10瓶,每瓶接种个体形态大小近乎一致的无菌单芽5 个。接种单芽后,30 d 转接1次,培养60 d。
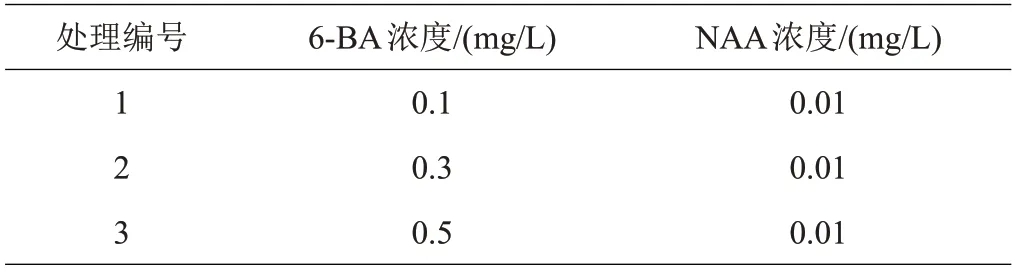
表3 草莓增殖培养单一变量试验处理
(6)生根培养。设计单一变量试验,将增殖苗接种到MS(处理1)和1/2MS+硝酸钙0.45 g/L(处理2)2 种培养基中进行生根培养。每个处理每个品种各10瓶,每瓶接种5 株个体形态完好、株高和大小近乎一致的无根或剪根幼苗,培养25~30 d。
(7)试验调查和数据统计。初代培养中,不以品种分类,观察所有茎尖的分化情况。增殖和生根培养中,每个品种随机取10 个样本,调查增殖形态和系数、生根植株的株高、叶片数、根长、根系条数。株高是指草莓植株中最高叶片距离植株基部的高度。统计增殖系数时,若出现芽块,与单芽等量大小的芽块视为1个单芽。采用Excel 2003 和SAS V8 统计软件进行数据处理和分析。
1.2.2 遗传稳定性检验方法
(1)引物合成。设计SRAP标记引物(表4)[12-13]。

表4 SRAP标记引物
(2)DNA 提取及检测。使用快捷型植物基因组DNA 提取系统(DP321)提取供试材料组培前、后植株的第3 片展开叶DNA,使用核酸分析仪Nano Drop2000检测DNA浓度和纯度。
(3)SRAP-PCR 检测。采用25 μL 的扩增体系:2×Taq PCR Mix 12.5 μL;正反引物各1 μL;DNA 模板<1000 ng;加ddH2O至25 μL。扩增条件为:94℃预变性5 min;94℃变性1 min,35℃退火1 min,72℃延伸1 min,5 个循环;94℃变性1 min,50℃退火1 min,72℃延伸1 min,35个循环;72℃延伸10 min。2%琼脂糖凝胶电泳,凝胶成像仪照相观察。
(4)数据统计。根据琼脂糖凝胶电泳结果人工读带,以相同迁移位置上有带记为“1”,无带或缺失、模糊不清条带记为“0”,建立0/1数据矩阵。
2 结果与分析
2.1 茎尖组培
2.1.1 初代培养经过5 d初代培养后,茎尖生长点逐渐变绿萌动,15 d 出现新芽和愈伤组织的分化。在不同处理下草莓茎尖分化存在明显差异(表5)。比较不同处理下茎尖分化情况,当NAA浓度≥0.05 mg/L时,会出现愈伤组织和玻璃化现象,也由此可推知,相比于6-BA,NAA 浓度的增加更易产生愈伤组织和玻璃化现象。处理1 添加的植物生长调节剂浓度最低,茎尖分化最好,30 d 内每个茎尖平均分化出2 个健壮芽且基部没有愈伤组织附着。适合草莓茎尖初代培养的培养基为MS+6-BA 0.5 mg/L+NAA 0.01 mg/L。

表5 不同处理对草莓初代培养茎尖分化比例的影响(接种后30 d) %
2.1.2 增殖培养在不同处理下,草莓初代单芽增殖情况存在明显差异(表6)。处理1 的2 个品种,虽然以幼苗为增殖形态的植株达到93%以上,没有出现愈伤组织和玻璃化现象,但植株生长势弱,增殖系数较低;处理3的2个品种,虽然增殖系数适合,但出现大量的愈伤组织和玻璃化现象;处理2的2个品种,增殖形态以幼苗为主,苗健壮,基部会产生极少量的愈伤组织,且增殖系数最大。综合考虑植株形态、增殖系数、植株健壮程度、愈伤组织和玻璃化出现情况等方面,适合草莓增殖培养的培养基为MS+ 6-BA 0.3 mg/L+ NAA 0.01 mg/L。
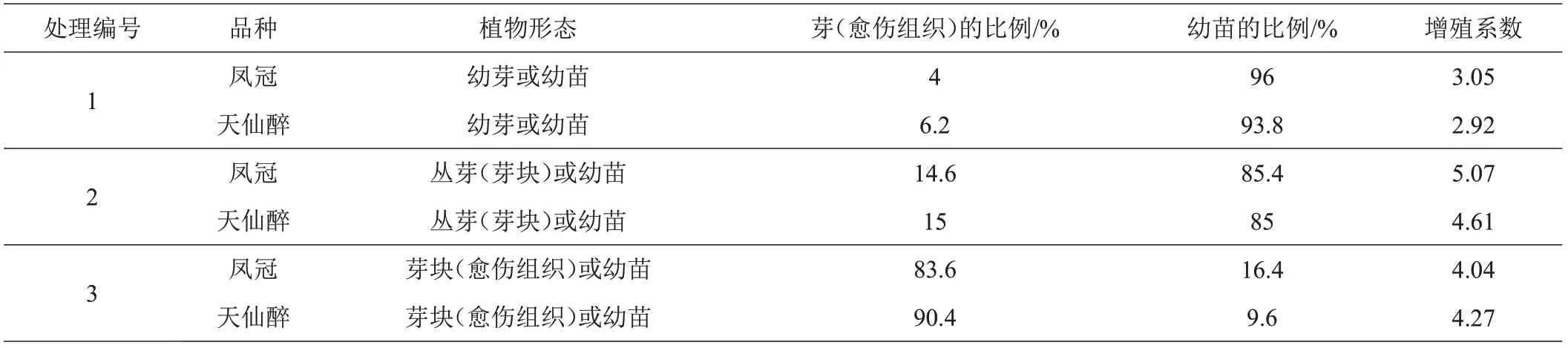
表6 不同处理对草莓增殖分化的影响
2.1.3 生根培养在不同处理下,2个品种的株高、叶片数、根数、根系长度存在显著差异(表7)。其中,2个品种的株高、根数、根系长度均是处理2显著大于处理1;但‘凤冠’处理1的叶片数显著大于处理2,‘天仙醉’处理2 的叶片数显著大于处理1。综合考虑植株株高和根系发育情况,1/2MS+硝酸钙0.45 g/L 的培养基更加适合生根培养。同时,‘凤冠’在2 种处理下变化相对较小,且叶片数在MS培养基中更大,可能与品种自身较抗盐碱的特性有关。
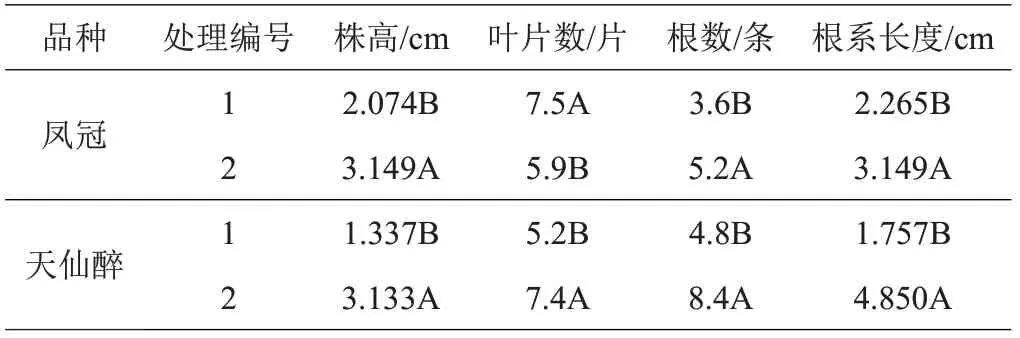
表7 不同处理对草莓生根培养的影响
2.2 组培苗基因稳定性检测
前期研究已对64 对SRAP 引物组合进行筛选,其中19对引物产生了清晰、稳定、多态性好的条带,共扩增出72条条带。将这19对引物对‘凤冠’和‘天仙醉’组培前后植株进行DNA-SRAP扩增,具体扩增结果见表8。‘凤冠’和‘天仙醉’组培前后72 个基因位点未发生变化,以上条带数据形成的DNA指纹没有差异。
3 结论
(1)在保证组培植株健壮的前提下,尽量减少植物生长调节剂添加的种类和浓度,降低了高变异率愈伤组织的产生。与前人研究相比[14-23],本研究培养基中使用的植物生长调节剂种类和浓度有所减少,初代培养基中6-BA浓度为0.5 mg/L、NAA浓度为0.01 mg/L,增殖培养基中6-BA浓度为0.3 mg/L、NAA浓度为0.01 mg/L,生根培养基中未添加植株生长调节剂。初代培养基中NAA 浓度达到及超过0.05 mg/L 将影响植株分化,会出现大量的愈伤组织和玻璃化现象;增殖培养基6-BA浓度低有助于分化出较多幼苗,这些结论与李晓亮等[21]的研究较一致。生根培养基中,不添加植株生长调节剂可以有效提高植株健壮程度,在生根的同时完成复壮;使用1/2MS 培养基,降低培养基的盐分,能够有效促进植株生根,结合生产中的表现,品种越不耐盐碱,在1/2MS 培养基中长势越好,但需要注意的是,1/2MS 培养基需额外添加硝酸钙,否则会在生根培养后期出现新叶褐变坏死的现象。
(2)控制继代次数和增殖系数,减少组培时长,避免植物生长调节剂在植株体内过度累积,降低变异风险。本研究将继代次数控制在2代、增殖系数控制在5以下,有植物生长调节剂使用的时间为3个月,这些结论与胡盼盼等[24]的总结较一致。虽然使用该方法得到组培苗数量少,但组培苗质量好,加之优质组培苗本身生长势旺盛,可以通过在防虫网室中进行匍匐茎快速繁殖增加种苗数量。
(3)组培苗SRAP基因稳定性检测,证明草莓茎尖组培扩繁体系的可靠性。前人研究表明,SRAP 分子标记由于具有简单、高效、高共显性、重复性、易测序等优点,已应用在多种作物的种质资源鉴定评价中[25]。刘振[8]采用SRAP分子标记技术,检测不同途径获得的草莓植株的遗传稳定性,检测子代与母本的相似程度,为离体快繁和种质资源保存提供了技术依据。本研究将考察组培苗基因稳定性作为茎尖组培体系是否合理的一项指标,采用SRAP分子标记扩增得到的72 个基因位点不存在变异,证明组培苗种性稳定。
4 讨论
研究以‘凤冠’和‘天仙醉’草莓为材料,这2 个品种在西安地区设施栽培中表现出早熟性好、冬季连续结果能力强、果个大等优点,但随着种植年限的增加,也出现了不同程度的品种退化和产量下降现象,经分子检测证实这2个品种已有病毒侵染。虽然前人已建立‘红颜’[14-19]、‘白雪公主’[20]、‘甜查理’[14]、‘京藏香’[14]、‘鬼怒甘’[21]、‘石莓7 号’[22]、‘阿苏的小雪’[18]、‘童子一号’[23]等品种的茎尖组培体系,但未见有这2个品种组培方面的报道。值得注意的是,不同品种组培使用的植物生长调节剂种类及数量、继代次数和培养时间均不相同,即使是同一品种如‘红颜’茎尖组培体系也不尽相同,因此在进行大规模组培生产前,需要针对不同品种对组培体系进行调整和优化。
在建立草莓组培繁育体系时,要将保持品种种性、植株健壮、脱病脱毒作为标准,而不是一味追求增殖数量。在保持品种种性方面,可以使用ISSR、MSAP[6]、RAPD、SCAR[26]、SSR[27]、SRAP等技术进行基因稳定性检测,还可以进行田间栽培种性鉴定试验。只有证明组培苗未发生变异后,才可使用在生产中。组培苗进入栽培种植环节后,虽然已脱去了病毒和病菌,但并不意味着在种植过程中不会再染病,由于组培苗相对于常规苗生长势更旺盛,所以应当注意灰霉病、白粉病、蚜虫、螨虫等病虫害的防治。
然而,本研究在增殖培养过程中会出现占比约15%的丛芽,其基部产生极少量的愈伤组织,因此仍存在变异的可能,下一步研究中将进一步细分该培养阶段植物生长调节剂的浓度梯度,以期找到更加利于植株幼苗分化且兼顾植株健壮度和增殖系数的浓度。同时,在组培体系的遗传稳定性检验中,下一步研究中将扩大基因标记的数量,并结合组培苗田间种性鉴定,从基因和表型2个方面检验遗传稳定性。
