日周期光热干露胁迫对泰来草生理特性的影响
2023-12-19李照阳史云峰蔡嘉丽赵牧秋史志强罗慧珏韩秋影
李照阳, 史云峰, 蔡嘉丽, 赵牧秋, 史志强, 罗慧珏, 韩秋影
( 1. 海南热带海洋学院 崖州湾创新研究院, 海南 三亚 572022; 2. 海南省现代化海洋牧场工程研究中心, 海南 三亚 572022; 3. 海南省近岸海洋生态环境过程与碳汇重点实验室, 海南 三亚 572022 )
海草是世界范围内浅水潟湖、海岸及河口区的关键物种,以其为主要生物类群构建的海草床是海岸带重要的生态系统类型(蔡泽富等,2021)。海草床可为众多的海洋生物提供食物来源、栖息地和产卵场(Unsworth &Cullen, 2010),兼具产氧、调节营养、固碳、稳定沉积物和减少病原体(Duarte &Krause, 2017)等生态功能。据估算,全球海草床的生态服务价值不低于1.9万亿美元,对商业渔业的支持价值高达3 500美元·hm-2·a-1(Waycott et al., 2009)。然而,全球气候变化和人类活动导致的多种胁迫正在威胁海草床的健康,自1990年以来,海草分布面积以每年7%的速度下降,全球多达35%的海草床退化明显(Manassa et al., 2017)。
干露是指水生生物因离开水体而停留在非水介质中的状态,生物在干露条件下维持生命活动的时长称为露空时间(姜令绪等,2012)。受潮汐作用影响,主要分布于潮间带的海草床淹水和干露状态交替进行(Kim et al., 2016),如果干露发生于昼间,就会伴随高温、强光等多重胁迫的叠加作用。因此,潮汐引起的日周期性干露成为制约海草在潮间带分布的重要因素(Shafer et al., 2007)。董益等(2021)研究表明随着海草露空时间的延长,其叶片表面水分会大量蒸发,细胞内电解质浓度逐渐升高,致使细胞质膜结构变化,细胞内生物化学反应抗性增加。刘洪亮等(2014)研究表明长期干露会导致可用于海草光合作用的CO2浓度降低,光合与呼吸作用失衡,光系统Ⅰ与Ⅱ之间的电子传递被阻隔,最终造成海草叶片出现不可修复的损伤。Stapel等(1997)研究表明潮汐干露叠加强光和高温可能导致海草在短期内大量死亡,植株密度和覆盖率骤降。
泰来草(Thalassiahemprichii)是热带西太平洋和印度洋海草群落的优势种,以及海南岛东、南部海草床的主要建群种,通常会占据海岸带的高潮间带至中潮间带区域(陈石泉等,2020)。泰来草的分布面积和生物量通常会表现出显著的季节性差异,这可归因于光照、温度、水文条件、营养盐含量等环境因素的周期性波动(蔡泽富等,2017);潮汐干露可能是引起泰来草床结构和功能季节性差异的重要原因(Azevedo et al., 2016)。比如,在海南陵水的新村潟湖,分布在高潮间带的泰来草每次大潮过程的露空时间为2~3 h·d-1(Jiang et al., 2014),足以引起海草发生不可逆损伤。
尽管已有研究对泰来草一次性短期干露过程脱水率与光合活性的关系进行了探索(Jiang et al., 2014; Wuthirak et al., 2016),但针对周期性潮汐干露与强光和高温相叠加对其生长和生理特性影响的研究尚较缺乏。鉴于此,本研究以热带优势海草泰来草为对象,通过在日光温室内模拟高温和强光环境,探索日周期光热干露胁迫对泰来草生长和生理特征的影响,拟探讨:(1)日周期光热干露胁迫对泰来草的生长速率、光合生理、抗氧化活性及代谢物质含量的影响;(2)随露空时间的延长,日周期光热干露胁迫对泰来草生长和生理特性影响程度的变化;(3)泰来草承受日周期光热干露胁迫的极限时长。以期为深入了解泰来草在潮间带生境中的生长适应机制和季节分布规律,以及为受损泰来草床生态修复时的位置选择和管护技术开发提供理论依据和支撑。
1 材料与方法
1.1 材料
本研究所用泰来草于2021年7月低潮(潮高小于50 cm)时采自海南省三亚市小东海海区(109°29′48″ E、18°12′33″ N)。采样时泰来草茎枝密度为(1 354±123) ind·m-2、株高(10.5±1.2) cm、叶宽(0.75±0.04) cm。采集海草时连同10 cm厚沉积物一并取出。将采集的原状泰来草及沉积物置于水族箱(37 cm × 25 cm × 22 cm)中,去除死亡和衰老叶片以及健康叶片上的附生生物,添加海水至没过海草叶片,运回实验室并置于日光温室内暂养(2周)备用。期间使用小型造浪泵保持海水呈流动状态,每2 d更换一次海水。
1.2 试验设计
根据前期调查和预试验结果,结合Jiang等(2014)和Wuthirak等(2016)的研究,下列结论用于指导本研究的设计:海南三亚周边海域潮汐类型为不规则日潮,泰来草光热潮汐干露主要出现在14:00—17:00;泰来草连续日周期性干露时间一般不超过7 d,平均露空时间通常不超过2 h·d-1,光热条件下连续露空时间超过60 min可能引起不可逆损伤;泰来草干露复水12~24 h后,其最大光合效率(Fv/Fm)可趋于稳定。
共设置6个处理:CK(不进行露空处理)、PTD10(露空时间10 min·d-1)、PTD20(露空时间20 min·d-1)、PTD40(露空时间40 min·d-1)、PTD60(露空时间60 min·d-1)和PTD90(露空时间90 min·d-1)。试验在日光温室内开展,每处理重复3次。试验期间每天14:00将进行光热干露处理水族箱内的海水抽干,使泰来草叶片完全暴露于空气中。干露达到试验预设的露空时间后,立即对海草进行复水至没过所有海草叶片。光热干露处理连续进行7 d,最后一次干露复水24 h后开始对泰来草的各项生理和生化指标进行测定。
试验所用海水取自海南三亚附近海域。试验中使用小型造浪泵保持水族箱内海水缓慢流动,其间海水盐度为(31±2)‰,pH为8.08±0.04,溶解氧为(6.44±0.68) mg·L-1,NO3--N为(0.043±0.012) mg·L-1,NH4+-N为(0.026±0.009) mg·L-1,PO43--P为(0.012±0.003) mg·L-1。试验期间应用光温测量仪(HOBO-UA-64,美国)监测,并记录温室内的温度和光量子通量密度,频率为60 min·次-1。
1.3 生长速率、光合色素含量和叶绿素荧光参数测定
试验期间泰来草的生长速率采用针孔法测定(Zieman,1974)。选取泰来草成熟叶片,采用改进的80%丙酮浸提比色法(舒展等,2010),分别测定其叶绿素a、叶绿素b和总叶绿素含量,结果以每g鲜重的海草叶片所含有的光合色素mg数表示。
采用水下调制叶绿素荧光仪(DIVING-PAM-II,德国)测定泰来草叶片叶绿素荧光参数。每箱随机选取1株海草,对其第二幼叶中部进行测定。测定诱导曲线前将海草植株置于黑暗条件下暗适应20 min,开启测定程序后,由WinControl 3.0(Walz,德国)软件自动记录暗适应下的最小荧光(Fo)和最大荧光(Fm),参照Fang等(2020)的公式计算光系统Ⅱ(PS Ⅱ)的最大光合效率(Fv/Fm)、光化学淬灭系数(qP)、实际光化学量子效率(ΦPSⅡ)和表观光合电子传递速率(electron transport rate, ETR)。
1.4 抗氧化酶活性、非结构碳水化合物含量和次生代谢物质含量测定
每箱随机选取3~5株泰来草,将其分割为叶片和根两部分,并分别将所有叶片和根混合。取一部分新鲜叶片或根,分别测定其抗氧化酶[过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)]活性和丙二醛(MDA)含量;取另一部分置于60 ℃持续烘干48 h至恒重,粉碎后用于测定非结构碳水化合物(淀粉、可溶性糖)和次生代谢物质(总酚、总黄酮)含量。
泰来草叶片和根的POD、SOD、CAT酶活性及MDA含量采用试剂盒(南京建成生物工程研究所)测定,具体操作参照试剂盒说明书进行;非结构碳水化合物(淀粉、可溶性糖)含量测定参照Jiang等(2013)的方法;次生代谢物质(总酚、总黄酮)含量测定参照孙倩等(2019)的方法。
1.5 数据统计分析
每一时刻的温度和光量子通量密度采用7 d所采集数据的平均值表示。各光热干露处理数据以平均值±标准差表示;采用Microsoft Excel 2019和IBM SPSS Statistics 26.0进行数据统计分析和绘图。对数据进行正态性及方差齐性检验,如果不符合,则进行数据转换;不同处理之间的差异显著性采用单因素方差分析(one-way ANOVA,P<0.05),采用Duncan法进行多重比较。
2 结果与分析
2.1 温度和光量子通量密度
本研究开展时正值海南省夏季(7—8月)。试验期间天气晴朗,日光温室内的平均温度和光量子通量密度如图1所示,温度波动为27.5 ℃(6:00)~44.5 ℃(14:00),光量子通量密度为0~1 967 μmol·m-2·s-1(12:00)。每天14:00开始处理光热干露,此时日光温室内平均温度为44.5 ℃,平均光量子通量密度为1 682 μmol·m-2·s-1;各处理露空时间最长为90 min(PTD90),该处理每天光热干露结束时(15:30)温度接近41.0 ℃,光量子通量密度约为633 μmol·m-2·s-1。
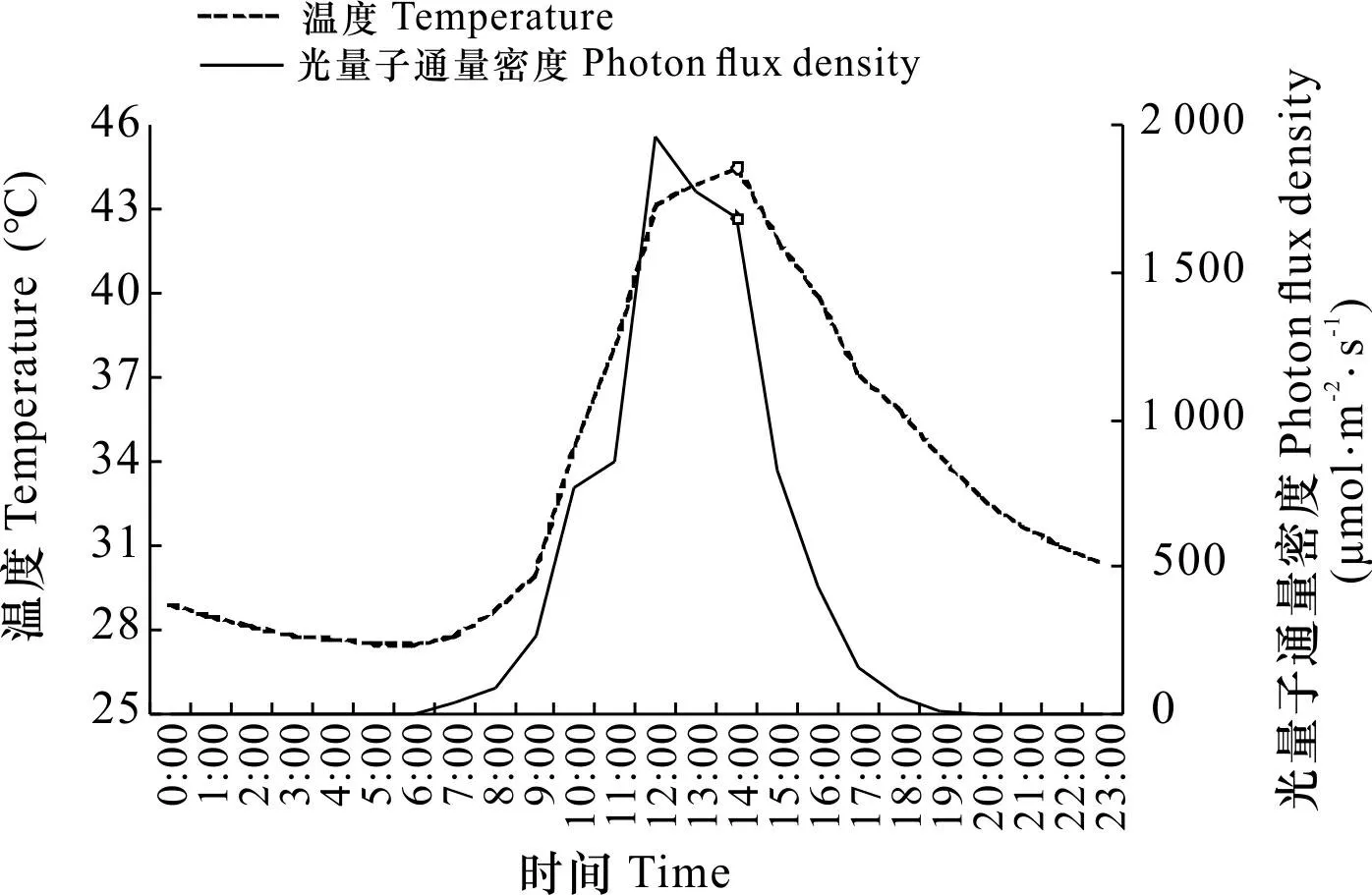
○表示光热干露开始时日光温室内的平均温度和光量子通量密度。○ indicates the average temperature and photon flux density in the greenhouse at the beginning of photothermal desiccation experiment.图 1 试验期间日光温室内的平均温度和光量子通量密度Fig. 1 Average temperature and photon flux density in greenhouse during experiment

图 2 试验结束时不同光热干露处理泰来草的叶片状态Fig. 2 Leaf states of different photothermal desiccation treatments at the end of experiment
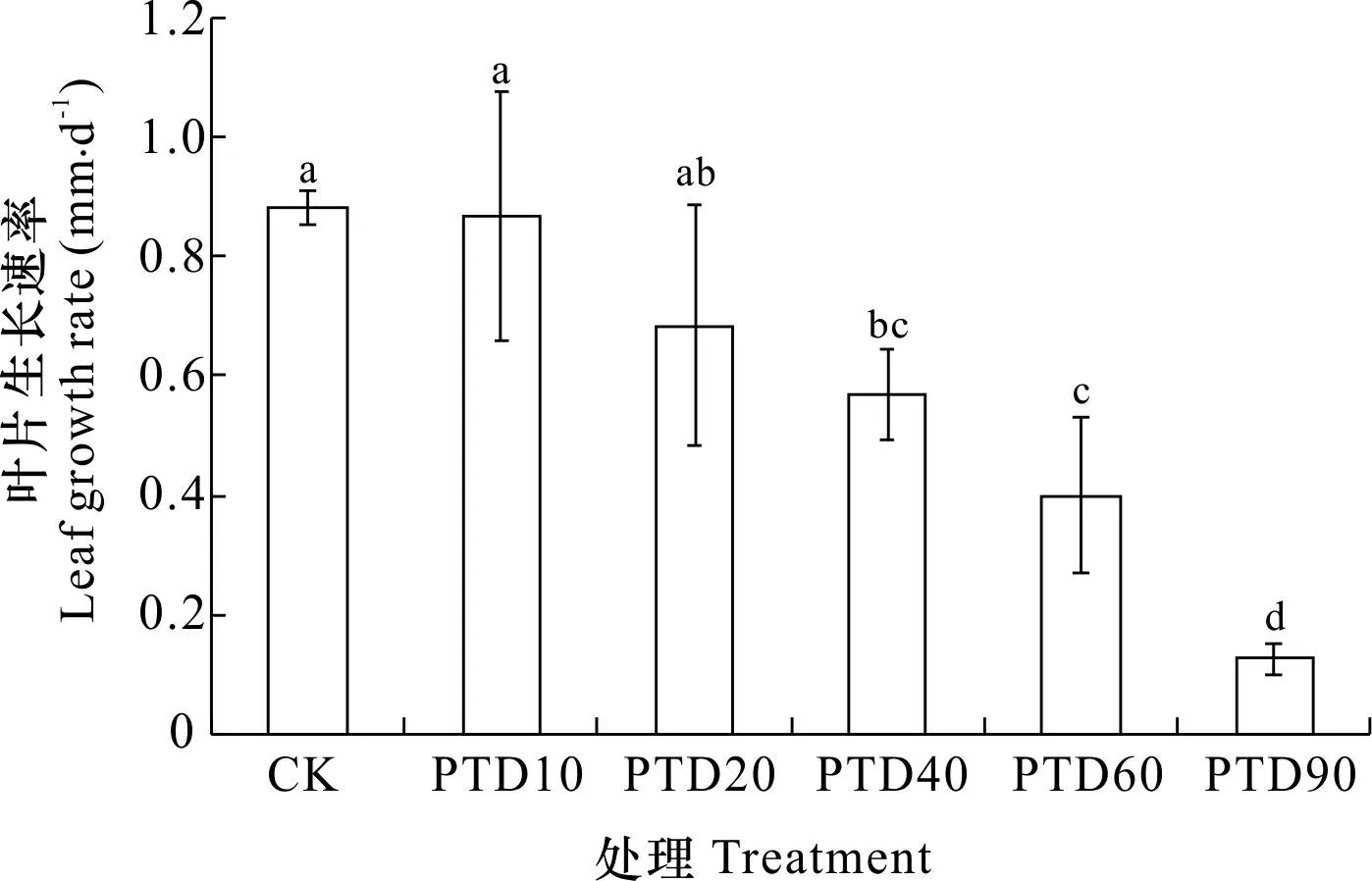
不同字母表示处理间差异显著 (P<0.05)。下同。Different letters indicate significant differences between treatments (P<0.05). The same below.图 3 不同光热干露处理泰来草的叶片生长速率Fig. 3 Leaf growth rates of Thalassia hemprichii for different photothermal desiccation treatments
2.2 泰来草叶片状态和生长速率
试验结束时,不同光热干露处理泰来草叶片展示出不同的状态(图2)。连续7 d每天10 min的光热干露处理(PTD10),泰来草叶片与CK比较未发生明显变化。当露空时间达到20 min·d-1(PTD20)时,叶片上缘开始出现少许褐色损伤斑,但并不严重;露空40 min·d-1(PTD40)时,有近1/3的叶片转为黄褐色;当露空≥60 min·d-1(PTD60和PTD90)时,整个海草叶片均呈褐色,并且PTD90处理叶片已从上缘开始干枯。可见,随露空时间的延长,日周期光热干露对泰来草叶片的损伤程度随之加重。
如图3所示,CK处理泰来草叶片生长速率为(0.88±0.03) mm·d-1;与CK相比,PTD10和PTD20处理叶片生长速率未呈现显著性差异(P>0.05)。当露空时间≥40 min·d-1时,海草叶片生长速率显著低于CK(P<0.05),PTD40、PTD60和PTD90处理叶片生长速率分别为CK的65%、45%和15%。由此可见,较短的露空时间(≤20 min·d-1)对泰来草叶片生长速率无影响,而长时间的光热干露(≥40 min·d-1)会显著抑制泰来草叶片的生长(P<0.05),并随露空时间延长抑制效应增强。
2.3 泰来草叶片光合色素含量和叶绿素荧光参数
如图4所示,随露空时间的延长,泰来草叶片光合色素(叶绿素a、叶绿素b和总叶绿素)含量及叶绿素a/叶绿素b均呈降低趋势。与CK相比,PTD10处理的光合色素含量及叶绿素a/叶绿素b均无显著性差异(P>0.05)。当露空时间≥20 min·d-1时,光合色素含量与CK比较显著降低(P<0.05),但叶绿素a的降低程度明显高于叶绿素b,导致不同处理的叶绿素a/叶绿素b随露空时间的延长而降低。
由表1可知,不同光热干露处理泰来草叶片Fo无显著性差异(P>0.05),其他叶绿素荧光参数(Fm、Fv/Fm、qP、ΦPS Ⅱ和ETR)均随露空时间延长而降低。PTD10处理的所有叶绿素荧光参数与CK比较均未呈现显著性差异(P>0.05);露空时间≥20 min·d-1处理的Fm和Fv/Fm显著低于CK(P<0.05);露空时间≥40 min·d-1处理的ΦPSⅡ和ETR显著低于CK(P<0.05);仅有PTD90处理的qP显著低于CK(P<0.05)。
2.4 泰来草叶片和根抗氧化酶活性和MDA含量
如图5所示,叶片和根的POD、SOD和CAT酶活性及MDA含量总体上随露空时间的延长而升高。除根的POD外,PTD10处理海草叶片和根的抗氧化酶活性和MDA含量与CK比较均无显著性差异(P>0.05)。随露空时间的延长,叶和根的POD、CAT酶活性以及叶的MDA含量增加迅速;而叶和根的SOD酶活性以及根的MDA含量在露空时间≥20 min·d-1时几乎不再发生显著性变化(P>0.05)。
2.5 泰来草叶片和根非结构碳水化合物和次生代谢物质含量
如图6所示,随露空时间的延长,叶片和根的可溶性糖含量呈升高趋势,根的淀粉含量呈下降趋势,叶片的淀粉、总酚和总黄酮含量呈先升高后降低趋势,而根的总酚和总黄酮含量在各处理间未呈现显著性差异(P>0.05)。与CK比较,PTD10处理泰来草仅叶片的总酚含量显著升高(P<0.05),其他指标均未出现显著性差异(P>0.05)。
3 讨论
海水的潮汐运动,使海草等生长在潮间带的植物通常经历周期性干露。在缺水、高盐和热应激等综合作用下,干露过程可能会对海草的生理、生长和繁殖产生影响,进而影响其在潮间带的分布状况(Clavier et al., 2011)。干露过程的持续时间是影响海草生长和生物量积累的主要因素之一(Collier & Waycott, 2014)。Unsworth等(2012)研究发现,海菖蒲草床地上部生物量和生长速率下降明显,并与潮汐干露存在显著相关性。Suykerbuyk等(2018)研究证实,随干露时间的延长,诺氏鳗草(Zosteranoltii)的生长速率降低,导致地上生物量减少。本研究结果表明,日周期光热干露胁迫对泰来草的生长存在负面影响。在温度超过40 ℃、光量子通量密度超过800 μmol·m-2·s-1的夏季午后,露空40 min·d-1泰来草的生长速率降低了35%,而当露空时间达到90 min·d-1时,海草的生长速率则为CK的15%。本研究是在充分调查三亚周边海域泰来草的潮汐干露状况后设计的,即该海区夏季泰来草的潮汐干露主要出现在午后,其露空时间最长达2 h·d-1。尽管干露发生时的实际温度可能稍低于本研究所采用的日光温室,但自然条件可能具有更高的光量子通量密度和更快的水分蒸发损失。可以推测,在夏季午后的光热干露过程中,三亚海区潮间带泰来草的生长速率可能受到极大抑制,进而影响其生物量和分布状况。
本研究结果显示,随泰来草露空时间的延长,叶片颜色由绿色逐渐变为褐色,说明海草叶片细胞内的叶绿体已遭受严重破坏(董益等,2021)。光合色素含量测定结果表明,当露空时间超过20 min·d-1时,泰来草叶片的叶绿素含量显著低于对照。随着露空时间的延长, 泰来草的生长速率和叶绿素荧光参数降低,抗氧化酶活性和MDA含量升高。这充分说明海草体内活性氧的产生与清除平衡状态被打破,累积的活性氧导致海草叶片细胞损伤和叶绿素含量的降低(Seddon &Cheshire, 2001)。林植芳等(1984)认为光合色素中叶绿素a对环境变化胁迫的反应比叶绿素b更敏感,胁迫发生时大量积聚的活性氧可能特异性地破坏叶绿素a,而对叶绿素b的破坏作用较低,最终可能导致叶绿素a/叶绿素b降低。本研究结果支持这一结论。因此,考虑通过泰来草叶绿素a/叶绿素b下降的程度来评价其受光热干露胁迫的程度。
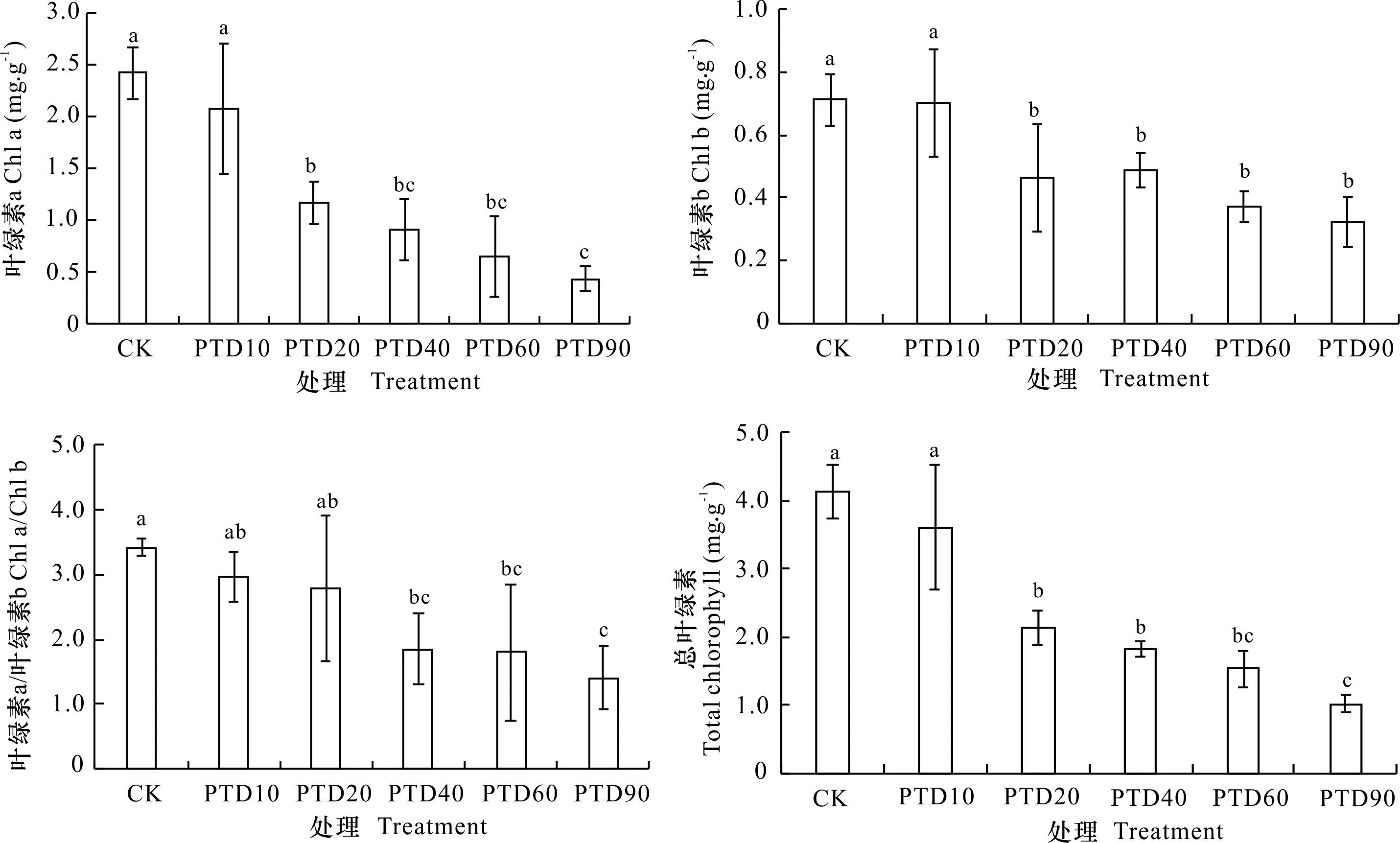
图 4 不同光热干露处理泰来草叶片的光合色素含量Fig. 4 Photosynthetic pigment contents of Thalassia hemprichii leaves for different photothermal desiccation treatments
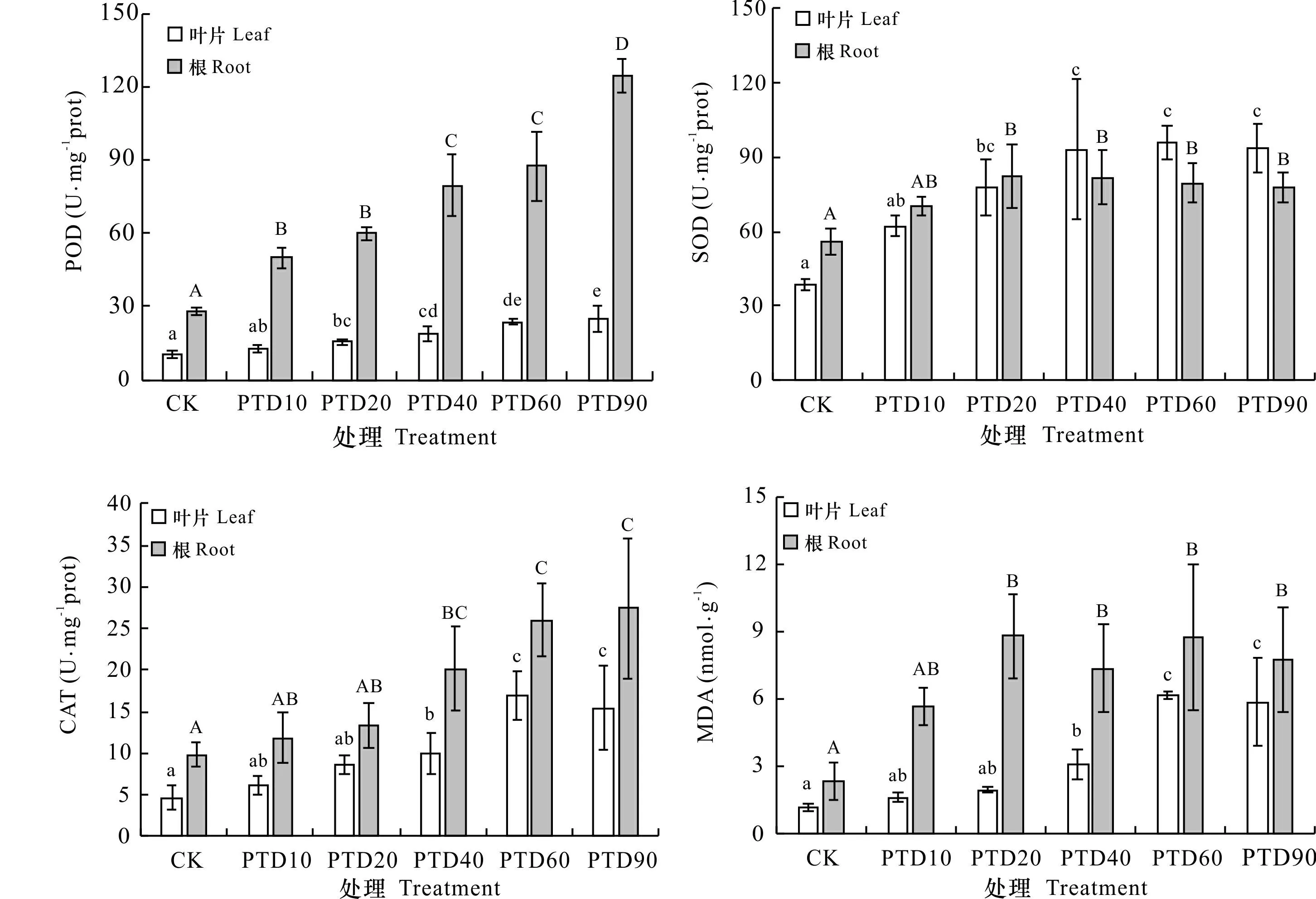
不同小写字母表示不同处理泰来草叶片间存在显著性差异 (P<0.05); 不同大写字母表示不同处理泰来草根间存在显著性差异 (P<0.05)。下同。Different lowercase letters indicate significant differences between treatments for the leaves of Thalassia hemprichii (P<0.05); different uppercase letters indicate significant differences between treatments for the roots of T. hemprichii (P<0.05). The same below.图 5 不同光热干露处理泰来草的抗氧化酶活性和MDA含量Fig. 5 Antioxidant enzyme activities and MDA contents of Thalassia hemprichii for different photothermal desiccation treatments
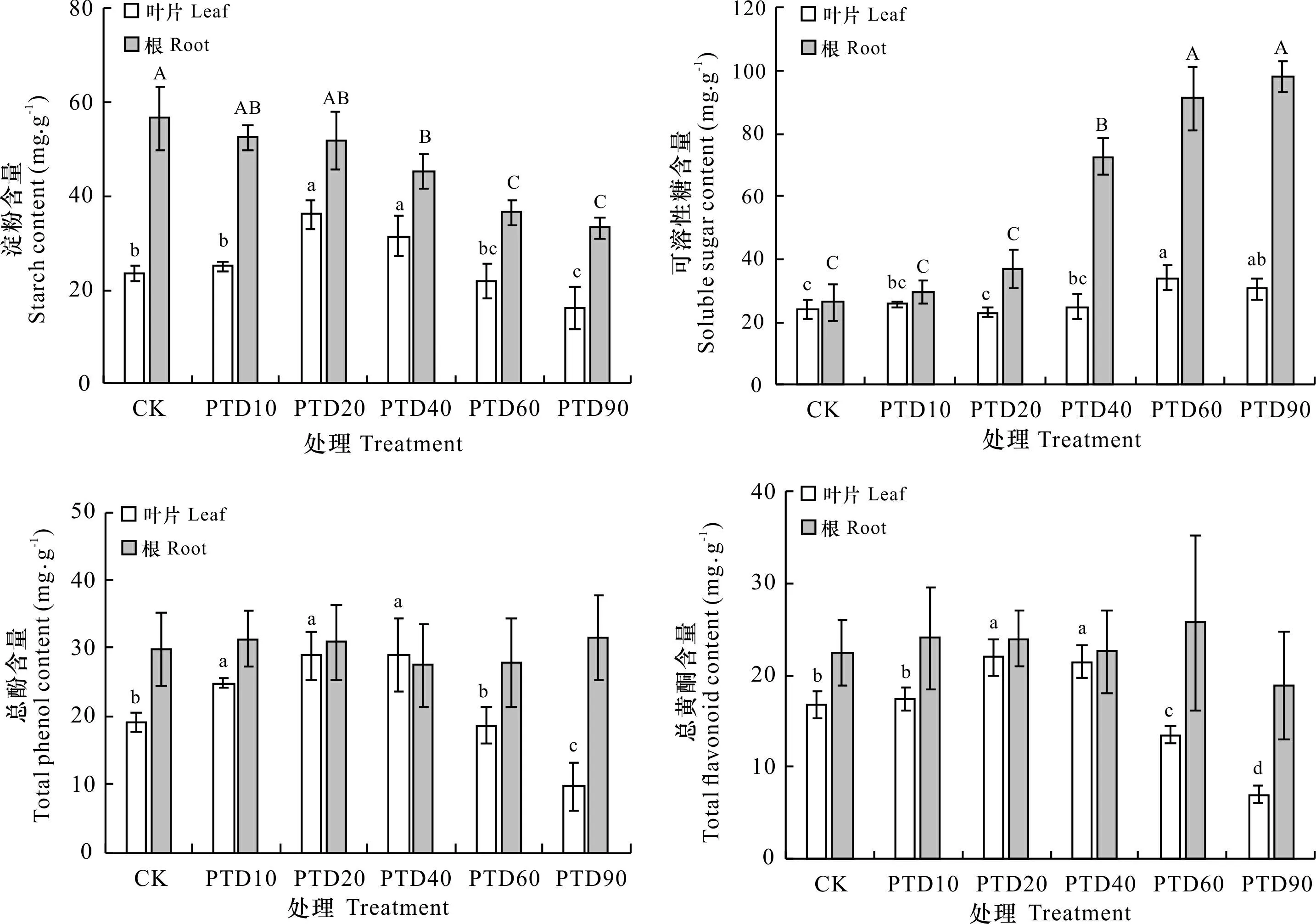
图 6 不同光热干露处理泰来草的非结构碳水化合物和次生代谢物质含量Fig. 6 Nonstructural carbohydrate and secondary metabolite content of Thalassia hemprichii for different photothermal desiccation treatments
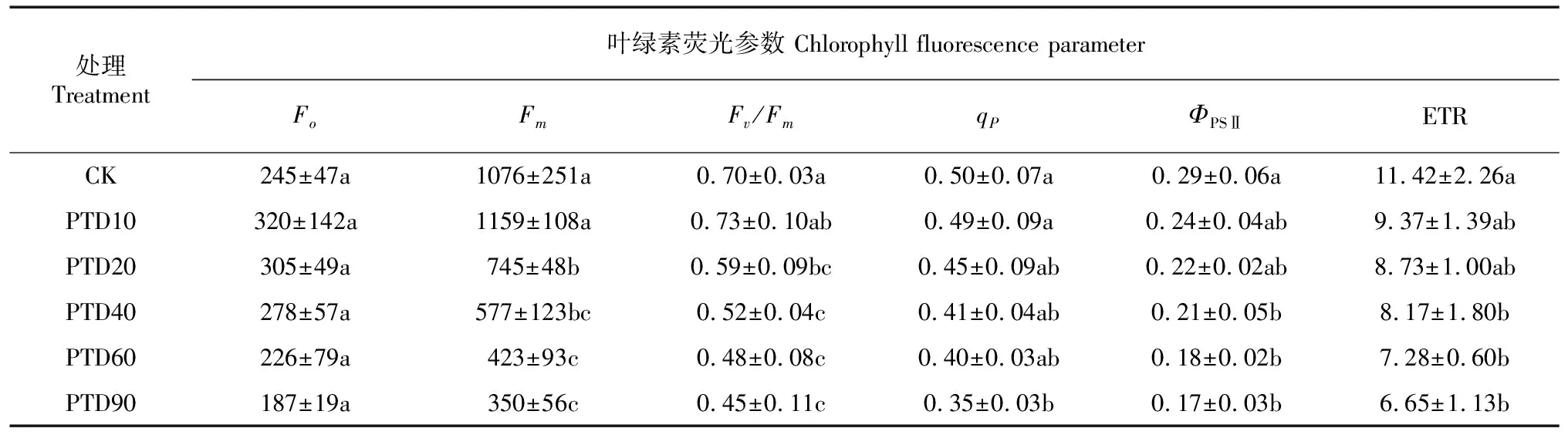
表 1 不同光热干露处理泰来草叶片的叶绿素荧光参数Table 1 Chlorophyll fluorescence parameters of Thalassia hemprichii leaves for different photothermal desiccation treatments
本研究各光热干露胁迫处理随露空时间的延长,除Fo外的所有叶绿素荧光参数(Fm、Fv/Fm、qP、ΦPSⅡ和ETR)均降低,这表明随露空时间的延长,泰来草叶片的光能利用率、光合作用的能量转换和PS Ⅱ活性等都随露空时间的延长而降低。这是细胞脱水导致内部电解质浓度激增,损伤了植物叶片类囊体及叶绿素-蛋白质复合物的结构(Malea et al., 2019),进而影响叶绿素荧光参数(Wuthirak et al., 2016; Papathanasiou et al., 2020)。植物的最大光合效率(Fv/Fm)常被用于衡量各种环境胁迫下叶绿体PS Ⅱ活性的高低,通常逆境条件下该参数会明显降低(张景平和黄小平,2009),Fv/Fm<0.44则意味着PS Ⅱ反应中心完全失去活性(Schansker &Rensen, 1999)。本研究露空时间最长的PTD90处理在试验结束时泰来草叶片的Fv/Fm为0.45,表明其已接近完全失活,即在试验设定条件下,连续7 d每天90 min的露空已是泰来草所能承受光热干露胁迫的上限。
本研究中,无论是泰来草的叶片还是根,其MDA含量均随露空时间的延长而升高,说明经光热干露胁迫处理后的泰来草,其叶片细胞膜可能遭受了不同程度的伤害,并且伤害随露空时间的延长而增强(于飞等,2014)。本研究结果表明,干露胁迫使泰来草叶片和根的POD、SOD、CAT酶表现出较高的活性且随露空时间的延长而快速升高,这是其体内活性氧和自由基升高所诱导的结果(Brierley &Kingsford, 2009; Rakhmad et al., 2019)。干露胁迫发生时,尽管泰来草抗氧化酶活性显著升高(P<0.05),但在逆境条件下植物体内生成的活性氧仍超过抗氧化酶体系的清除能力,使部分未能清除的活性氧引起膜脂过氧化,最终表现为MDA含量升高,叶片光合色素含量降低且由绿色变为褐色,叶绿素荧光参数下降,生长速率受到抑制。本研究结果还表明,随露空时间的延长,泰来草不同类型抗氧化酶活性变化趋势表现不同,POD和CAT随露空时间的延长急剧升高,而SOD在露空超过20 min·d-1后几乎不再发生变化。导致这种现象的原因可能是植物体内不同类型过氧化物和自由基产量不均衡,使其诱导的不同类型抗氧化酶活性变化趋势出现差异(魏爱丽和王志敏, 2004)。
本研究中,随露空时间的延长,泰来草叶片淀粉含量呈先升高后降低趋势,其原因可能是中等时长(20~40 min·d-1)的光热干露影响了海草对氮营养的吸收,使叶片蛋白质合成受阻,进而导致碳水化合物含量的相对升高(Clabby &Osborne, 1997;孙倩等,2019)。与叶片不同,泰来草根的淀粉含量则随露空时间的延长呈降低趋势。一方面,随露空时间的延长,泰来草光合效率降低,合成且转移储存至根部的淀粉量降低(江志坚等,2012);另一方面,海草抵御外部环境胁迫以及修复受损组织需要消耗更多物质和能量,可能导致根中储存的淀粉作为碳源和能源被大量利用,使其含量降低。与淀粉不同,无论是叶片还是根中的可溶性糖含量均随露空时间的延长而升高,其原因可能是植物细胞通过合成大量的可溶性糖作为渗透调节物质来降低细胞内水势,维持较高渗透压以抵制不良环境,从而保证细胞的正常生理功能(Koch et al., 2007; Touchette, 2007)。
泰来草叶片中的总酚和总黄酮含量均随露空时间的延长呈先升高后降低趋势。其原因可能是露空时间较短(≤20 min·d-1)时,光合作用受抑制尚不严重,植物体能够按照胁迫作用的强弱诱导生成次生代谢物质(Trevathan-Tackett et al., 2015);干露胁迫较强(≥40 min·d-1)时,光合速率显著降低,植物所生产的有限有机物质主要用于合成可溶性糖等渗透调节物质,次生代谢物质的合成因受组织内可利用碳、氮等物质的制约而无法大量合成。随干露胁迫的增强,泰来草叶片内总酚和总黄酮含量与淀粉含量的变化趋势基本一致,印证了植物体内含碳次生代谢物质与可利用碳水化合物含量呈正相关的观点(Stamp, 2003)。
本研究结果表明,热带地区夏季午后的光热干露时长可能是限制泰来草分布上限的重要因素,连续1周每天露空20 min以上可显著损伤海草的生理机能,并可能对海草床生物量、生产力及分布密度等产生影响,进而限制其生态功能的发挥。在进行海草床的生态修复时,应充分考虑修复区所处潮位,避免潮位过低所引起的光照限制,以及潮位过高所导致的光热干露胁迫。修复区位于较高潮位、海草在低潮周期光热干露时间较长时,应适当采取遮光、降温措施,确保海草免受不可逆损伤。
综上所述,日周期光热干露胁迫对泰来草的生理特性具有重要影响,露空时间的长短对干露胁迫效应起决定性作用。日光温室条件下,连续7 d每天10 min的光热干露胁迫对泰来草不产生显著性影响(P>0.05)。露空时间20~90 min·d-1(连续7 d)时,随干露胁迫时间的延长,泰来草叶片的损伤程度加重,光合色素含量、叶绿素荧光参数及生长速率均呈降低趋势,叶片和根的MDA、可溶性糖含量及POD、SOD、CAT酶活性呈升高趋势,叶片淀粉、总酚、总黄酮含量呈先升高后降低趋势,根淀粉含量呈降低趋势。90 min·d-1(连续7 d)的干露胁迫处理泰来草叶片叶绿体PS Ⅱ光合反应中心已接近完全失活,达到泰来草承受日周期光热干露胁迫的极限。本研究结果为深入了解泰来草在潮间带生境中的生长适应机制和季节分布规律,以及为受损泰来草床生态修复时的位置选择和管护技术开发提供了依据。
