“大推天河水”不同操作时长对发热幼兔的退热效果及下丘脑5-HT、NE的影响*
2023-12-18王慧娟陈碧婵欧玲林刘迈兰
王慧娟,陈碧婵,龙 倩,欧玲林,钟 欢,刘迈兰,叶 勇,汤 伟
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学针灸推拿学院,湖南 长沙 410208)
“小儿之病,惟热居多。”[1]发热是儿科临床最常见症状之一[2]。持续的高热易引起神经功能损害[3],从而诱发抽搐、癫痫等并发症[4]。目前临床常用小儿退热药以解热镇痛非甾体药为主。解热镇痛非甾体药能快速降低体温,但其潜在的胃肠道不良反应,使婴幼儿应用具有一定局限性[5]。小儿推拿作为中医儿科的主要外治法之一,其退热技术已广泛应用于临床,大量临床研究证实了推拿干预小儿发热安全、有效[6-7]。天河水,性大凉,可治一切热证[8],是小儿推拿治疗发热的经验效穴。当代小儿推拿流派围绕“天河水”,在继承古人的基础上,创新了一系列小儿退热手法,如“清天河水”“取天河水”“大推天河水”“引水上天河”等。其中“大推天河水”作为湖南刘氏小儿推拿流派特色退热技法之一[9],操作独特,讲究手到气到,凉透起效。“大推天河水”临床主要用于治疗小儿高热、实热之证[10]。
推拿临证重视“手随心转,法从手出”,才能发挥“以推代药”的作用,实现“手到病除”的目的;其中“心”“法”涉及的关键要素是推拿手法的刺激量如操作时间、频率等,而手法刺激量通常与临床疗效密切相关。以“天河水”退热推拿为例,临床手法操作的时长,主要以医者个人临床经验为参考依据,尚缺乏统一操作标准。目前文献报道关于“天河水”退热手法的操作时间标准不一[11],操作时间的长短是否直接影响“天河水”的退热效应,尚无直接证据证明[12]。本团队预实验研究发现,大推天河水5 min即可有效降低发热幼兔体温,但叠加手法操作时长是否影响手法退热效果,尚未明确。基于此,本团队以流派核心退热技术“大推天河水”为干预手法,通过建立发热幼兔模型,以观察“大推天河水”的不同操作时长对发热幼兔体温的影响,并探讨其可能的解热机制,以期为临床治疗小儿发热提供推拿手法的量效参考依据。
1 材料
1.1 实验动物与分组 40只50日龄左右的健康普通级雄性新西兰兔,体质量1.5~2.0 kg,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2019-0009,饲养于湖南中医药大学实验动物中心。动物饲养于湿度(55±5)%,温度(25±2)℃,12 h明/12 h暗循环条件下,自由饮食饮水。动物实验经湖南中医药大学动物伦理委员会批准(LLBH-201908120003)。所有动物适应性饲养7 d,待饮食、饮水正常即开始进行肛温适应性测定,每隔30 min测定1次,共测量3次,确保每次测量时体温计插入深度一致,每次测量时长不低于5 min。取3次体温的平均值作为基础体温。选取40只体温波动在38.5~39.5 ℃之间,且最高体温与最低体温差不超过0.5 ℃的合格幼兔,随机分为5组,即正常组、模型组、大推天河水5 min组、大推天河水10 min组及布洛芬组,每组8只。
1.2 主要试剂与仪器 大肠杆菌内毒素(美国Sigma,批号:019M4009Y);布洛芬混悬液(上海强生制药有限公司,批号:200823);兔5-羟色胺(5-hydroxytryptamine,5-HT)ELISA试剂盒(江苏菲亚生物科技有限公司,批号:201211R);兔去甲肾上腺素(Norepinephrine,NE)ELISA试剂盒(江苏菲亚生物科技有限公司,批号:201211R);天沐兽用体温计(九江鑫康医用仪表有限公司制造,型号:ZL888);电子天平(上海良平仪器仪表有限公司,型号:AE1204);微量高速离心机(长沙湘智离心机仪器有限公司,型号:TG16W);移液器(德国艾本德股份公司,型号:3120000054);450 nm波长全自动酶标仪(雷杜生命科学股份有限公司,型号:RT-6100);电热恒温培养箱(一恒苏净科学仪器有限公司,型号:DHP-9012);洗板机(拓普分析仪器有限责任公司,型号:ZMX-988B)。
2 方法
2.1 造模前准备 所有动物先适应性喂养7 d,待饮食、饮水等正常后开始进行造模前适应性固定与操作。(1)适应性固定:在造模前3 d,每日将实验幼兔在特制兔架上仰卧位适应性固定1 h;(2)适应性操作:在造模前1 d对幼兔左前肢剃毛,蘸取与室温相同的清水,在幼兔左前肢掌面正中相当于天河水的位置行“大推天河水”手法,频率为50~100次/min,每次操作1 min,操作2次。(3)称体质量:在造模当天,抓取幼兔进行体质量测定,根据体质量计算造模药物及布洛芬给药剂量。
2.2 模型制备 参照文献[13],以无热源0.9%氯化钠溶液为稀释液,将精制大肠杆菌内毒素稀释成质量浓度为200 ng/mL的溶液,模型组、大推天河水5 min组、大推天河水10 min组及布洛芬组幼兔均经兔耳缘静脉注射大肠杆菌内毒素溶液(1 mL/kg),注射1 h后模型兔体温上升高度(△T)与正常组比较,差异有统计学意义(P<0.01),造模成功[14]。
2.3 天河水定位 参照《实验针灸学》[15]:从腕横纹至肘横纹。
2.4 推拿方法 在造模后1.5 h开始进行推拿干预,按照《小儿推拿》[16]中大推天河水的手法操作要点,医者用示指、中指指面蘸凉水自内劳宫穴经总筋穴沿天河水向上直推至洪池穴,边推边吹气,频率为50~100次/min,实验中推拿操作由同一名实验人员进行。
2.5 各组干预方法 正常组不予以任何干预,相同条件下测量肛温;模型组在造模成功后不予以任何干预,相同条件下测量肛温;大推天河水5 min组于造模后1.5 h进行推拿干预,频率为50~100次/min,共操作5 min;大推天河水10 min组分别于造模后1.5、2.5 h进行推拿干预,频率为50~100次/min,每次操作5 min,共操作10 min;布洛芬组在造模后1.5 h予布洛芬混悬液(0.01 g/mL)灌胃,1 mL/kg。所有实验幼兔从造模后开始监测体温,每隔0.5 h测量1次幼兔肛温,共观察6 h。
2.6 观察指标
2.6.1 体温上升高度 造模后每0.5 h测量1次幼兔肛温,观察幼兔发热的时相并计算体温上升高度△T(△T=体温上升最高值-基础体温),比较各组体温上升高度变化。
2.6.2 退热时间 观察各组幼兔降至正常体温范围(38.5~39.5 ℃)的时间,比较各组体温恢复正常的时间。
2.6.3 下丘脑中5-HT、NE含量 动态体温测量完毕后,各组幼兔利用空气栓塞法致死,快速断头后以灰结节和视交叉之间的中心点为中心确定下丘脑组织,取下丘脑组织,快速投放于液氮中,待下丘脑组织冰冻定型后,转移至-80 ℃环境下保存待测,所有动物取材完毕后,待标本融化,加入一定量的缓冲液,将标本充分匀浆。以3 000 r/min离心15 min(离心半径为13.5 cm)。收集上清液,按照ELISA试剂盒说明书中步骤测定下丘脑中5-HT和NE的含量。
2.7 统计学方法 采用SPSS 25.0软件进行统计学处理。计量资料以“均数±标准差“()表示,对所有数据进行正态性检验及方差齐性检验,体温上升高度值数据不符合正态分布、方差齐性时,采用广义估计方程分析;退热时间及下丘脑5-HT、NE数据符合正态分布,采用单因素方差分析,方差齐时,采用最小显著差异(LSD)法进行组间两两比较,方差不齐则采用ANOVA Tamhane's T2法。以P<0.05为差异有统计学意义。
3 结果
3.1 各组幼兔体温上升高度比较 广义估计方程分析结果显示。(1)组间比较:Waldχ2=211.997,P=0.000,表明不同组别之间体温上升高度差异有统计学意义(P<0.05);(2)时间比较:Waldχ2=425.484,P=0.000,表明不同时间点之间体温上升高度差异有统计学意义(P<0.05);(3)交互效应:组别因素与时间因素存在交互效应(Waldχ2=257.300,P=0.000),表明不同组别随时间变化体温上升高度不一致。大推天河水5 min组幼兔造模后2.0~3.0 h的体温上升高度明显低于模型组(P<0.01);大推天河水10 min组幼兔造模后1.5~3.5 h的体温上升高度低于模型组(P<0.05或P<0.01);布洛芬组幼兔造模后2.0~3.5 h、5.0~5.5 h的体温上升高度低于模型组(P<0.01或P<0.05);大推天河水10 min组幼兔在造模后2.5~4.0 h的体温上升高度低于大推天河水5 min组(P<0.01或P<0.05);布洛芬组幼兔在造模后3.0~4.0 h、5.5~6.0 h的体温上升高度低于大推天河水5 min组(P<0.01或P<0.05);布洛芬组幼兔造模后5.5~6.0 h的体温上升高度低于大推天河水10 min组(P<0.01或P<0.05)。(见表1~2)
表1 各组幼兔体温上升高度(△T)比较 (,℃)
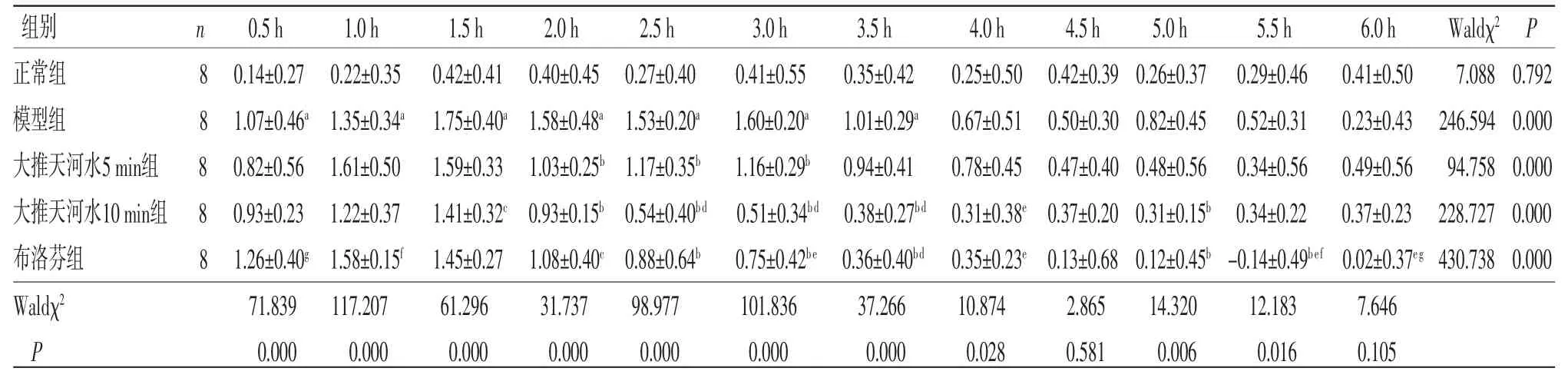
表1 各组幼兔体温上升高度(△T)比较 (,℃)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05;与大推天河水5 min比较,dP<0.01,eP<0.05;与大推天河水10min组比较,fP<0.01,gP<0.05。
?
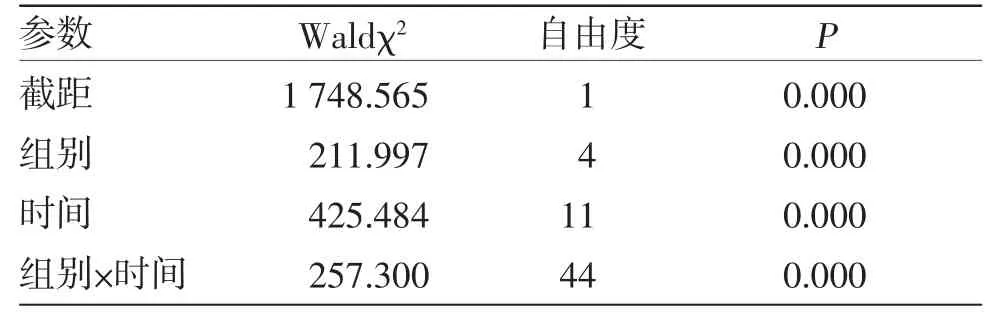
表2 广义估计方程模型效应检验结果
模型组幼兔体温上升高度在造模后1 h显著高于正常组(P<0.01),说明造模成功。造模后,模型组幼兔体温明显升高,出现典型的双向热,发热第一个高峰出现在1.5 h左右,第二个高峰出现在3.0 h左右。(见表1、图1)
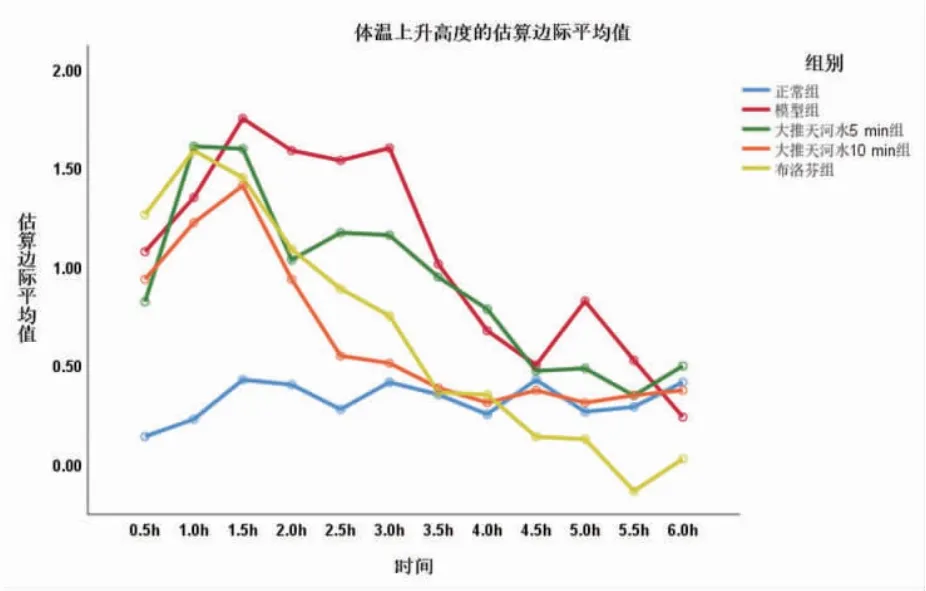
图1 体温上升高度变化图
3.2 各组幼兔退热时间比较 大推天河水10 min组及布洛芬组幼兔退热时间短于模型组(P<0.01);大推天河水5 min组幼兔退热时间与模型组比较,差异无统计学意义(P>0.05);大推天河水10 min组及布洛芬组幼兔退热时间短于大推天河水5 min组(P<0.01);大推天河水10 min组幼兔退热时间与布洛芬组比较,差异无统计学意义(P>0.05)。故各组退热疗效,按时间降序排列如下:大推天河水10 min<布洛芬组<大推天河水5 min组<模型组。(见表3)
表3 各组发热幼兔退热时间比较 (,min)

表3 各组发热幼兔退热时间比较 (,min)
注:与模型组比较,aP<0.01;与大推天河水5 min组比较,bP<0.01。
?
3.3 各组幼兔下丘脑5-HT、NE含量比较 模型组幼兔下丘脑中5-HT含量低于正常组(P<0.01);大推天河水10 min组及布洛芬组幼兔下丘脑中5-HT含量均高于模型组(P<0.01);大推天河水5 min组幼兔下丘脑5-HT含量与模型组比较,差异无统计学意义(P>0.05);大推天河水10 min组及布洛芬组幼兔下丘脑中5-HT含量均高于大推天河水5 min组(P<0.01);大推天河水10 min组幼兔下丘脑中5-HT含量与布洛芬组比较,差异无统计学意义(P>0.05)。(见表4)
表4 各组幼兔下丘脑中5-HT 含量比较 (,ng/mL)

表4 各组幼兔下丘脑中5-HT 含量比较 (,ng/mL)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.01;与大推天河水5 min比较,cP<0.01。
?
模型组幼兔下丘脑中NE含量高于正常组(P<0.01);大推天河水10 min组及布洛芬组幼兔下丘脑中NE含量均低于模型组(P<0.01);大推天河水5 min组幼兔下丘脑中NE含量与模型组比较,差异无统计学意义(P>0.05);大推天河水10 min组及布洛芬组幼兔下丘脑中NE含量均低于大推天河水5 min组(P<0.01);布洛芬组幼兔下丘脑中NE含量低于大推天河水10 min组(P<0.01)。(见表5)
表5 各组幼兔下丘脑中NE 含量比较 (,ng/mL)
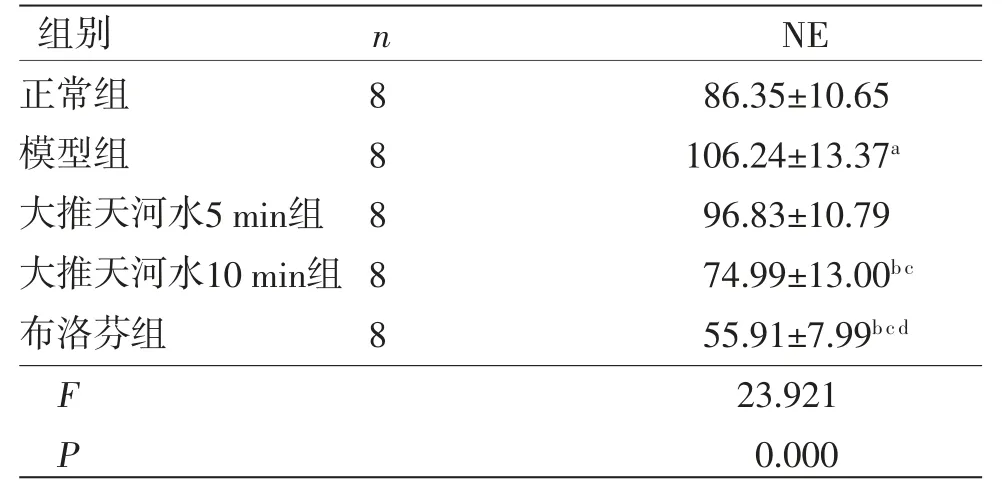
表5 各组幼兔下丘脑中NE 含量比较 (,ng/mL)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.01;与大推天河水5 min比较,cP<0.01;与大推天河水10 min比较,dP<0.01。
?
4 讨论
发热是指机体在各种致热原的作用下,下丘脑体温调定点上移而引起核心温度升高[17]。发热主要由致热原引起。内毒素作为一种外生致热原,经静脉注射进入机体后可激活产内生致热原细胞,产生大量内生致热原。内生致热原通过影响机体中枢单胺类神经递质的释放和代谢,导致下丘脑体温调节中枢功能紊乱,最终引起发热[18]。内毒素致热模型可以较好地模拟发热,有利于探讨推拿治疗小儿发热的解热机制[19]。故本实验选取出生50 d的幼兔,以耳缘静脉注射内毒素制备幼兔发热模型。本实验各组幼兔在内毒素注射后1 h内体温均显著升高,均成功复制发热幼兔模型。
小儿推拿作为一种传统的中医外治法,临床疗效显著,但临床治疗仍缺乏规范的手法操作标准,且手法的治疗量主要依靠施术者自身经验决定推拿手法类别、力度、频率及时间[20]。操作时长作为手法刺激量的基本要素,不仅是推拿起效的关键,也是建立推拿标准化操作基本元素,故对手法刺激量进行规范化、量化研究,有利于操作者控制手法质量,提高临床疗效,促进推拿标准化进程[21]。近年来,关于推拿手法的量化研究日益增多,但多数推拿手法研究以生物力学研究为主[22],而忽略了手法操作时长与临床疗效的关系。在早期推拿治疗时间的探讨中,有学者认为手法要在体内产生多种生理、生化或物理效应,在每一个穴位的操作时间需要维持2~5 min[19]。但彭筱[23]研究发现,单独操作清天河水、退六腑穴5 min左右并无显著退热效果,故目前手法操作时长并无统一的指导标准。天河水穴是小儿推拿中常用的退热穴位[24],临床及实验研究均已证实该穴的退热功效[25]。基于天河水退热手法的临床疗效,本研究针对刘氏小儿推拿流派特色退热技法之一“大推天河水”,开展手法量效研究,探讨可产生最佳退热效应的推拿时长。本实验从体温上升高度和退热时间两方面进行比较,结果显示,大推天河水5 min、大推天河水10 min、布洛芬对发热幼兔均具有一定的降温作用,但大推天河水10 min退热效果显著优于大推天河水5 min;且大推天河水10 min组幼兔退热时间短于布洛芬组、大推天河水5 min组及模型组。表明大推天河水5 min即可发挥退热效应;从手法量效分析,大推天河水10 min组的退热效果更为显著,起效时间明显优于大推天河水5min组。
哺乳动物的下丘脑内含有丰富的单胺类物质。单胺类神经递质作为温度敏感神经元活动的神经化学基础,参与机体体温调节[26]。常见的单胺类神经递质主要有5-HT和NE。5-HT作为中枢内源性解热分子,可抑制发热,而NE含量增加可促使发热[27],故5-HT和NE的动态平衡是维持体温恒定的关键[28]。研究发现三叶青提取物可有效调节体温调节中枢介质5-HT、NE的含量,从而缓解大鼠的发热症状[29]。内毒素等致热源通过影响中枢单胺类神经递质的含量,可引起发热。本实验结果显示,大推天河水10 min可显著增加下丘脑5-HT含量,降低NE含量,维持下丘脑5-HT与NE的动态平衡。这与现已证实的体温调节的单胺学说一致。但大推天河水5min对下丘脑5-HT、NE的调控作用并不明显,故基于大推天河水不同操作时长对下丘脑单胺类神经递质的调节差异,我们推测大推天河水10 min退热疗效更为显著的原因与其调控下丘脑5-HT、NE动态平衡相关。有研究[30]发现,兔脑室内注入5-HT可引起体温下降,但在猫、狗、猴等动物脑室注射5-HT反而出现使体温上升,这种因动物种属差异引起的神经递质差异至今仍存在。洪倩等[31]研究发现,金振口服液具有解热作用,能降低酵母致大鼠发热模型下丘脑中5-HT含量,升高下丘脑中NE含量。本实验结果表明,大推天河水10 min组幼兔下丘脑中5-HT含量高于模型组(P<0.01),NE含量均低于模型组(P<0.01)。由此可知,单胺类神经递质的表达差异可能与动物种属密切相关,但不论是哪一种递质升高或降低,都将引起不同程度的体温变化。
综上所述,大推天河水5 min、大推天河水10 min与布洛芬对内毒素性发热幼兔均有退热作用,但大推天河水10 min的退热效果及退热时间优于大推天河水5 min及布洛芬。由此可知,大推天河水操作时长的叠加与疗效密切相关,操作时长与退热效应相关,即增加推拿干预时间,退热效应明显提高;大推天河水10 min组的退热疗效可能与调控下丘脑5-HT与NE的动态平衡相关。
本研究的不足在于,研究组设立较少、观察时长较短,只涉及叠加量效对比而未对等量手法操作及手法操作频率进行量效比较,故后续研究将探讨大推天河水等量手法操作及手法操作频率与其疗效的关系,以期为临床运用刘氏小儿推拿“大推天河水”手法治疗小儿发热提供可参考的量效依据。
