物质结构与性质核心考点测试题(B卷)
2023-12-16江西师范大学附属中学谢文勋
■江西师范大学附属中学 谢文勋
1.“胃舒平”的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·H2O)等化合物。下列叙述中错误的是( )。
A.基态铝原子的价层电子排布式是3s23p1
B.硅原子核外共有14 种不同运动状态的电子
C.离子半径:Mg2+>Al3+
D.工业上通过电解熔融Al Cl3制备金属铝
2.下列说法中错误的是( )。
A.臭氧是极性分子
B.酸性强弱:一氟乙酸>一氯乙酸>乙酸
C.氨水中有4种氢键
D.将饱和硫酸铜溶液快速降温可得到大颗粒的硫酸铜晶体
3.多孔储氢材料前驱体结构如下,M、W、X、Y、Z 为原子序数依次增大,且都是前四周期的主族非金属元素,Z 的核外成对电子数与未成对电子数之比为3∶1。下列说法错误的是( )。
A.第一电离能:Y>Z>X
B.M 分别能与W、Y 形成正四面体的离子
C.1 mol该物质的阴离子含有的配位键数为1NA
D.X、Y 都能和Z 形成两种及以上化合物
4.铁及其化合物是重要的化工产品,广泛用于生产、生活。已知NO 能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4。图1 为γ-Fe的晶胞。下列有关说法错误的是( )。

图1
A.γ-Fe的晶胞中,铁原子的配位数为12
B.该配合物的配位数为6
5.地球上的硅大部分以二氧化硅及硅酸盐的形式存在,它们的基本结构单位是硅氧四面体[SiO4](图2a)。石英晶体中的硅氧四面体相连构成螺旋链(图2b)。天然硅酸盐组成复杂,硅、氧原子通过共用氧原子形成各种不同的硅酸根阴离子,一种层状硅酸根阴离子结构如图2c 所示。下列说法正确的是( )。
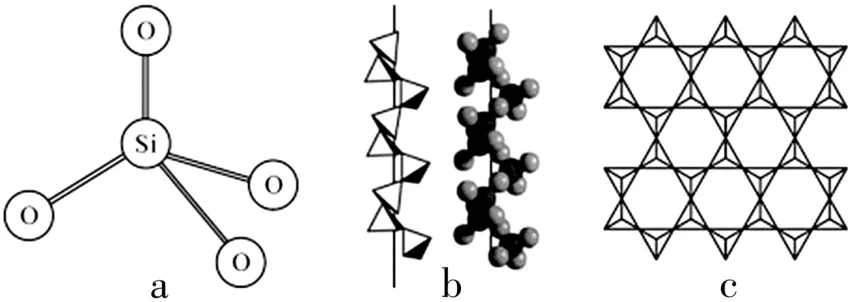
图2
A.1 mol SiO2分子含有2 mol Si—O 键
B.图2b为低温石英的结构,具有手性,被广泛用作压电材料
D.图2c层状硅酸根阴离子结构中硅和氧的原子个数比为1∶3
6.“肼合成酶”以其中的Fe2+配合物为催化中心,可将N H2O H 与N H3转化为肼(NH2NH2),其反应历程如下所示。下列说法错误的是( )。
A.一定条件下 N H2OH、N H3和NH2N H2都能与盐酸反应
B.反应过程中涉及极性键的断裂与非极性键的形成
C.该过程中铁元素的价态始终不变
D.将N H2O H 替换为ND2OD,反应可得ND2NH2和HDO
7.铍(Be)与铝具有相似的性质,图3为Be O 晶胞结构示意图。沿着晶胞体对角线方向投影,下列图中能正确描述投影结果的是( )。

图3
8.2019年诺贝尔化学奖授予Goodenough等人,以表彰他们在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献。图4(a)为LiFePO4的晶胞结构示意图。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,LiFe O4脱出部分Li+,形成Li1-xFePO4,图4(b)为Li1-xFePO4的晶胞结构示意图。下列说法错误的是( )。
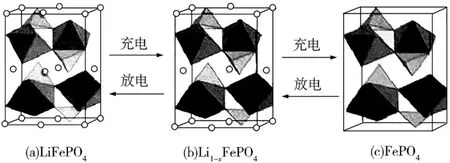
图4
A.阴离子中P 原子的杂化轨道类型为sp3
B.每个晶胞中有4个LiFePO4单元
C.x=0.187 5
D.图4(b)中n(Fe2+)∶n(Fe3+)=3∶13
9.有关晶体的结构如图5 所示,下列说法中错误的是( )。

图5
A.在Na Cl晶体中,距Cl-最近且等距的Na+有6 个,距Na+最近且等距的Na+共12个
B.在CaF2晶体中,每个晶胞含有4 个Ca2+,F-的配位数是4
C.在金刚石晶体中,每个碳原子被12个最小六元环共同占有
D.该气态团簇分子的分子式为EF 或FE,其晶体不导电
10.砷与镓的化合物是继硅之后研究最深入、应用最广泛的半导体材料。某种由砷和镓组成的化合物,其立方晶胞结构如图6所示,图7 为晶胞沿z轴的1∶1 平面投影图,已知图中A 球的原子坐标参数为(0,0,0),B 球为(1,1,1),设NA为阿伏加德罗常数的值,该物质的摩尔质量为Mg·mol-1。下列说法错误的是( )。

图6

图7
A.该化合物的化学式为Ga As
B.距离最近的两个Ga 原子的距离为2apm
11.图8所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图9所示。
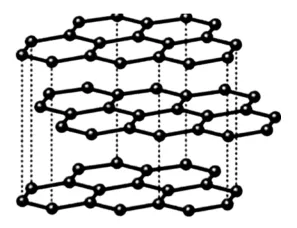
图9
回答下列问题:
(1)图9对应的物质名称是_____,其晶胞中原子的杂化轨道类型为____。
(2)d中元素的原子结构示意图为_____。
(3)g的电子式为____。
(4)f中化学键的类型为____。
(5)图8中的双原子分子中,极性最大的分子是_____。
(6)k的分子式为____,中心原子的杂化轨道类型为____,属于____分子(填“极性”或“非极性”)。
12.研究发现,火星岩的主要成分有K2O、Ca O、Na2O、Mg O、Al2O3、Fe2O3、Fe O、Si O2和H2O。
(1)Na、Mg、Al的第一电离能由大到小的顺序是____。
(2)Al2O3溶于 Na O H 溶液生成Na[Al(OH)4],[Al(OH)4]-中Al的杂化类型是____。
(3)实验室用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中σ键、π键数目之比为_____。
(4)晶体熔点:K2O_____ (填“>”或“<”)Ca O。
(5)已知铁和镁形成的晶胞如图10所示。
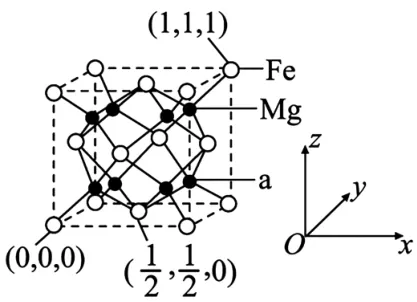
图10
①在该晶胞中铁的配位数为____。
②图中a处原子坐标参数为____。
③已知该晶胞密度为ρg·cm-3,NA为阿伏加德罗常数的值。该晶胞中Fe原子与Mg原子的最近距离是____pm(用含NA、ρ的代数式表示)。
(1)Cr在元素周期表中的位置是_____,Mn属于_____区。
(2)吡咯中N 原子的价层孤电子对占据_____(填字母)。
A.2s轨道 B.sp2杂化轨道
C.sp杂化轨道 D.2p轨道
14.近年来,研究者发现,Ⅰ-Ⅲ-Ⅵ2(Ⅰ:Cu,Ag;Ⅲ:Al,Ga,In;Ⅵ:S,Se,Te)的黄铜矿半导体在中高温区域显示出了非凡的热电性能,使该类材料成为热电领域的研究热点之一。回答下列问题:
(1)Cu2+和烟酸所形成的新型金属配合物, 可减少Cu2+对维生素的催化分解,该配合物的结构如下所示。
①下列有关铜的粒子中,失去1 个电子需要能量最多的是____(填字母)。
A.[Ar]3d94s1B.[Ar]3d10
C.[Ar]3d104s1D.[Ar]3d104p1
②1 mol 该配合物含有σ 键的数目为____(阿伏加德罗常数用NA表示)。
③该配合物中碳原子的杂化方式为____。
(2)Cu2-xSe 是一种钠离子电池正极材料,其立方晶胞结构如图11所示。该晶胞中n(Cu2+)∶n(Cu+)=____。
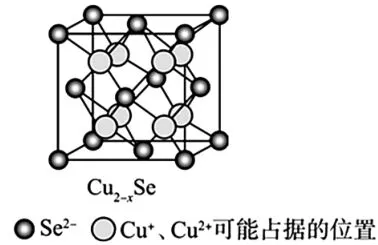
图11
(3)H2O、H2S、H2Te的沸点由高到低的顺序为_____(填化学式)。比较H2O 和H2S的键角大小并说明其原因:___。
