中国儿童细菌耐药监测组2022年儿童细菌耐药监测
2023-12-15王传清许红梅景春梅邓继岿王红梅华春珍陈英虎陈学军陈益平杨锦红林爱伟王世富邓慧玲曹三成郝建华黄园园项红霞卓志强1黄美恋1
付 盼 王传清 俞 蕙 吴 霞 许红梅 景春梅 邓继岿 王红梅 华春珍 陈英虎 陈学军 陈益平 杨锦红 林爱伟 王世富 曹 清 王 星 邓慧玲 曹三成 郝建华 高 巍 黄园园 项红霞 卓志强1 黄美恋1
抗菌药物在儿童中的广泛应用已经引起较为严峻的细菌耐药问题,监测临床儿科患者分离菌的分布和耐药变迁对儿科抗感染治疗尤其重要。为了解和监测全国儿童细菌感染常见病原菌及耐药变迁,由全国三级甲等教学儿童医院组成的细菌耐药监测组ISPED组织(Infectious Disease Surveillance for Pediatrics)每年对各家成员单位的耐药监测数据进行汇总和分析。现对2022年ISPED 12家成员单位的儿童细菌耐药监测结果进行统计分析,为临床合理使用抗菌药物、遏制耐药菌的传播提供理论基础。
1 方法
1.1 菌株来源 2022年1月1日至12月31日ISPED中12所三级甲等儿童医院或综合医院儿科临床分离株,剔除重复菌株及污染菌株,凝固酶阴性葡萄球菌仅纳入无菌部位样本(血液、脑脊液等),非无菌部位样本未进一步区分定植菌和致病菌。菌株纳入标准和排除标准:详见2019年ISPED监测组发表文章[1]。
1.2 细菌培养及鉴定 细菌分离和培养参照微生物学检验诊断操作规程。采用VIETEK自动化细菌分析仪(法国)或MALDI-TOF/MS质谱鉴定仪(法国,布鲁克)进行菌种鉴定。质控菌株采用ATCC25922、ATCC25923、ATCC49619和ATCC66027。
1.3 抗菌药物敏感试验 抗菌药物敏感试验采用自动化细菌鉴定及药敏分析仪(Vitek2 Compact,法国)或纸片扩散法(OXOID公司),肺炎链球菌青霉素药物敏感性试验采用E-test(OXOID公司)做补充。质控菌株采用ATCC25922、ATCC25923、ATCC27853、ATCC49619和ATCC49247,药物敏感性试验质量控制每周进行1次。判断标准:参照2022年CLSI M100-S32文件推荐的判断标准[2]。耐药菌的检测和定义:青霉素不敏感肺炎链球菌(PNSP),碳青霉烯类耐药的肠杆菌目细菌(CRE)、碳青霉烯类耐药的肺炎克雷伯菌(CR-KP)、碳青霉烯类耐药的铜绿假单胞菌(CR-PA)和碳青霉烯类耐药的鲍曼不动杆菌(CR-AB)的定义和检测方法参考2021年ISPED报道[3]。
多粘菌素或替加环素不敏感的革兰阴性菌:用微量肉汤稀释法复核MIC值;万古霉素、替考拉宁或利奈唑胺不敏感的革兰阳性菌:用纸片法或MIC法进行复核。
1.4 β-内酰胺酶(OXD)检测 采用OXD试纸与被测菌接触,室温下变红色为阳性,不变色(黄色)为阴性。
1.5 年龄分组 新生儿组(≤28 d)、婴儿组(~1岁)、幼儿组(~3岁)、学龄前期组(~6岁)、学龄期组(~12岁)、青春期组(≤18岁)。
1.6 统计学分析 不同组间细菌耐药率统计分析采用WHONET 5.6统计分析软件。多重耐药菌(MDROs)趋势分析采用趋势卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 分离株总体特征分析 共收集分离菌株50 399株。
2.1.1 ISPED成员单位中分离株分布 以收集分离株数量排序:重庆医科大学附属重庆儿童医院14 703株,浙江大学医学院附属儿童医院6 901株,广东省深圳市儿童医院5 502株,复旦大学附属儿科医院4 603株,温州医科大学第二附属医院3 533株,福建省厦门市儿童医院3 524株,山东大学附属儿童医院3 399株,上海交通大学医学院附属上海儿童医学中心2 591株,陕西省西安市儿童医院2 356株,江苏省无锡市儿童医院2 158株,吉林大学白求恩第一医院儿科分离株743株,河南省开封市儿童医院386株。
2.1.2 分离株患儿年龄分布 新生儿组 4 486株(8.9%),婴儿组14 459株(28.7%),幼儿组8 804株(17.5%),学龄前期组10 157株(20.2%),学龄期组9 320株(18.5%),青春期组3 173株(6.2%)。
2.1.3 分离株患儿性别分布 男性29 859例(59.2%),女性 20 540例。
2.1.4 分离株菌属分布 革兰阳性菌19 572株(38.8%),革兰阴性菌30 827株(61.2%)。
2.1.5 分离株菌种总体分布 肠杆菌目细菌 15 920株(31.6%),葡萄球菌属9 136株(18.1%),非发酵菌8 434株(16.7%),链球菌属7 798株(15.5%),肠球菌属2 533株(5.0%)。分离株占比前10位的分别是:大肠埃希菌(14.3%)、流感嗜血杆菌(11.8%)、金黄色葡萄球菌(11.4%)、肺炎链球菌(11.3%)、凝固酶阴性葡萄球菌(6.8%)、卡他莫拉菌(7.3%)、肺炎克雷伯菌(5.3%)、铜绿假单胞菌(4.4%)、鲍曼不动杆菌(2.3%)及粪肠球菌(2.1%)。
2.1.6 分离株菌种在不同年龄组占比分布 表1显示,大肠埃希菌是新生儿组、学龄期组和青春期组儿童的主要分离株,占比分别为18.2%、24.3%和23.0%;流感嗜血杆菌是婴儿组儿童最主要分离菌(13.5%),肺炎链球菌是幼儿组和学龄前期组儿童最主要分离菌,占比分别为16.1%和16.2%。
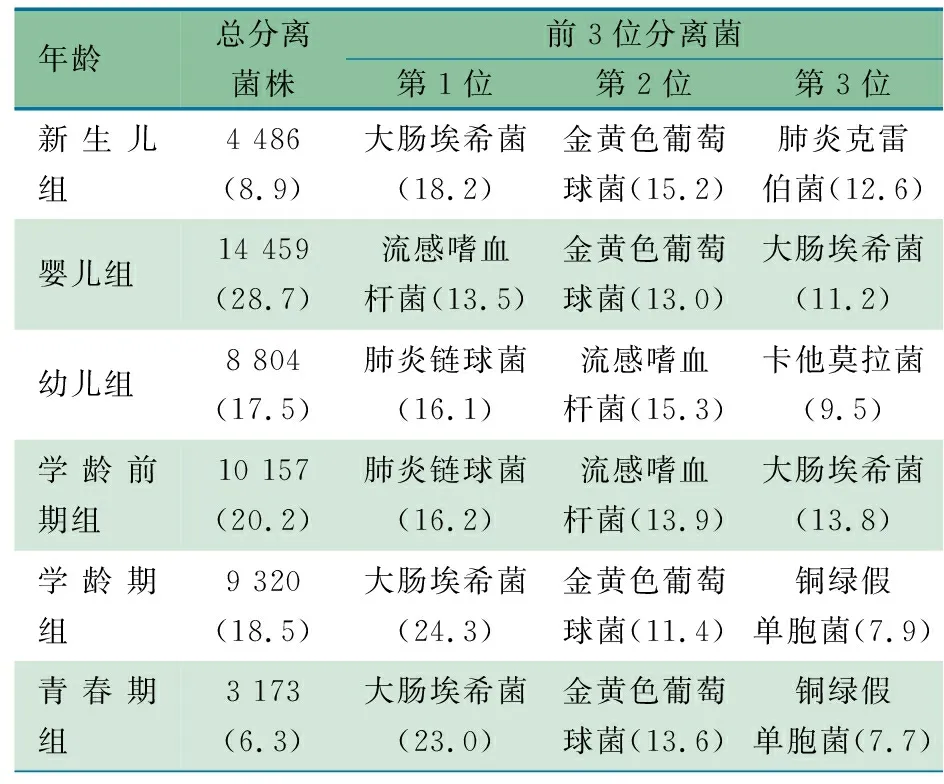
表1 ISPED监测不同年龄组患儿主要分离株分布(%)
2.2 细菌分离株标本分布及不同分离部位主要分离株
2.2.1 菌株的主要标本来源分布 50 399株临床分离株中,下呼吸道标本(痰、肺泡灌洗液等)占46.7%(23 540株),脓液/分泌物标本(伤口、脓液、各种分泌物)占16.9%(8 537株),尿液标本占11.3%(5 696株),血液标本占8.5%(4 284株),肠道标本(含粪便和肛拭子)占5.9%(2 969株),上述标本占比总和89.3%(45 026株)。
2.2.2 不同标本来源前5位分离株分布 表2显示,①下呼吸道标本:分离率最高的为流感嗜血杆菌(22.5%)、肺炎链球菌(22.3%)、卡他莫拉菌(14.9%)和金黄色葡萄球菌(14.3%);②脓液/分泌物标本:分离率最高的为大肠埃希菌(32.1%)和金黄色葡萄球菌(16.1%);③尿液标本:分离率最高的为大肠埃希菌(36.3%)、粪肠球菌(13.3%)和屎肠球菌(10.8%);④肠道标本:分离率最高的为未分型沙门菌(42.1%)、鼠伤寒沙门菌(27.7%)和肠炎沙门菌(13.8%);⑤血液标本:分离率最高的为凝固酶阴性葡萄球菌(52.2%),最主要为表皮葡萄球菌和人葡萄球菌,占比分别为26.9%和16.4%,但不排除标本采样时的污染可能,应结合临床症状和指征判断是否为致病菌。
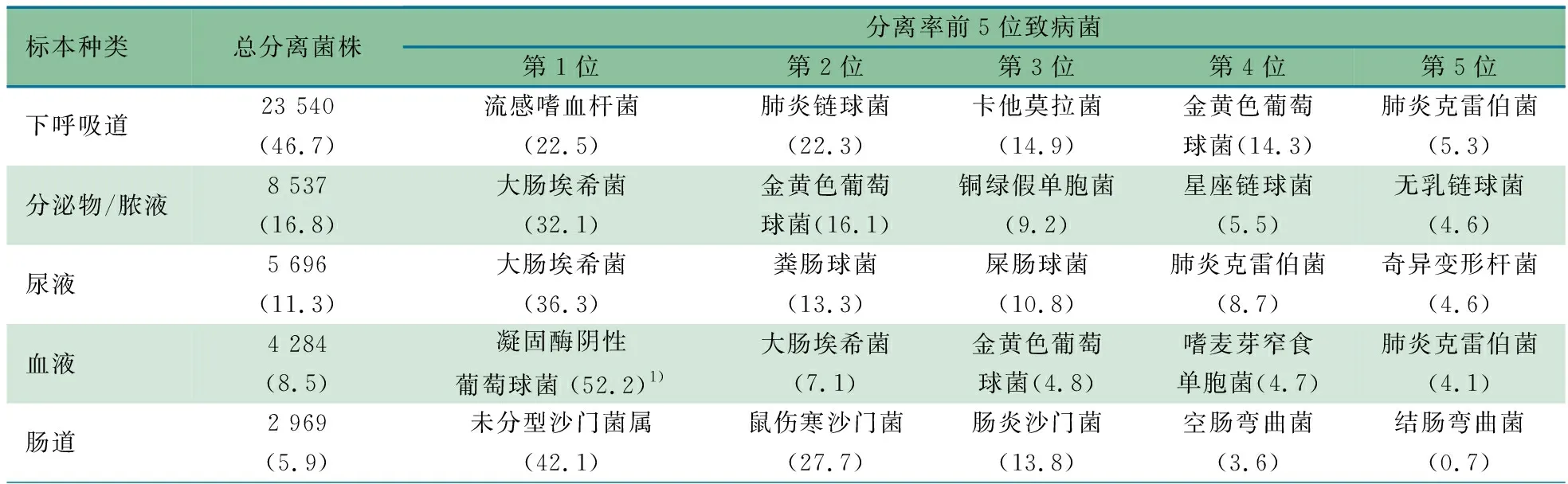
表2 ISPED监测细菌分离株标本来源分布及分离率前5位致病菌占比(%)
2.3 革兰阴性菌耐药监测数据分析
2.3.1 肠杆菌目细菌耐药监测数据 表3显示,肠杆菌目细菌共分离到15 920株,占比前3位的分别为大肠埃希菌7 224株(45.4%)、肺炎克雷伯菌2 660株(16.7%)和阴沟肠杆菌798株(5.0%)。产超广谱β-内酰胺酶(ESBL)的大肠埃希菌和肺炎克雷伯菌占比分别为41.8%(3 019/7 224)和42.3%(1 125/2 660)。大肠埃希菌对氨苄西林、头孢唑啉和甲氧苄啶/磺胺甲噁唑耐药率均>50%,对头孢呋辛、头孢曲松和环丙沙星的耐药率均>40%,对氨苄西林-舒巴坦和左氧氟沙星耐药率均>30%;肺炎克雷伯菌对Ⅰ~Ⅲ代头孢菌素、阿莫西林/克拉维酸、氨苄西林-舒巴坦、氨曲南和甲氧苄啶/磺胺甲噁唑耐药率均>30%;阴沟肠杆菌对头孢曲松耐药率为35.3%,对其他抗生素耐药率均<30%。大肠埃希菌、肺炎克雷伯菌和阴沟肠杆菌对美罗培南耐药率分别为2.2%、18.5%和8.1%。
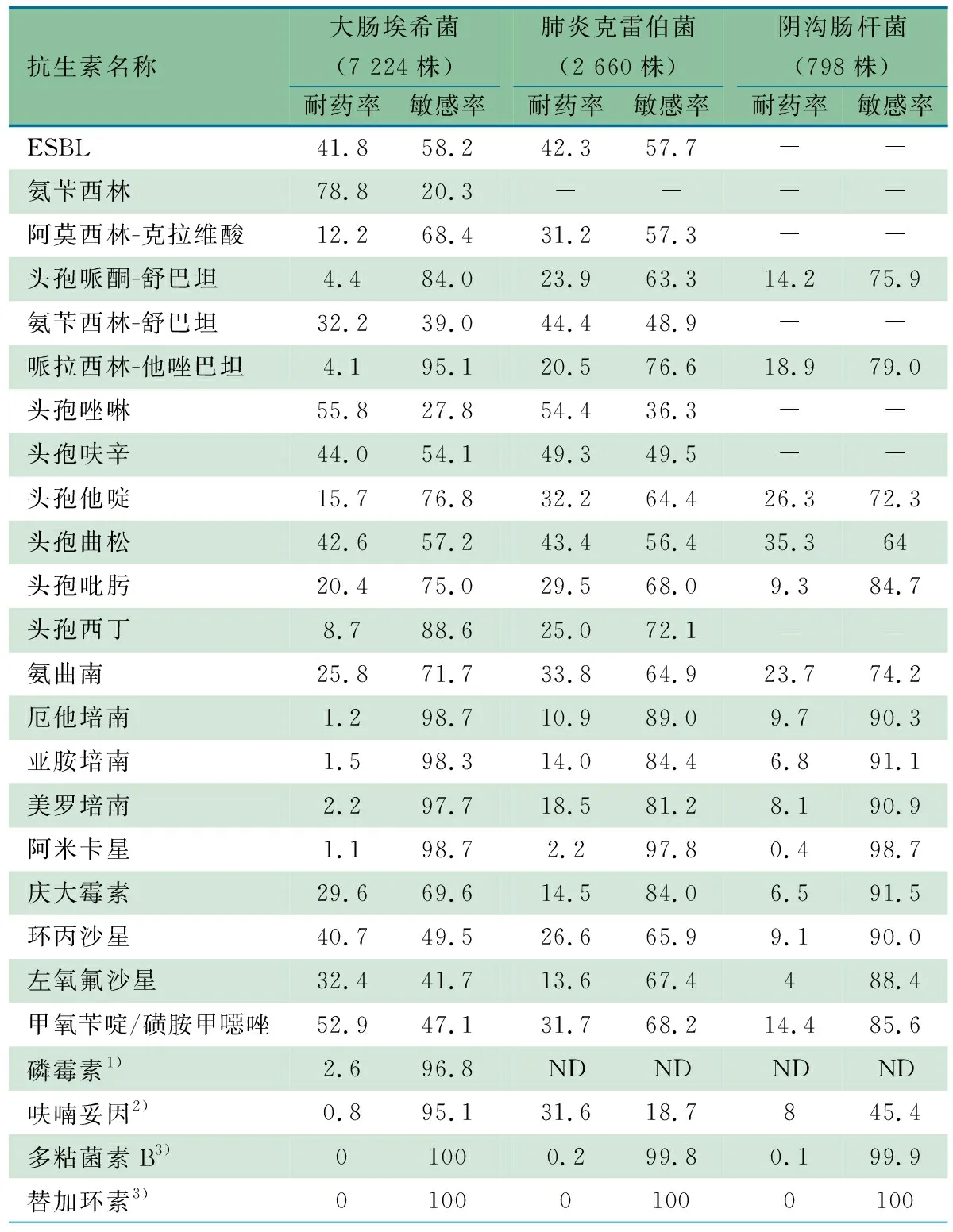
表3 2022年ISPED监测主要肠杆菌目细菌耐药率情况(%)
2.3.2 主要非发酵菌的耐药性分析 表4显示,非发酵菌共分离到8 434株,占比前2位的分离菌分别为铜绿假单胞菌2 230株(26.4%)和鲍曼不动杆菌1 149株(13.6%)。铜绿假单胞菌总体耐药率均<10%,鲍曼不动杆菌对多种监测抗生素的耐药率均<30%,其中铜绿假单胞菌和鲍曼不动杆菌对美罗培南耐药率分别为5.9%和26.1%。
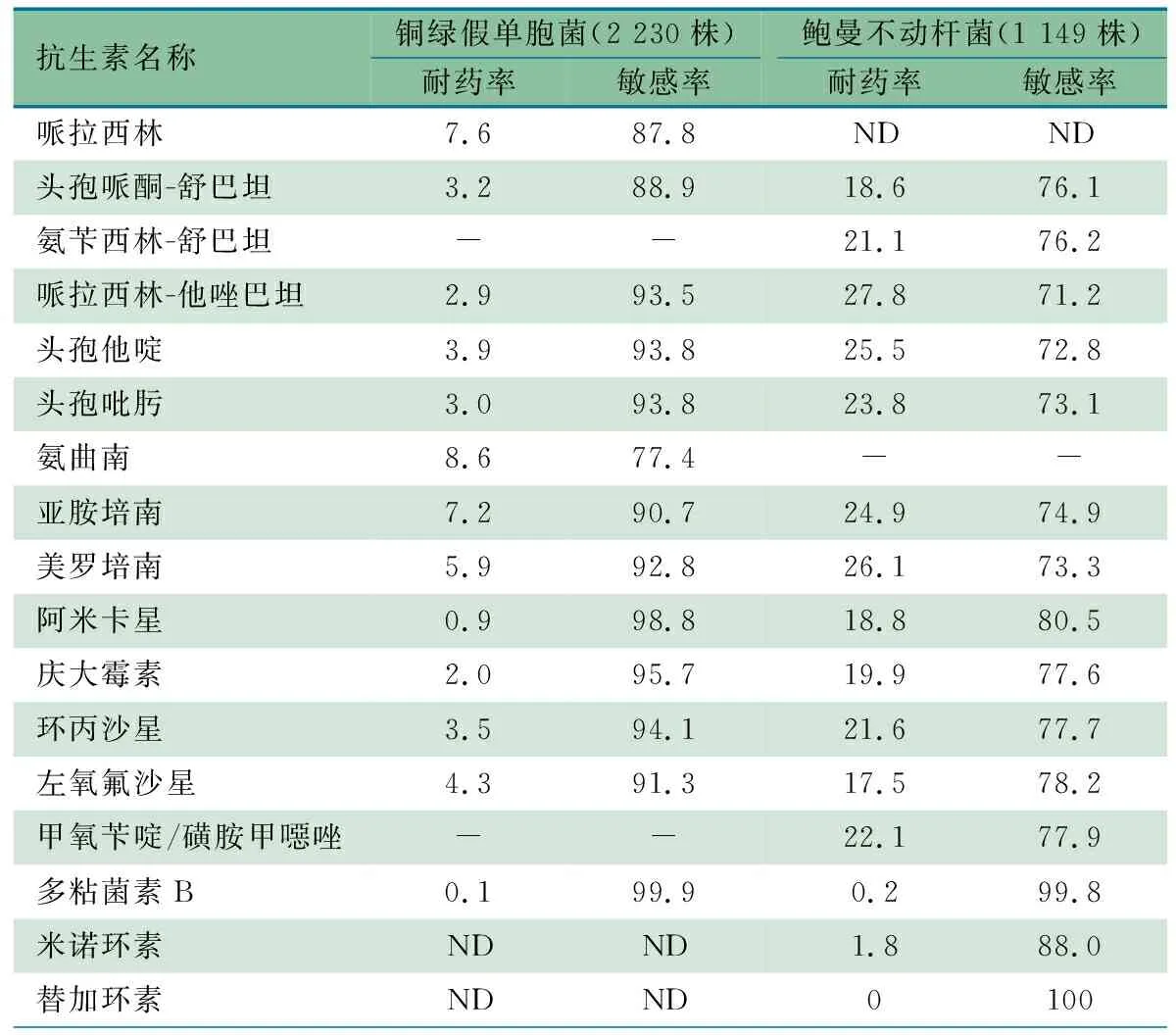
表4 2022年ISPED监测主要非发酵菌耐药率情况(%)
2.3.3 流感嗜血杆菌和卡他莫拉菌耐药性分析 表5显示,共分离到流感嗜血杆菌5 937株(11.8%)和卡他莫拉菌3 704株(7.3%),β-内酰胺酶产酶率在流感嗜血杆菌中为68.9%(4 091株)、在卡他莫拉菌中为98.9%(3 663株)。流感嗜血杆菌对氨苄西林和甲氧苄啶/磺胺甲噁唑耐药率分别为76.2%和70.3%,对头孢呋辛、氨苄西林-舒巴坦耐药率均>50%。流感嗜血杆菌和卡他莫拉菌对阿奇霉素非敏感率分别为46.3%和37.7%。卡他莫拉菌对克林霉素耐药率为18.3%,对除阿奇霉素和克林霉素外的其他抗生素耐药率均<10%。
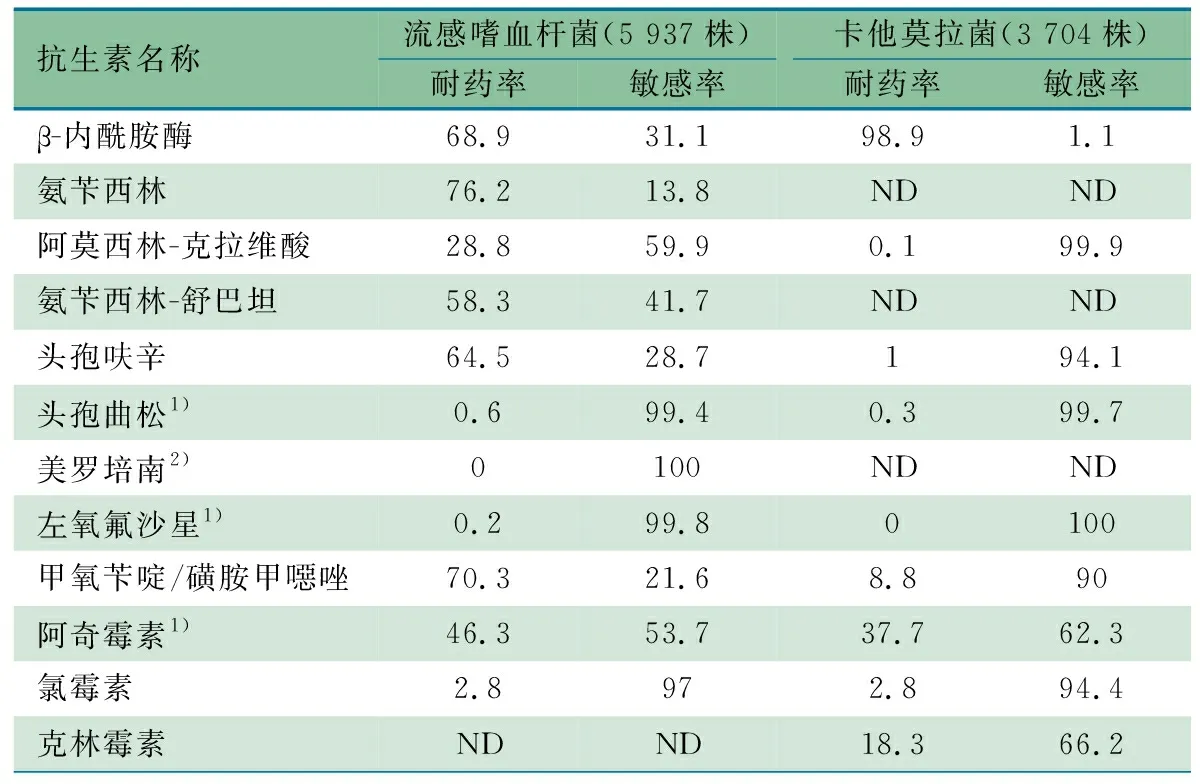
表5 2022年ISPED监测流感嗜血杆菌和卡他莫拉菌耐药率情况(%)
2.4 革兰阳性球菌耐药监测数据分析
2.4.1 葡萄球菌属耐药监测数据分析 表6显示,共分离到葡萄球菌属9 136株,其中金黄色葡萄球菌5 725株(62.7%),凝固酶阴性葡萄球菌3 411株(37.3%)。金黄色葡萄球菌对青霉素和红霉素耐药率分别为92.1%和57.9%,对苯唑西林和克林霉素耐药率分别为32.8%和36.6%,对庆大霉素、利福平、环丙沙星、左氧氟沙星和甲氧苄啶/磺胺甲噁唑的耐药率均<10%。凝固酶阴性葡萄球菌对苯唑西林、青霉素和红霉素耐药率分别为80.5%、93.4%和79.6%,对克林霉素、左氧氟沙星和甲氧苄啶/磺胺甲噁唑耐药率均>30%,对环丙沙星耐药率>25%。已有少量的凝固酶阴性葡萄球菌显示出对利奈唑胺、万古霉素和替考拉宁耐药,其耐药率分别为0.1%、0.1%和0.2%。
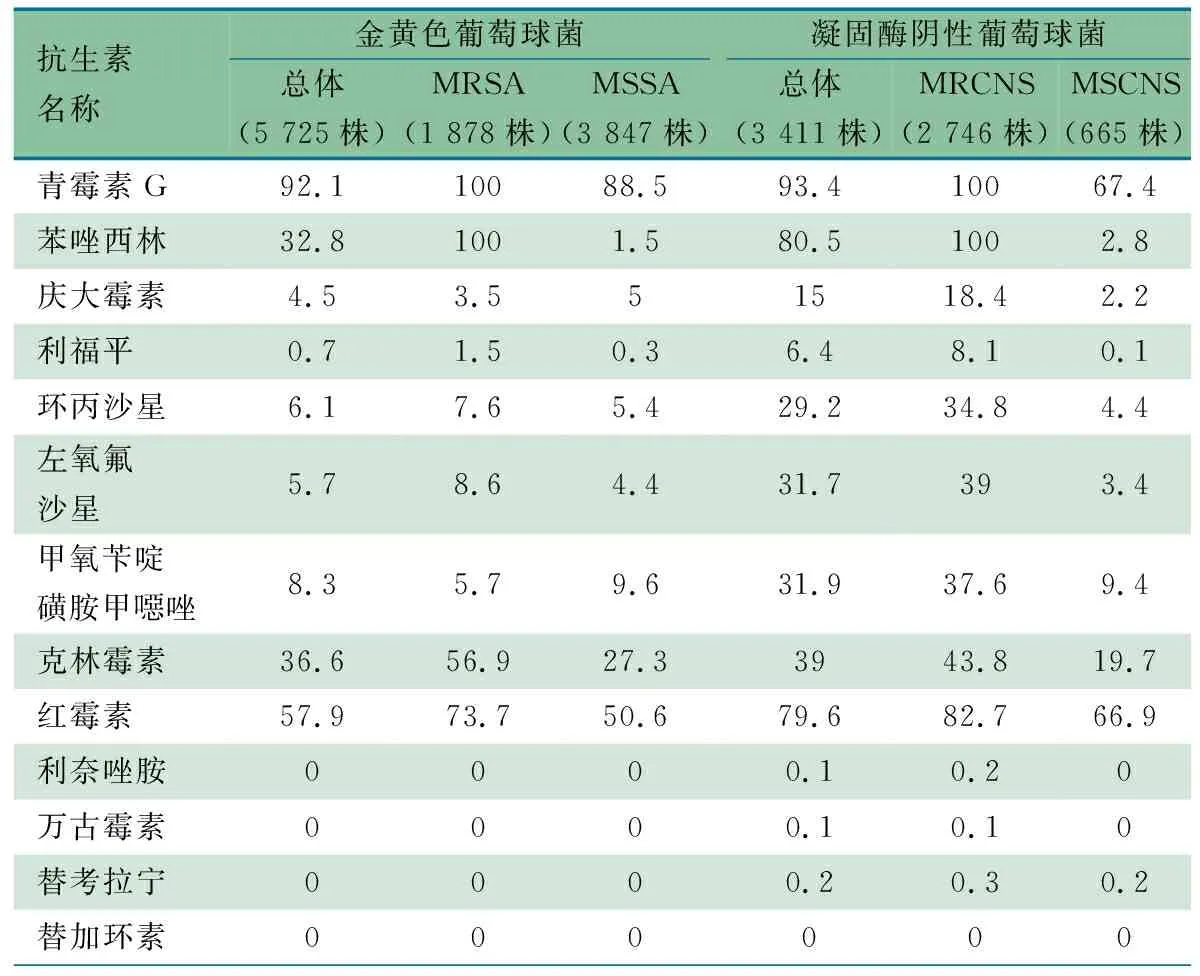
表6 2022年ISPED监测葡萄球菌属耐药率情况(%)
表6显示,耐甲氧西林金葡菌(MRSA)和耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)检出率分别为32.8%(1 878/5 725)和80.5%(2 746/3 411)。MRSA对克林霉素和红霉素耐药率分别为56.9%和73.7%,甲氧西林敏感金黄色葡萄球菌(MSSA)对克林霉素和红霉素耐药率分别为27.3%和50.6%。MRCNS对庆大霉素、利福平、环丙沙星、左氧氟沙星、甲氧苄啶/磺胺甲噁唑、克林霉素和红霉素耐药率,均高于甲氧西林敏感的凝固酶阴性葡萄球菌(MSCNS)。
2.4.2 链球菌属耐药性分析 表7显示,共分离到7 798株链球菌属,占比前2位的为肺炎链球菌5 696株(73.1%)和化脓性链球菌549株(7.0%),肺炎链球菌株中有18株来源于脑脊液(0.3%)。PNSP在脑脊液和非脑脊液来源肺炎链球菌中的比例分别为88.9%和6.7%。肺炎链球菌对红霉素、克林霉素耐药率均>95%;对甲氧苄啶/磺胺甲噁唑耐药率>50%。化脓性链球菌对青霉素、利奈唑胺和万古霉素均100%敏感,对红霉素和克林霉素耐药率分别为94.0%和92.5%。
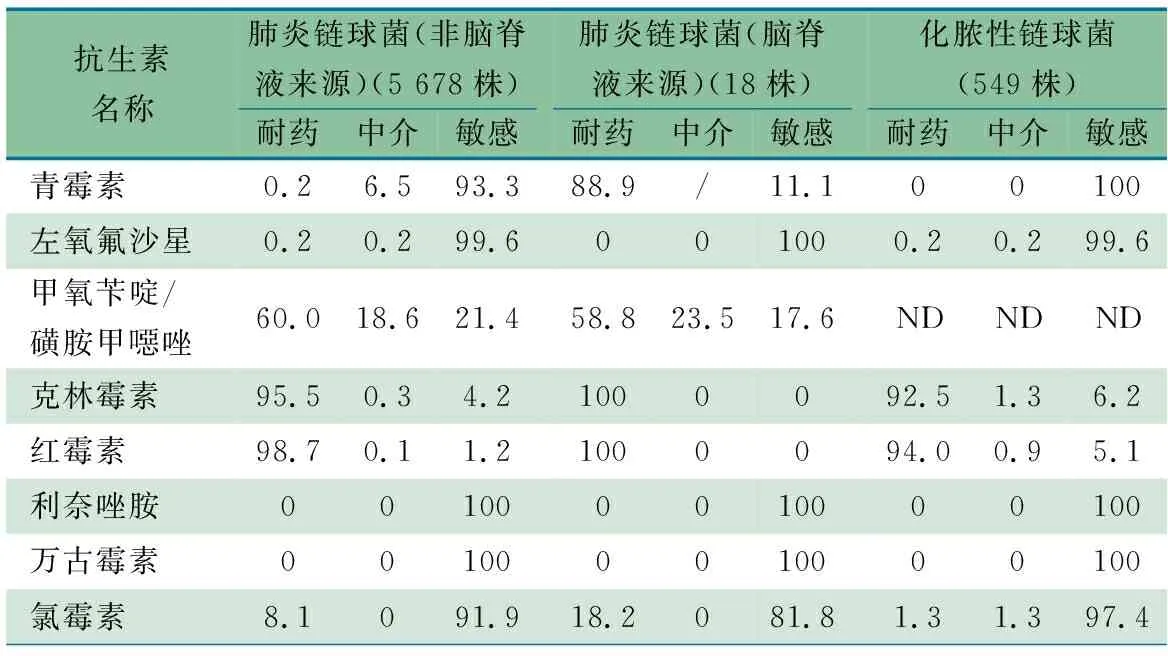
表7 2022年ISPED监测链球菌属耐药率情况(%)
2.4.3 肠球菌属耐药性分析 表8显示,共分离到肠球菌属细菌2 533株,占比前2位的屎肠球菌和粪肠球菌均为1 079株(42.6%)。屎肠球菌对氨苄西林、左氧氟沙星和红霉素耐药率分别为89.1%、53.6%和75.3%,对高浓度庆大霉素耐药率为43.0%,对呋喃妥因耐药率为17.2%(尿液分离株)。粪肠球菌对红霉素耐药率为64.1%,对高浓度庆大霉素耐药率为37.2%。已有少量(0~0.2%)利奈唑胺或万古霉素或替考拉宁耐药的肠球菌检出。
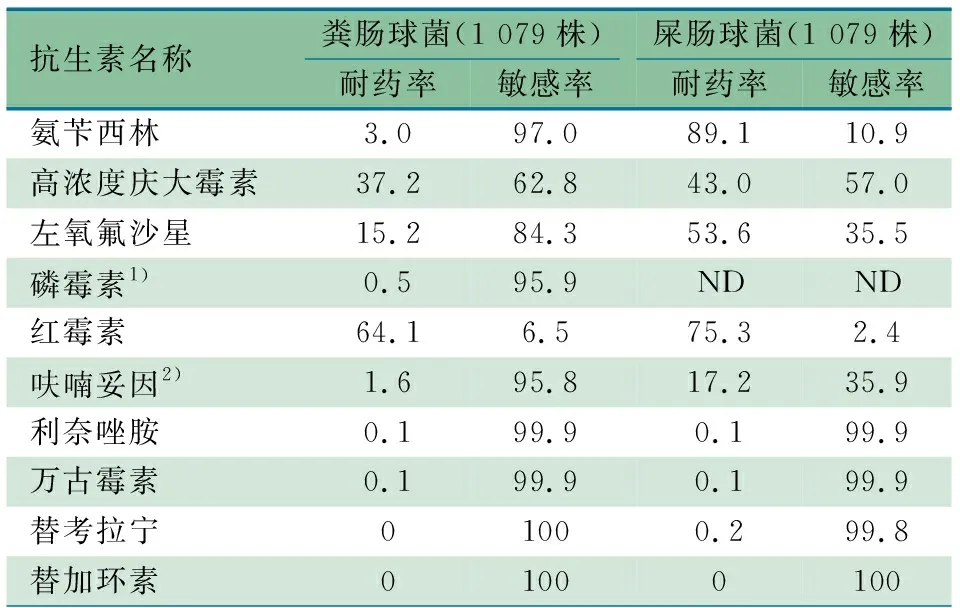
表8 2022年ISPED监测肠球菌属耐药率情况(%)
2.5 MRSA在新生儿与非新生儿中的分布特征和耐药监测
2.5.1 MRSA分离株年龄分布特征分析 表9显示,金黄色葡萄球菌5 749株中,共分离到MRSA 1 878株(32.8%),新生儿组和非新生儿组MRSA分别检出207和1 671株。MRSA对红霉素耐药率较高,新生儿组和非新生儿组分别为60.9%和75.3%。

表9 2022年ISPED监测MRSA耐药率情况(%)
2.5.2 碳青霉烯类耐药菌(CRO)分离株年龄分布特征分析 15 920株肠杆菌目细菌中,新生儿组1 871株,非新生儿组14 049株。表10显示,共分离到CRE菌株710株(4.5%),CRE检出率新生儿组6.4%(120株),非新生儿组4.2%(590株)。CRE菌株对多种抗生素高度耐药,其中对头孢他啶、头孢吡肟、头孢西丁和酶抑制剂复合制剂耐药率均>80%;对氨曲南耐药率>70%;对甲氧苄啶/磺胺甲噁唑耐药率>50%。庆大霉素、环丙沙星、左氧氟沙星和甲氧苄啶/磺胺甲噁唑耐药率在非新生儿组分别为33.1%、49.7%、35.1%和63.5%,在新生儿组分别为20.7%、18.7%、18.3%和25.8%。
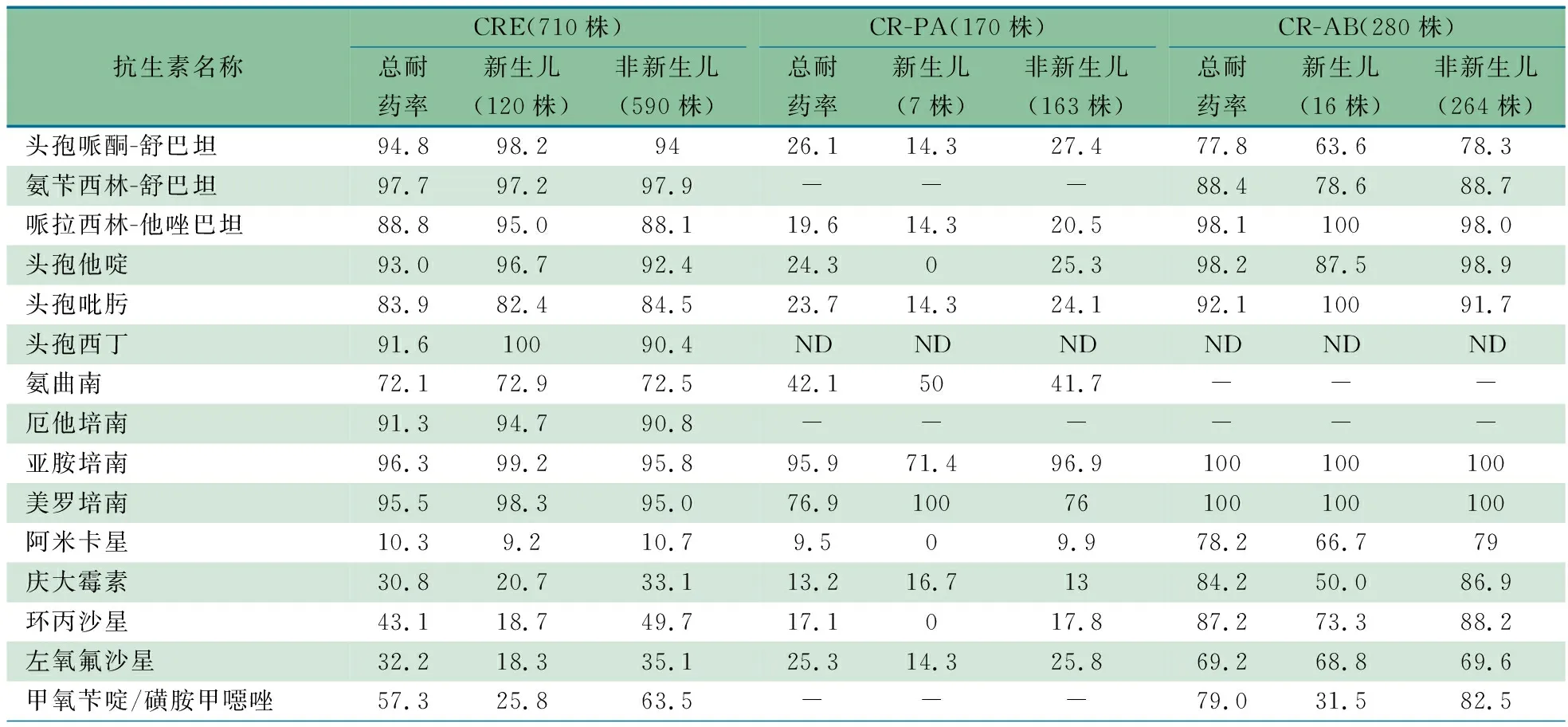
表10 2022年ISPED监测碳青霉烯类耐药菌(CRO)的耐药率情况(%)
表10显示,2 230株铜绿假单胞菌中,新生儿组62株,非新生儿组2 168株,共分离到CR-PA 170株(7.6%),CR-PA检出率新生儿组为11.3%(7株),非新生儿组为7.5%(163株)。CR-PA对氨曲南耐药率为42.1%,对头孢哌酮-舒巴坦、头孢他啶、头孢吡肟和左氧氟沙星耐药率均>20%。新生儿组分离的CR-PA对多种抗生素如头孢哌酮-舒巴坦、哌拉西林-他唑巴坦、头孢他啶、头孢吡肟、亚胺培南、阿米卡星、环丙沙星和左氧氟沙星的耐药率均低于非新生儿组。
表10显示,1 149株鲍曼不动杆菌中,新生儿组146株,非新生儿组1 003株,共分离到CR-AB 280株(24.3%),CR-AB检出率新生儿组为10.9%(16株),非新生儿组26.3%(264株)。CR-AB对Ⅲ-Ⅳ代头孢、酶抑制剂复合制剂的耐药率为77.8%~98.2%。非新生儿组中CR-AB对头孢哌酮-舒巴坦、氨苄西林-舒巴坦、头孢他啶、阿米卡星、庆大霉素、环丙沙星和甲氧苄啶/磺胺甲噁唑的耐药率均高于新生儿组。
3 讨论
2022年ISPED共监测有效分离菌50 399株,对12家单位提交的监测资料进行优势菌株分布、不同年龄组分离株分布及优势分离株在不同年龄组耐药现状进行分析。
本次监测数据显示:儿童分离前10位分离株依次为大肠埃希菌、流感嗜血杆菌、金黄色葡萄球菌、肺炎链球菌、卡他莫拉菌、凝固酶阴性葡萄球菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌及粪肠球菌;不同年龄组主要分离株有明显差异;MRDOs的检出率较往年无变化或呈现下降趋势,其中CRE和CR-PA在新生儿组检出率较高,而CR-AB在非新生儿组检出率较高。
2022年儿童分离株的菌谱构成与成人同期报道相比仍呈现显著差异,其中苛养菌如流感嗜血杆菌、肺炎链球菌和卡他莫拉菌在儿童中的占比位居前五位,明显高于成人报道[4]。除在2020年,流感嗜血杆菌占比均位于儿童分离株前5位[5]。与ISPED 2021年监测数据比较,流感嗜血杆菌的占比有所提高,从第4位上升至第2位,肺炎链球菌占比有所降低,从第2位下降至第4位。儿童分离株最主要的标本来源为下呼吸道标本,占比为46.7%,高于成人同期报道的37.8%[4];此外,流感嗜血杆菌、肺炎链球菌和卡他莫拉菌位居儿童下呼吸道标本前3位分离菌。中国CDC 2021年监测数据表明,肺炎链球菌和流感嗜血杆菌是儿童呼吸道感染最主要的致病菌,而在成人和老年群体中最主要的致病菌为铜绿假单胞菌[6]。因此,2022年ISPED监测数据提示:呼吸道感染是儿童最主要的感染类型,流感嗜血杆菌、肺炎链球菌和卡他莫拉菌在呼吸道中的高检出率使其在儿童中的总体检出率较高。
2022年监测数据表明,50 399株儿童分离株在不同年龄组和不同标本来源中的检出率有较大差异。①不同年龄组儿童的主要分离株呈现显著差异:大肠埃希菌是新生儿和>5岁儿童主要分离株,流感嗜血杆菌是婴儿组最主要分离菌,而肺炎链球菌在幼儿组至学龄前期组儿童群体中的占比最高,金黄色葡萄球菌是婴儿、幼儿和学龄期儿童占比第2位的分离菌。②不同标本来源的主要分离株有明显差异:下呼吸道主要分离株为流感嗜血杆菌、肺炎链球菌和卡他莫拉菌;大肠埃希菌是分泌物、脓液和尿液标本主要分离株;凝固酶阴性葡萄球菌、大肠埃希菌和金黄色葡萄球菌是血液标本主要分离株;肠道标本中主要分离株为沙门菌属和弯曲菌属。与2021年监测数据相比,金黄色葡萄球菌在新生儿中的占比有所降低,肺炎链球菌在婴儿中的占比有所降低[7]。因此,儿童分离株的分布特征每年有一定差异,应当加强持续监测。
1990至2017年,全球儿童和青少年因感染性疾病的死亡人数已经大幅减少,然而感染性疾病的发生率和对儿童造成的健康损害却有所增加,目前感染性疾病仍然是儿童健康的严峻威胁[8]。抗生素耐药(AMR)问题是全球公共卫生的紧迫威胁,《柳叶刀》一项研究表明:2019年超过120万人死于抗生素耐药性感染,高于艾滋病或疟疾造成的死亡;6种主要的耐药性病原菌包括多重耐药的大肠埃希菌、金黄色葡萄球菌、肺炎克雷伯菌、肺炎链球菌、鲍曼不动杆菌和铜绿假单胞菌;值得注意的是,幼儿是AMR导致死亡的极高风险人群,大约1/5的AMR死亡发生于5岁以下儿童[9]。本研究提示,MRDOs在儿童中均有检出:脑脊液和非脑脊液来源肺炎链球菌中PNSP的比例分别为88.9%和6.7%;MRSA、CRE、CR-PA和CR-AB的检出率分别为32.8%、4.5%、7.6%和24.3%。
ISPED监测数据表明,2022年儿童中MRSA的检出率为32.8%,相比2017至2020年的34.1%~36.8%和2021年的33.2%,已经呈现下降趋势[5],但略高于CHINET监测网2021年成人同期报道的30.0%[4]。CRE和CR-PA检出率较低,分别为4.5%和7.6%,相比2021年无明显变化。脑脊液来源肺炎链球菌中PNSP的比例较高(88.9%),相比2016年报道的86.2%和2020年报道的94.7%[3, 10],仍处于较高水平。CLSI[2]对肺炎链球菌青霉素耐药折点有2个标准,脑脊液来源肺炎链球菌:MIC≤0.06 μg·mL-1为敏感,MIC≥0.12 μg·mL-1为耐药;非脑脊液来源肺炎链球菌:MIC≤2 μg·mL-1为敏感,MIC=4 μg·mL-1为中介,MIC≥8 μg·mL-1为耐药。非脑脊液来源肺炎链球菌中PNSP的比例为6.7%,明显低于2021年的9.6%。此外,CR-AB的检出率为24.3%,相比ISPED之前报道,显示出持续降低趋势,且低于成人同期报道的65.6%~66.5%[4,5,7]。CR-PA检出率为7.6%,显著低于成人同期报道的18.9%~23.0%[4]。此外,MRSA对临床多种常用抗生素的耐药性高于敏感的MSSA菌株。可见,MRDOs在儿童中检出率呈现逐年降低趋势,应加强持续监测;除MRSA以外,儿童群体其他MRDOs菌株的检出率均较成人低,因此应高度警惕MRSA在儿童中的感染与传播。
近年来新生儿群体中多重耐药的革兰阴性菌(MDR-GN),尤其是CRE的比例显著增高,新生儿MDR-GN由定植转感染甚至爆发的事件已有报道[11,12]。ISPED 2022年监测数据显示,MRDOs的检出率在新生儿和非新生儿组中有较大差异,其中MRSA、CRE和CR-PA在新生儿组中的检出率高于非新生儿组。研究表明,新生儿CRE和CR-PA检出率高可能与新生儿免疫力不成熟和母亲分娩期间的肠杆菌目细菌的暴露有关[13];CRE导致的新生儿脓毒症的病死率高达33.3%[14]。由于新生儿有较多用药禁忌,多种临床常用抗生素,如氨基糖苷类、大环内酯类、复方磺胺类等不能应用于新生儿群体,新生儿感染MRDOs后可选用抗生素非常有限,因此应高度警惕新生儿群体MRDOs的感染[15]。头孢他啶/阿维巴坦作为新一代酶抑制剂复合制剂,对CRO感染的治疗具有显著疗效,而最新研究显示,新生儿感染的CR-KP中,新德里金属-β-内酰胺酶(NDM)所占比例高达68.0%,由于金属酶NDM无法水解头孢他啶/阿维巴坦,故使得该药在治疗新生儿CR-KP感染中作用十分有限[16]。目前,抗生素耐药问题是新生儿感染面临的最严峻的挑战,尽管预防感染和减少新生儿暴露和感染的风险非常重要,感染的早期及时监测及抗生素的合理使用是降低新生儿MDROs感染的关键因素[17]。
综上所述,儿童群体分离株的菌谱和分布特征与成人相比具有显著差异,不同年龄组儿童的主要病原菌亦有明显区别。由于我国近年来对抗菌药物合理使用的规范和要求,使得儿童群体MDROs检出率呈现持续下降趋势。新生儿尤其是早产儿由于免疫力低下,应当防范MDROs的感染,MRSA、CRE和CR-PA在新生儿的检出率较高,应加强新生儿群体的多重耐药菌主动筛查和预防措施,降低该群体MDROs的发生率。未来应继续加强儿童感染性病原菌的早期主动筛查和预防,规范抗生素的合理使用,提高抗生素使用前病原菌送检率,以期控制儿童感染性疾病的发生发展,降低MDROs对儿童群体的健康威胁。
