慢性阻塞性肺疾病急性加重期合并肺动脉高压的高危因素分析
2023-12-14涂友慧胡先纬尤青海
涂友慧 胡先纬 尤青海
肺动脉高压是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)进展过程中的重要病理生理特征,其形成机制与肺血管床减少、慢性缺氧及慢性气道炎症所致肺动脉收缩和血管重塑有关[1-2]。研究显示肺动脉高压在COPD患者中的发生率主要取决于疾病的严重程度,多数患者表现为中度增高,约1%~4%患者有严重肺动脉压力增高[3-5]。虽然COPD患者肺动脉压力增高趋势较慢[6],但肺动脉压力是影响COPD患者死亡率的重要负性调控因素。既往研究表明平均肺动脉压力大于25 mmHg的COPD患者5年生存率仅36%[7-9]。早期识别及诊治肺动脉高压对改善COPD患者疾病预后具有重要意义。本研究通过回顾性分析合并肺动脉高压的AECOPD患者的相关临床特征,探索AECOPD合并肺动脉高压的高危临床因素。
资料与方法
一、纳入和排除标准
回顾性连续纳入安徽医科大学第一附属医院2019年6月至2022年5月于呼吸与危重症医学科住院的AECOPD患者。研究方案经安徽医科大学第一附属医院伦理委员会批准(PJ2023-05-41)。入选标准:年龄大于等于18岁。既往诊断慢阻肺明确(慢阻肺诊断标准及慢阻肺急性加重标准均符合2018年慢阻肺全球防治倡议)。临床资料完整。排除标准:合并支气管扩张、间质性肺疾病等其他慢性肺部疾病。合并肺动脉栓塞相关的肺动脉高压。既往诊断由其他疾病(肺血管畸形、先天性心脏病、风湿性心脏病等)所致的肺动脉高压。长期服用可导致肺动脉压力增高或降低的药物。
二、信息收集
通过使用东华电子病历系统收集AECOPD患者的临床基本信息及相关检验检查数据,基本信息包括性别、年龄、身高、体重、吸烟指数、动脉血气分析、血常规、肝肾功能、心肌酶谱、凝血指标、C-反应蛋白、脑钠肽、超声心动图、肺功能参数、胸部CT等。参考2015年欧洲心脏协会/欧洲呼吸协会的肺动脉高压诊断和治疗标准。超声心动图检测三尖瓣返流估测的右心室压力(right ventricular systolic pressure,RVSP)大于等于40 mmHg考虑合并肺动脉高压[10]。符合入院标准的AECOPD患者,根据其是否合并肺动脉高压,分为AECOPD合并肺动脉高压组和AECOPD不伴有肺动脉高压组。
三、统计分析
采用SPSS 26.0软件处理两组间的相关临床数据,非正态分布资料采用中位数描述,组间比较采用Mann-WhitneyU检验;分类资料比较采用卡方检验。单因素有意义的进一步采用多元Logistic回归进一步分析比较。采用Spearman比较有意义的临床高危因素与右心室压力的相关性分析。以P值<0.05为差异有统计学意义。
结 果
一、一般资料比较
389例AECOPD患者参与评选,根据入选标准及排除标准,其中临床数据(缺乏肺功能/心脏彩超/心肌酶谱/血气分析等数据)不完整者228例,合并支气管扩张者32例,合并间质性肺疾病者26例,服用安立生坦者(降低肺动脉压力)3例,最终纳入研究病例100例,其中男性91例,女性9例,100例入选患者中位年龄71.49岁。依据超声心动图RVSP超过40 mmHg考虑为合并肺动脉高压并进行分组,其中AECOPD合并肺动脉高压组54例,AECOPD不伴有肺动脉高压组(AECOPD组)46例。利用PASS 15软件计算,输入两组实际样本量(54vs46),考虑本研究拟观测的众多变量组间差异,根据各指标变化值的实际临床意义,设置效应大小(difference in means)为0.6 to 2 by 0.1,要达到0.05的检验水准,统计效能均可达0.84以上,基本满足本研究样本量需求。两组患者间一般临床资料(见表1)。
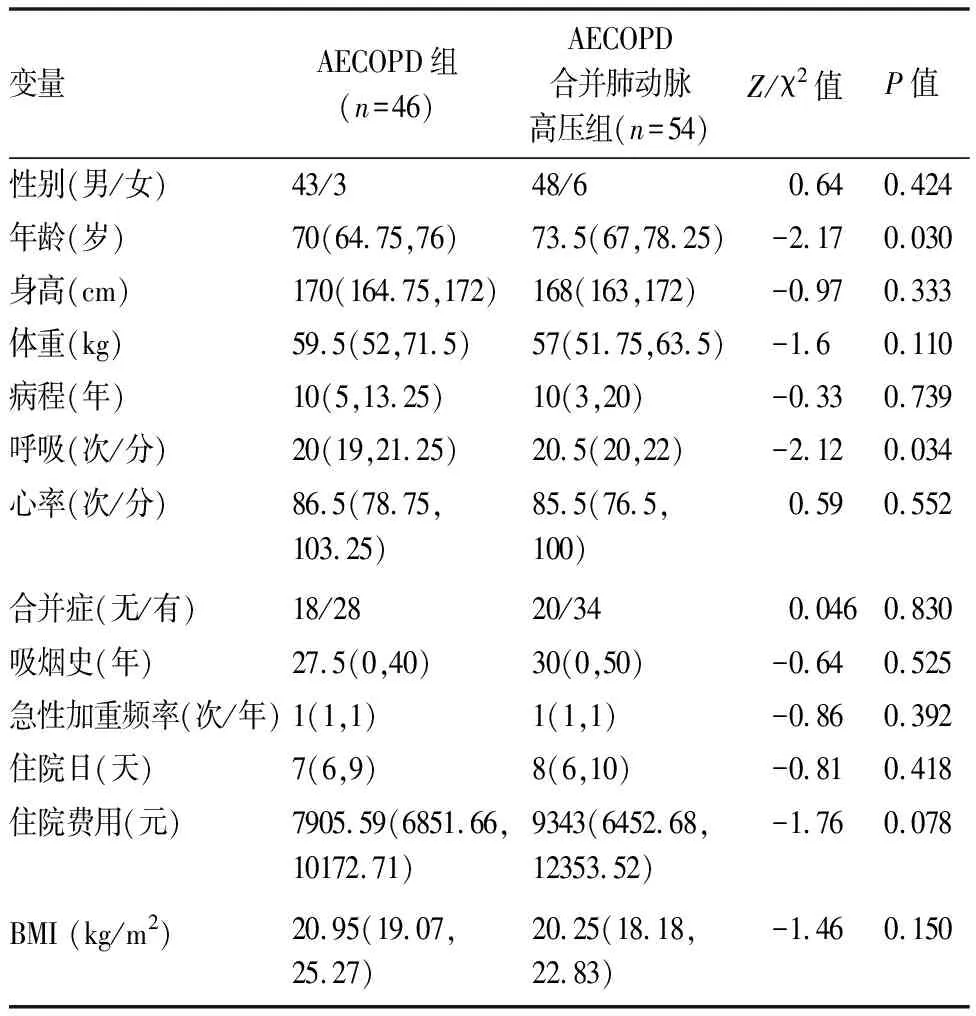
表1 两组间临床基本特征的组间比较[M(P25,P75)]
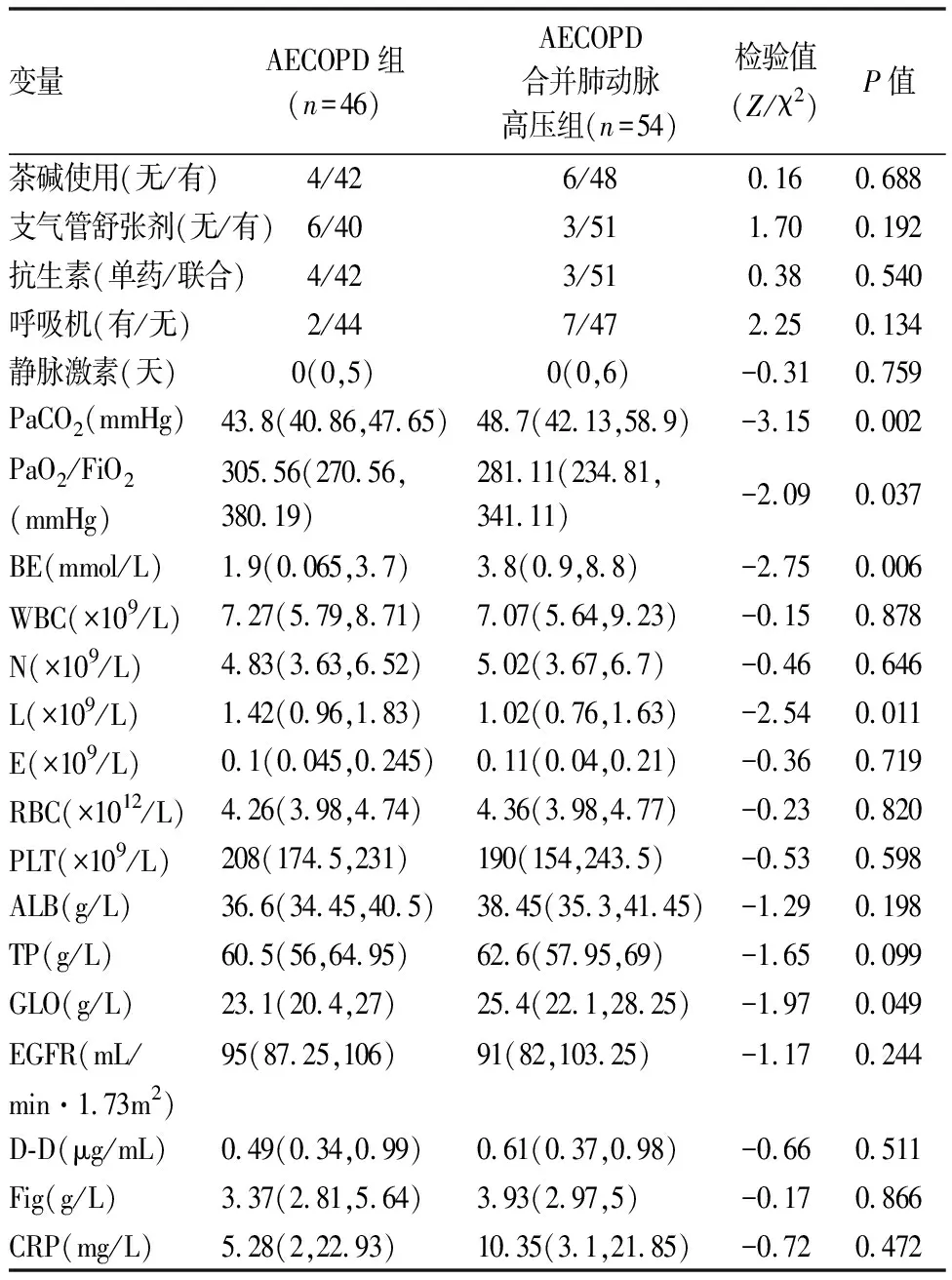
表2 两组间治疗药物、血实验室数据比较[M(P25,P75)]
二、临床资料比较
AECOPD合并肺动脉高压组年龄显著高于AE-COPD组(73.5岁vs70岁,P=0.030)。AECOPD合并肺动脉高压组患者入院时呼吸频率、PaCO2、剩余碱及球蛋白显著高于AECOPD组;AECOPD合并肺动脉高压组患者氧合指数(PaO2/FiO2)、血淋巴细胞计数显著低于AECOPD组(P均<0.05)。两组患者的病程、吸烟史、BMI、心率、性别、CRP、凝血指标、平均住院时间、合并症、静脉使用激素情况、抗生素使用情况(单用或联合用药)、支气管舒张剂的使用、呼吸支持(包括有创和无创机械通气)、住院费用均无明显统计学差异,具体结果(见表1,2)。同时,比较两组患者的肺功能参数(FEV1% pred,FEV1/FVC,PEF,MEF75%,MEF50%,MEF25%)、心脏彩超指标(AO,LA,IVSD,LVD,SV,EF,FS,LVPWD) 和胸部CT轴向肺动脉主干内径/升主动脉内径比值,均未见明显统计学差异(P均>0.05)。AECOPD合并肺动脉高压组患者心脏彩超右心室压力显著高于AECOPD组(P<0.05),具体结果(见表3)。
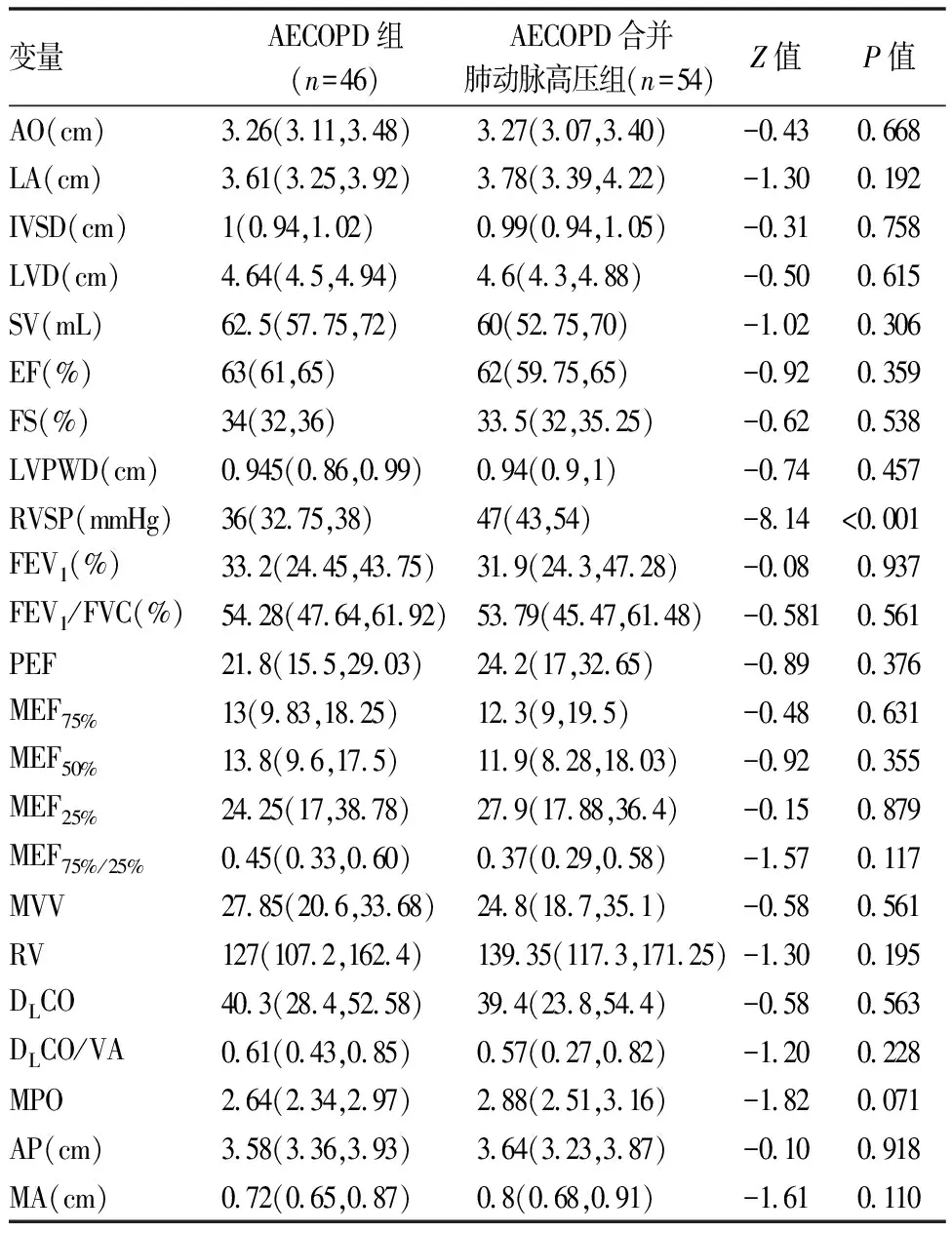
表3 两组间心脏彩超、肺功能及胸部CT参数比较[M(P25,P75)]
三、Logistic回归分析及相关性分析
通过组间比较提示年龄、入院时呼吸频率、高PaCO2、高剩余碱、低氧合指数(PaO2/FiO2)、高球蛋白和低淋巴细胞计数在两组间具有统计学意义。进一步采用多元Logistic回归分析提示年龄及高PaCO2为AECOPD合并肺动脉高压的高危因素(如表4)。
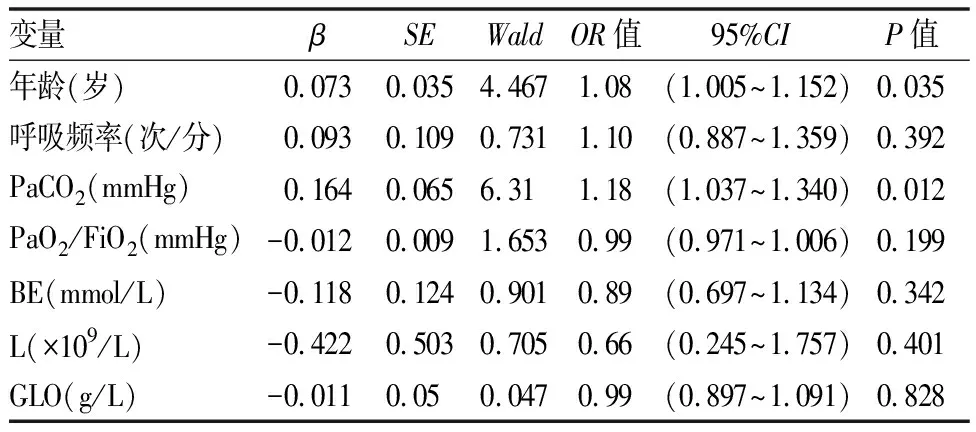
表4 AECOPD患者合并肺动脉高压的临床高危因素的Logistic回归分析
为进一步分析AECOPD肺动脉压力与临床高危因素间的相关性,采用Spearman相关性分析比较有意义的临床高危因素与右心室压力的相关性。结果显示PaCO2、入院时呼吸频率、剩余碱与右心室压力呈显著正相关(P值<0.05),而氧合指数(PaO2/FiO2)、淋巴细胞与右心室压力呈显著负相关(P值<0.05),具体(见表5)。
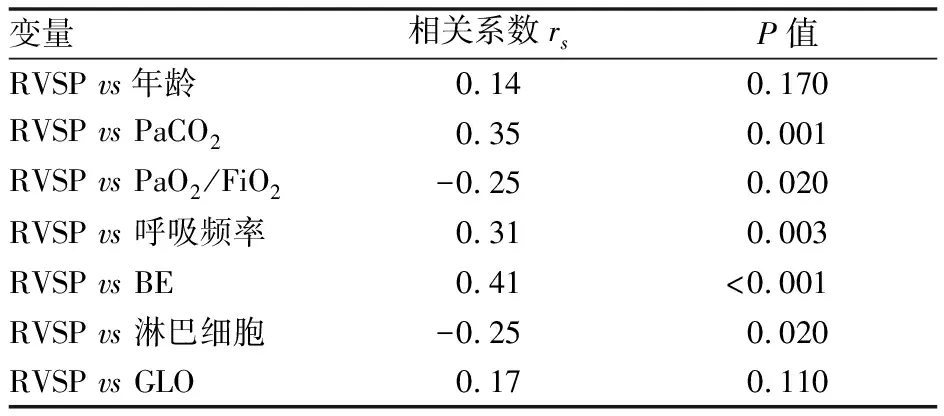
表5 AECOPD患者合并肺动脉高压的临床高危因素与右心室压力的相关性分析
讨 论
本研究通过回顾性研究分析发现AECOPD合并肺动脉高压组患者入院时呼吸频率、PaCO2、剩余碱及球蛋白显著高于不伴有肺动脉高压组,而氧合指数(PaO2/FiO2)、血淋巴细胞计数显著低于不伴有肺动脉高压组。采用多元Logistic回归分析提示高龄及高PaCO2是AECOPD患者合并肺动脉高压的独立临床高危因素。
COPD是肺部疾病低氧所致肺动脉高压最常见的病因之一[11],研究显示COPD相关肺动脉高压的患病率在20%~91%[12-13],而有关AECOPD合并肺动脉高压的患病率鲜有报道,本研究中AECOPD合并肺动脉高压患病率为54%,显著高于代灵灵等人报道的住院AECOPD患者肺动脉高压患病率为21.5%[14],分析原因可能与两者纳入标准、排除标准以及人群分布特征不同等有关。年龄是AECOPD患者合并肺动脉高压的易感因素,这可能与在生理状态下,肺血管内皮细胞及肺血管平滑肌随年龄的增加出现功能紊乱有关[15]。淋巴细胞是机体重要的炎症及免疫细胞,气道、肺实质和肺血管的慢性炎症反应是慢阻肺的特征性改变,也是参与COPD发生发展的重要发病机制之一[16]。本研究中AECOPD合并肺动脉高压组患者的血淋巴细胞计数显著低于不伴有肺动脉高压组,这与既往研究结果相一致[14]。分析可能与AECOPD患者机体炎症细胞活化并消耗,激活下游的细胞炎症因子分泌及基质金属蛋白酶的合成,促进肺血管收缩及重塑有关[17]。球蛋白是一种具有免疫功能的血清蛋白,常在机体遭遇外来刺激时由肝脏代偿性分泌产生。本研究中发现AECOPD合并肺动脉高压组血球蛋白显著高于不伴有肺动脉高压组,这在既往相关研究中鲜有报道,分析原因可能与肺动脉高压时继发的右心功能不全、肝淤血、肝脏代偿性分泌球蛋白增加有关,具体有待于进一步的临床及分子研究报道。
肺通气功能障碍是COPD早期病理生理改变,在疾病后期由于肺泡和毛细血管丧失、弥散面积减少,继发出现肺换气功能障碍,从而出现缺氧和CO2潴留,患者可出现不同程度的低氧血症和高碳酸血症[18-19]。本研究发现AECOPD合并肺动脉高压组PaCO2、剩余碱显著高于无肺动脉高压组,而氧合指数(PaO2/FiO2)显著减低,且相关性研究分析发现PaCO2、剩余碱与右心室压力显著正相关,氧合指数(PaO2/FiO2)与右心室压力显著负相关,与Liu等[20]研究发现高碳酸血症及低氧血症是导致慢性肺部疾病患者平均肺动脉压力增高的独立因素基本一致。分析与急性加重期COPD患者体内低氧血症及高碳酸血症进一步加重,继发导致肺血管收缩和重塑、血管内皮细胞及血管平滑肌功能障碍,增加肺动脉压力及右心负荷密切相关[2]。由此我们推测降低或消除高PaCO2可能是降低AECOPD患者合并肺动脉高压的一种临床治疗策略。
综上所述,本研究通过回顾性分析比较AECOPD伴和不伴有肺动脉高压患者的临床特征,结果发现高龄及高PaCO2可能是AECOPD合并肺动脉高压的临床高危因素。为临床上医务工作者早期发现并治疗AECOPD患者合并肺动脉高压提供一定的临床依据及治疗策略。然而,本研究为单中心回顾性研究,研究结论可能存在一定偏倚及局限性,有待于进一步的多中心及前瞻性临床研究支持及验证。
