利用叶片结构、生理及转录组分析雾冰藜干旱胁迫响应机制
2023-12-11谭炯锐查同刚张泽宇张晓霞滕红梅李成奇王玲丽赵莉丽姚紫懿
谭炯锐,查同刚,张泽宇,张晓霞,滕红梅,李成奇,王玲丽,赵莉丽,王 奥,姚紫懿
(1.运城学院生命科学系, 山西 运城 044000;2.北京林业大学水土保持学院, 北京 100083;3.中建一局集团第三建筑有限公司, 北京 100161;4.北京八达岭林场, 北京 102102)
干旱和半干旱荒漠区降水极少、地表温度高、温差大、土壤贫瘠且盐碱化程度高、风蚀水蚀强烈,水土流失严重。生长在干旱半干旱荒漠区的植物,在长期的自然进化中形成了多样性较高的干旱胁迫适应策略,因此荒漠植物对干旱胁迫的适应和响应研究一直是荒漠生态研究的热点。
植物对干旱胁迫的响应过程包括胁迫感知、信号转导和抗旱相关基因表达。脱落酸(abscisic acid,ABA)信号通路是植物应对干旱胁迫的核心信号通路,ABA 通过抑制PP2Cs的表达来激活SnRK2s,被激活的SnRK2s可磷酸化下游干旱胁迫响应基因[1]。此外生长素(auxin, IAA)、乙烯(ethylene)和茉莉酸(jasmonic acid, JA)等激素信号通路也参与干旱胁迫响应调节。钙离子(Ca2+)是第二信使,干旱胁迫时Ca2+通道感知细胞膨压降低,使膜内产生Ca2+峰值[2]。Ca2+信号可激活CPKs和CBLs-CIPKs参与信号的检测和传递[1]。丝裂原活化蛋白激酶(MAPK)家族成员也参与非生物胁迫信号的传递[3]。活性氧(reactive oxygen species, ROS)也作为信号分子参与干旱胁迫响应[4]。转录因子在从信号接收到干旱胁迫相关基因表达的中间过程发挥着重要的信号级联作用[5]。
胁迫信号的成功转导启动后续生理和形态层面的干旱恢复机制。形态方面如较厚的表皮、栅栏组织,较发达的维管束鞘,叶片面积缩小而厚度增加等;生理方面如渗透调节、光合响应、呼吸作用等。植物积累脯氨酸、可溶性蛋白、糖、生物碱等代谢物质维持渗透平衡[6-7]。对于过量的ROS,植物可以通过酶促防御系统(SODs、PODs、CATs 和硫氧还蛋白等)和非酶自由基清除剂(脯氨酸、谷胱甘肽、抗坏血酸和黄酮类等)抵御氧自由基破坏、保护细胞膜系统的完整性[5]。
植物生理和形态层面的干旱胁迫响应过程均受到基因表达的调控,为了探究与干旱相关的基因表达网络及其调控机制,已经有大量关于模式植物和作物的抗旱转录组测序研究。而对荒漠区植物抗旱机制的转录组测序研究相对较少,近年来可见到梭梭(Haloxylon ammodendron)[8]、柠条(Caragana korshinskii)[9]、白 刺(Nitraria tangutorum)[10]、苜 蓿(Medicago falcata)[11]、 沙 冬 青 (Ammopiptanthus mongolicus)[12]和胡杨(Populus euphratica)[13]等植物的报道。一年生草本植物雾冰藜(Bassia dasyphylla)为藜科樟味藜族雾冰藜属,常分布于荒漠、半荒漠区和盐碱地[14]。雾冰藜耐旱抗风沙,是干旱区退化土地植被恢复初期的优势物种[15],具有优异的抗旱基因资源。目前对雾冰藜抗旱性的研究多为形态结构和生理层面等的研究[16-17],对雾冰藜抗旱分子机制的研究鲜见报道。因此本研究以内蒙古乌拉山矿山废弃地周边优势物种雾冰藜为研究对象,对播种盆栽苗进行干旱胁迫梯度处理,研究其在不同程度干旱胁迫下叶片解剖结构、生理指标和基因表达的响应变化。研究结果为雾冰藜抗旱分子机制解析提供理论支撑,也为荒漠植物抗旱基因资源的挖掘利用提供参考。
1 材料与方法
1.1 材料栽培与处理
雾冰藜种子采自内蒙古乌拉山矿山废弃地周边。选用高15.2 cm、内径18.5 cm 的塑料盆进行温室盆栽,泥炭土和珍珠岩(3 ∶ 1)混合基质,每盆播种30 粒。温室光照12 h,光强520 μmol·(m2·s)-1,温度25 ℃,湿度50%。对长势一致的雾冰藜设5 个干旱胁迫梯度处理,每处理10 盆。播种后30 d 开始控水处理,并根据土壤相对含水量划分胁迫等级[18]:(1)胁迫0 d,田间持水量的80%;(2)胁迫7 d,田间持水量的61%,轻度水分胁迫;(3)胁迫14 d,田间持水量的49%,中度水分胁迫;(4)胁迫21 d,田间持水量的42%,中度水分胁迫;(5)胁迫28 d,田间持水量的36%,重度水分胁迫。采集各处理枝条中部大小一致的成熟叶片用于后续测定。各处理均匀混合样采后一部分立即投于液氮,存于-80 ℃冰箱用于提取RNA 和生理指标测定;另一部分投入福尔马林-乙酸-乙醇(FAA)固定液(18 ∶ 1 ∶ 1),用于石蜡切片。
1.2 石蜡切片及分析
用FAA 固定的叶片经酒精梯度脱水,无水乙醇、二甲苯透明,用二苯甲苯和石蜡溶液进行浸蜡处理,然后包埋。切片番红固绿染色、透明、干燥,中性树胶封片。Nikon Eclipse Ci-S 显微镜观察并拍照,用CaseViewer 2.3 软件测量表皮厚度、叶片厚度、贮水组织厚度和主维管束面积,每个处理10 个重复。
1.3 生理指标测定及分析
酸性茚三酮法测定脯氨酸含量,考马斯亮蓝 G-250 染色法测定可溶性蛋白含量,四氯化钛比色法测定过氧化氢含量,硫代巴比妥酸比色法(TBA)测定丙二醛(malondialdehyde, MDA)含量,愈创木酚显色法测定过氧化物酶(peroxidase activity, POD)活性,氮蓝四唑(NBT)染色法测定超氧化物歧化酶(superoxide dismutase, SOD)活性,紫外吸收法测定过氧化氢酶(catalase, CAT)活性[19],每个处理6 次重复。
1.4 转录组测序及分析
叶片总RNA 用植物总RNA 提取试剂盒(天根生化科技北京有限公司)提取,按说明书操作具体步骤,每个处理3 次重复。对RNA 进行质量检测,合格后进行建库测序。对raw data 进行过滤后得到高质量clean data。利用Trinity (http://trinityrnaseq.git hub.io/)软件进行拼接。对拼接后得到的基因进行基因功能注释(5 大数据库Nr,Pfam,Swiss-prot,KEGG,GO)。利用FeatureCounts 软件将每个基因在不同样本中表达量进行FPKM 值的计算。样品间基因表达差异,用 DESeq2 进行差异表达分析,将padj <0.05,|log2fold change| ≥ 1 作为差异显著性的筛选标准。差异表达基因(differentially expressed genes, DEG)的GO (Gene Ontology)富集分析使用GOseq,用KOBAS 2.0进行KEGG (Kyoto Encyclopedia of Genes and Genomes)富集分析,P< 0.05。胁迫相关通路和差异表达基因用mapman 软件进行分析和作图。
1.5 实时荧光定量 PCR
在比较组7 d 与0 d、14 d 与0 d、21 与0 d 和28 d 与0 d 的差异表达基因中随机选6 个基因,进行qRT-PCR 分析,内参基因为EF1A(表1)。使用反转录试剂盒Prime ScriptTMRT (Takara)对RNA 进行反转录得到cDNA。实时荧光定量PCR 采用SYBR Green I dye (Takara)进行,扩增体系为95 ℃ 3 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,共35 个循环;72 ℃10 min[20]。每个处理3 次生物学重复,每次生物学设3 次技术重复。
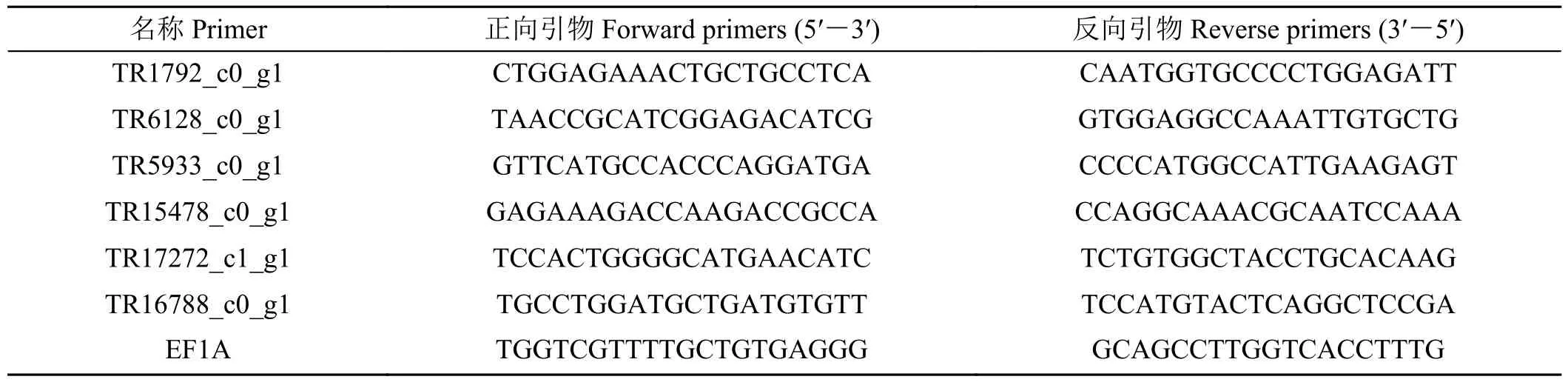
表1 差异表达基因引物序列Table 1 Primers of differentially expressed genes
1.6 数据分析
叶片解剖结构和生理指标数据用SPSS 17.0 软件进行统计分析,结果数据表示为平均值 ± 标准误。对不同处理数据的差异显著性分析用单因素方差分析法,多重比较用LSD 法进行。
2 结果
2.1 干旱胁迫下雾冰藜叶片解剖结构变化
雾冰藜的表皮细胞排列较整齐,向内较长的圆柱形细胞为叶肉细胞,可见含晶细胞。维管束和叶肉细胞之间有薄壁细胞构成的维管束鞘。叶肉细胞、维管束鞘细胞和维管束共同构成弧形结构,而非闭合的环形结构。弧形结构内是薄壁细胞构成的发达的贮水组织,贮水组织中间的维管束较大。胁迫0 d时,叶肉细胞较整齐地排列在弧形外侧,偶有含晶细胞,贮水组织细胞充盈;7 d 时,部分贮水组织细胞缩小,含晶细胞增多;14 d 时弧形结构的连续性变差,贮水组织薄壁细胞的细胞壁向外凸起;21 d 时贮水组织薄壁细胞缩小变薄;28 d 时表皮向内皱缩,贮水组织极度收缩,含晶细胞在维管束之外(图1)。
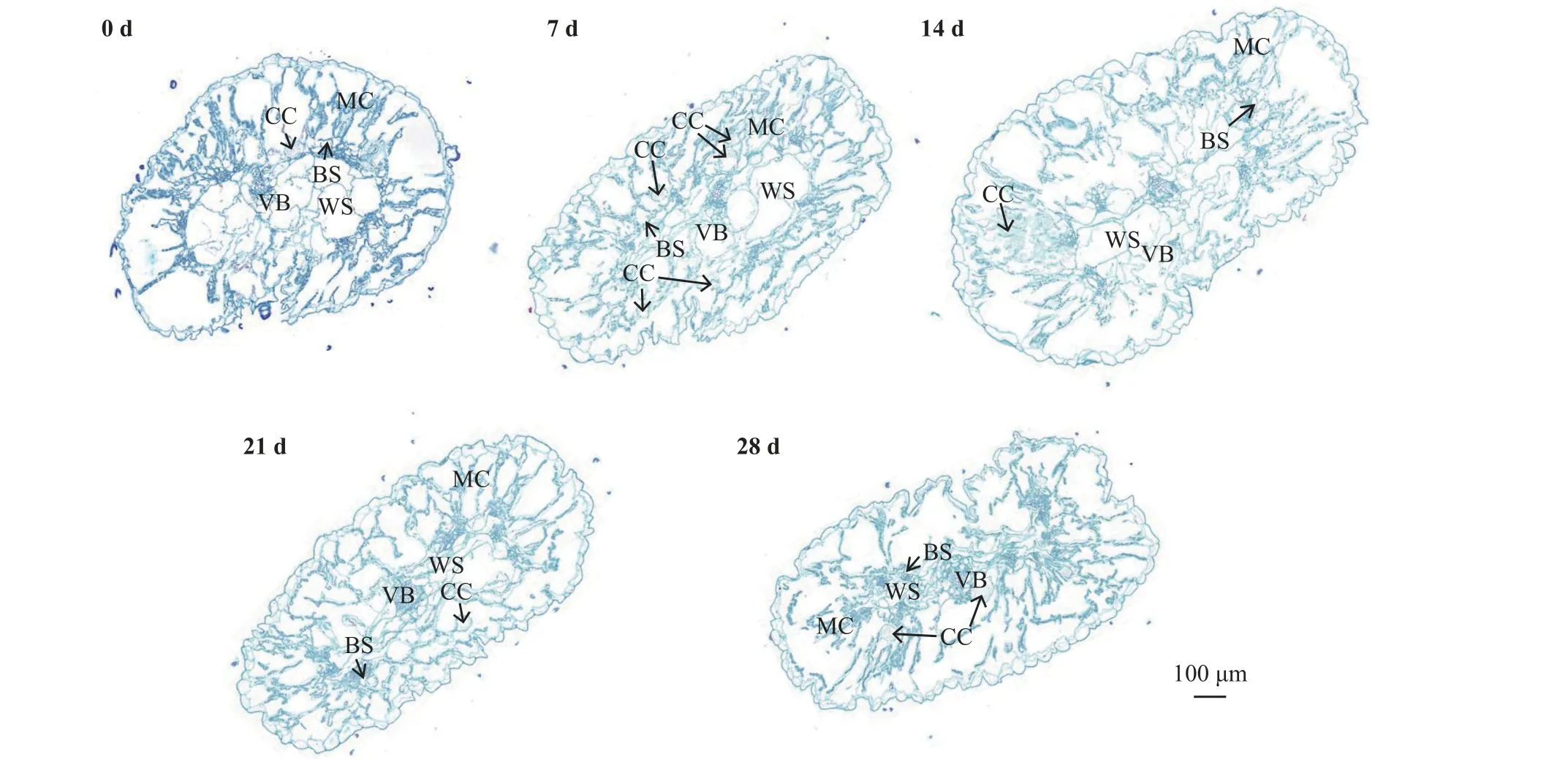
图1 不同程度干旱胁迫下雾冰藜叶片解剖结构Figure 1 Anatomical structures of the leaves of Bassia dasyphylla under different degrees of drought stress
贮水组织厚度随干旱胁迫时间延长逐渐降低,28 d 时降到最低(106.93 μm)。主维管束面积在干旱胁迫下先减小后增大,14 d 时最小(3 386.23 μm2)。叶片厚度随干旱胁迫呈先增后减的变化,胁迫7 和14 d 时显著增加(P< 0.05)。表皮厚度随干旱胁迫呈先增后减的变化,胁迫7 d 时最厚(42.73 μm) (表2)。

表2 雾冰藜叶片解剖结构各参数随干旱胁迫的变化Table 2 Changes of anatomical parameters of leaves of Bassia dasyphylla with drought stress
2.2 干旱胁迫下雾冰藜叶片生理指标变化
干旱胁迫下雾冰藜叶片可溶性蛋白含量无显著变化。脯氨酸含量在干旱胁迫21 d 时最高(P<0.05),为49.68 μg·g-1。SOD 在干旱胁迫28 d 时活性最高,但与胁迫21 d 相比差异不显著(P> 0.05),干旱胁迫7 d 时活性显著低于除胁迫14 d 外的其他处理。POD 活性随干旱胁迫先升高后降低,14 d 时活性最高(P< 0.05),为38.08 U·g-1。干旱导致CAT活性降低(P< 0.05)。过氧化氢含量随干旱胁迫先升高后降低,14 和21 d 时显著高于其他处理。21 d时丙二醛含量最低(P< 0.05),为17.39 nmol·g-1(表3)。
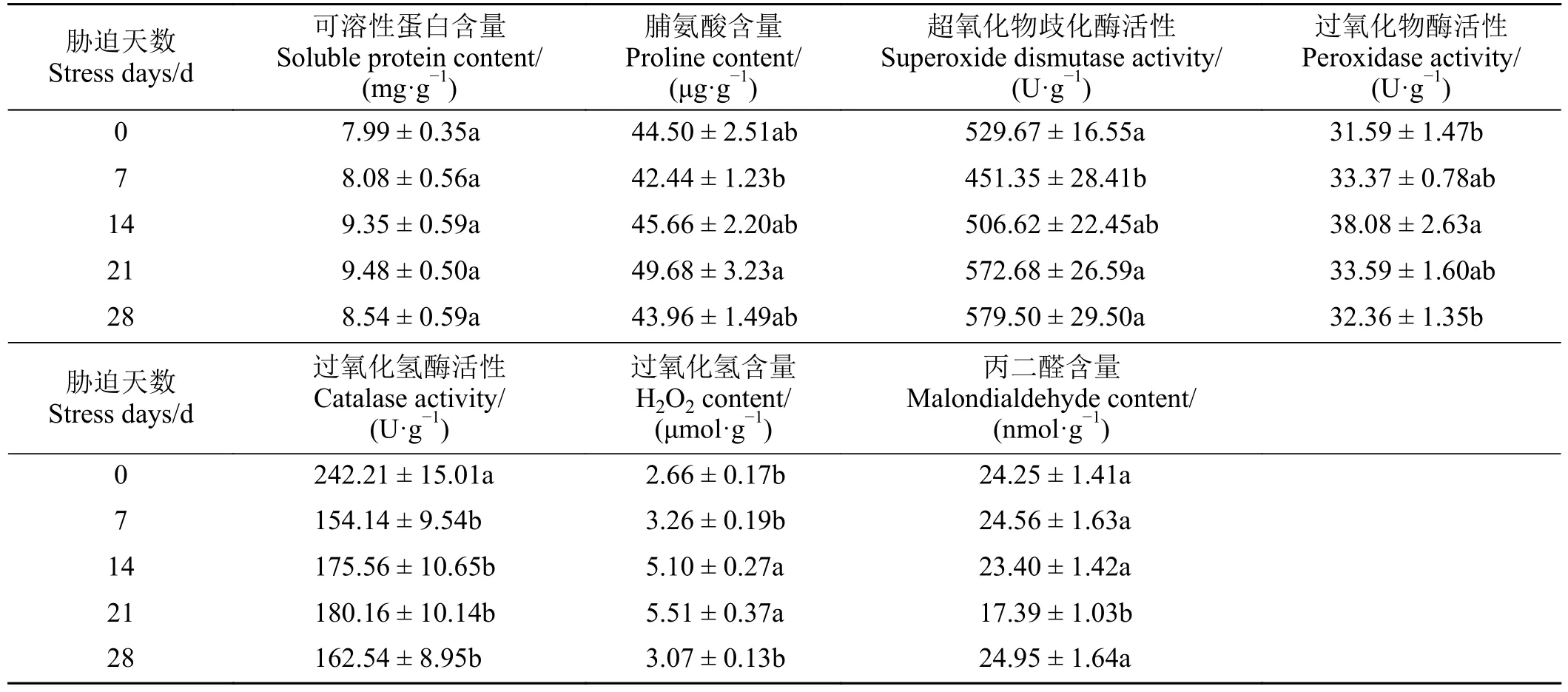
表3 雾冰藜叶片生理指标随干旱胁迫的变化Table 3 Changes of physiological indexes of leaves of Bassia dasyphylla with drought stress
2.3 干旱胁迫下雾冰藜转录组分析
雾冰藜转录组测序各样本测序数据量均高于6 G。每个文库的clean reads 大于4 900 万条,共15 个文库超过7 亿条。每个样品文库的Q30 高于95%,Q20 高于98%,GC 碱基比例均大于46%,测序质量满足高通量测序的要求。干旱胁迫7 d 与0 d 比较组鉴定出1 860 个DEGs,17 个下调基因,1 843 个上调基因;干旱胁迫14 d 与0 d 比较组鉴定出2 781 个DEGs,210 个下调基因,2 571 个上调基因;干旱胁迫21 d 与0 d 比较组鉴定出1 550 个DEGs,101 个下调基因,1 449 个上调基因;在干旱胁迫28 d 与0 d 比较组鉴定出819 个DEGs,443 个下调基因,376 个上调(图2)。实时荧光定量PCR 结果与转录组测序结果的相关性高于0.87 (图3),说明转录组测序准确可靠。
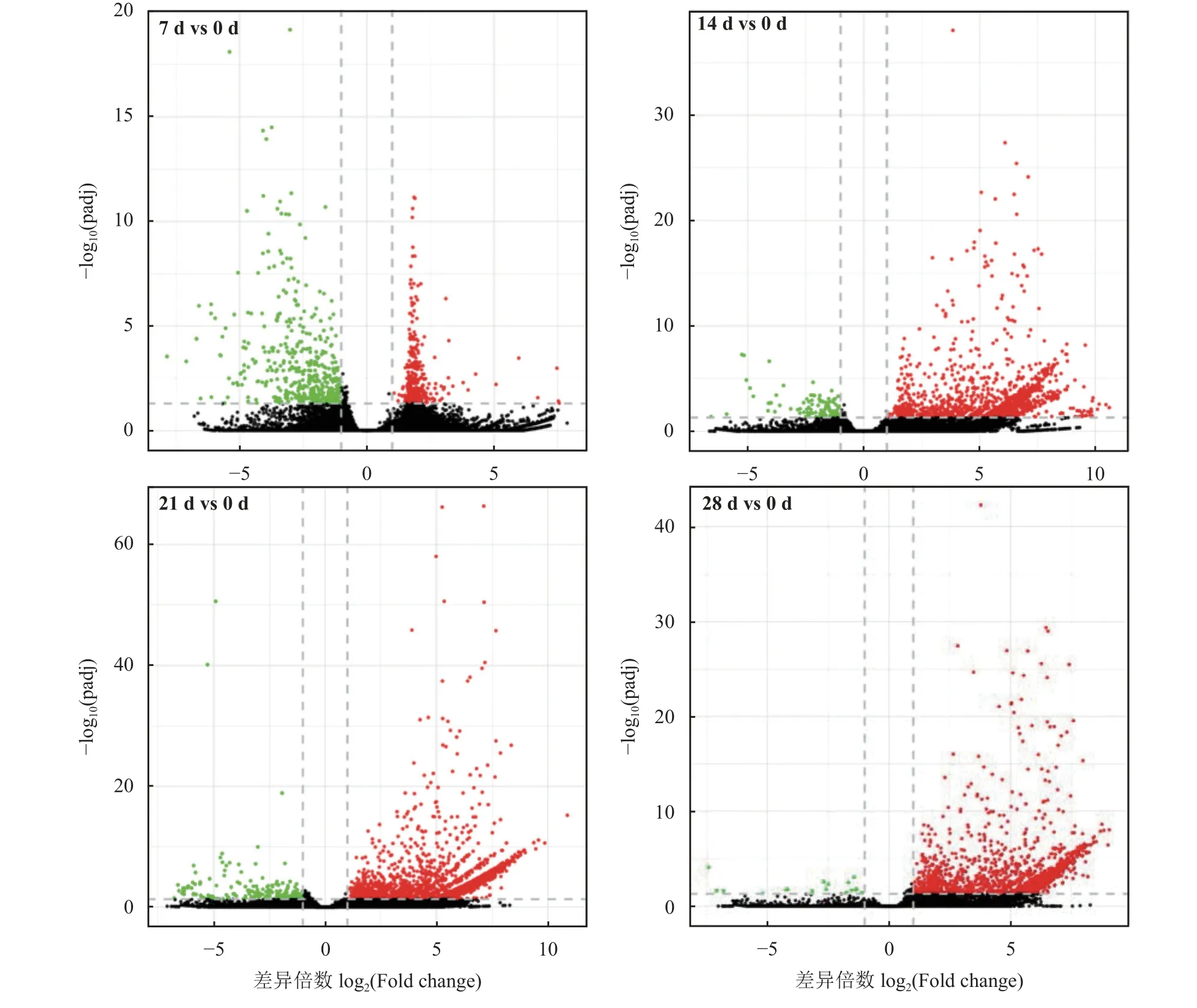
图2 不同程度干旱胁迫差异表达基因火山图Figure 2 Volcano plots of differentially expressed genes under different degrees of drought stress
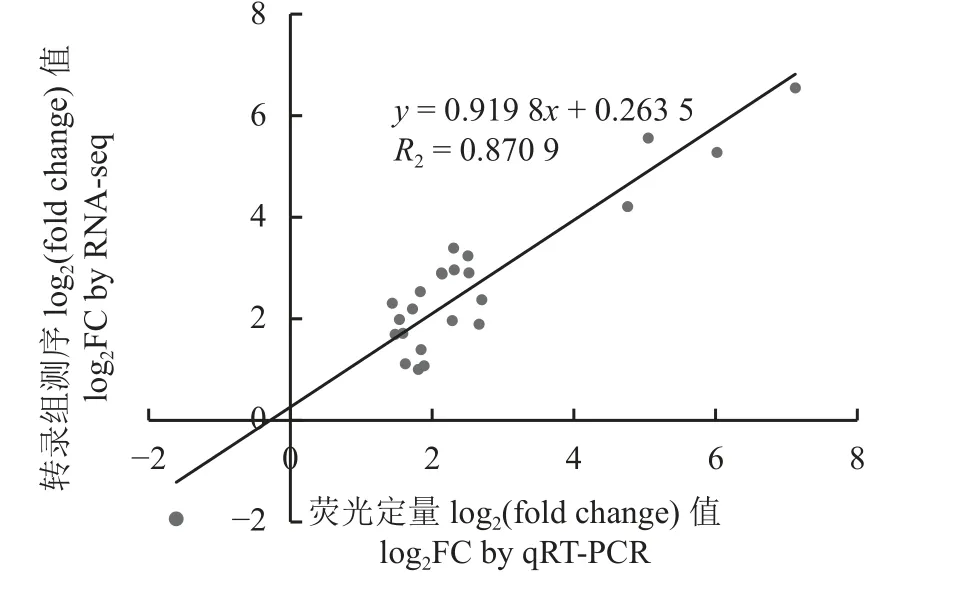
图3 实时荧光定量PCR 验证RNA-seq 数据Figure 3 Real-time fluorescence quantitative PCR validation RNA-seq data
2.4 差异表达基因GO 功能显著性富集分析
GO 富集分析结果表明,在7 d 时差异表达基因主要富集在有机氮复合代谢过程、有机氮化合物的生物合成过程、蛋白结合、分子功能、细胞外外泌体、细胞外细胞器等条目。干旱胁迫14 d 时,主要富集在氧化磷酸化、有机氮复合代谢过程、蛋白结合、结合、细胞外外泌体、细胞外细胞器等条目。干旱胁迫21 d 时,防御反应、细胞对细胞因子刺激的反应、分子功能、杂环化合物结合、细胞外外泌体、细胞外细胞器等条目。干旱胁迫28 d 时,主要富集在嘌呤核糖核苷酸的代谢过程、ATP 代谢过程、电子转移活性、阳离子转运ATP 酶活性、细胞质部分和线粒体包膜等条目中(表4)。

表4 差异表达基因GO 富集前5 名条目Table 4 Top 5 terms of GO enrichment analysis of the differentially expressed genes
2.5 差异表达基因 KEGG 富集分析
KEGG 富集分析结果(表5)表明,在干旱胁迫7 d时,差异表达基因主要富集在核糖体、氧化磷酸化、蛋白酶体、剪接体、细胞衰老等通路中;干旱胁迫14 d时,主要富集在核糖体、氧化磷酸化、坏死性凋亡、蛋白酶体、光合作用等通路中;干旱胁迫21 d 时,主要富集在核糖体、氧化磷酸化、坏死性凋亡、碳代谢、蛋白酶体等通路中;干旱胁迫28 d 时,主要富集在氧化磷酸化、代谢途径、戊糖和葡糖醛酸盐的相互转化、双组分系和柠檬酸循环(TCA 循环)等通路中。
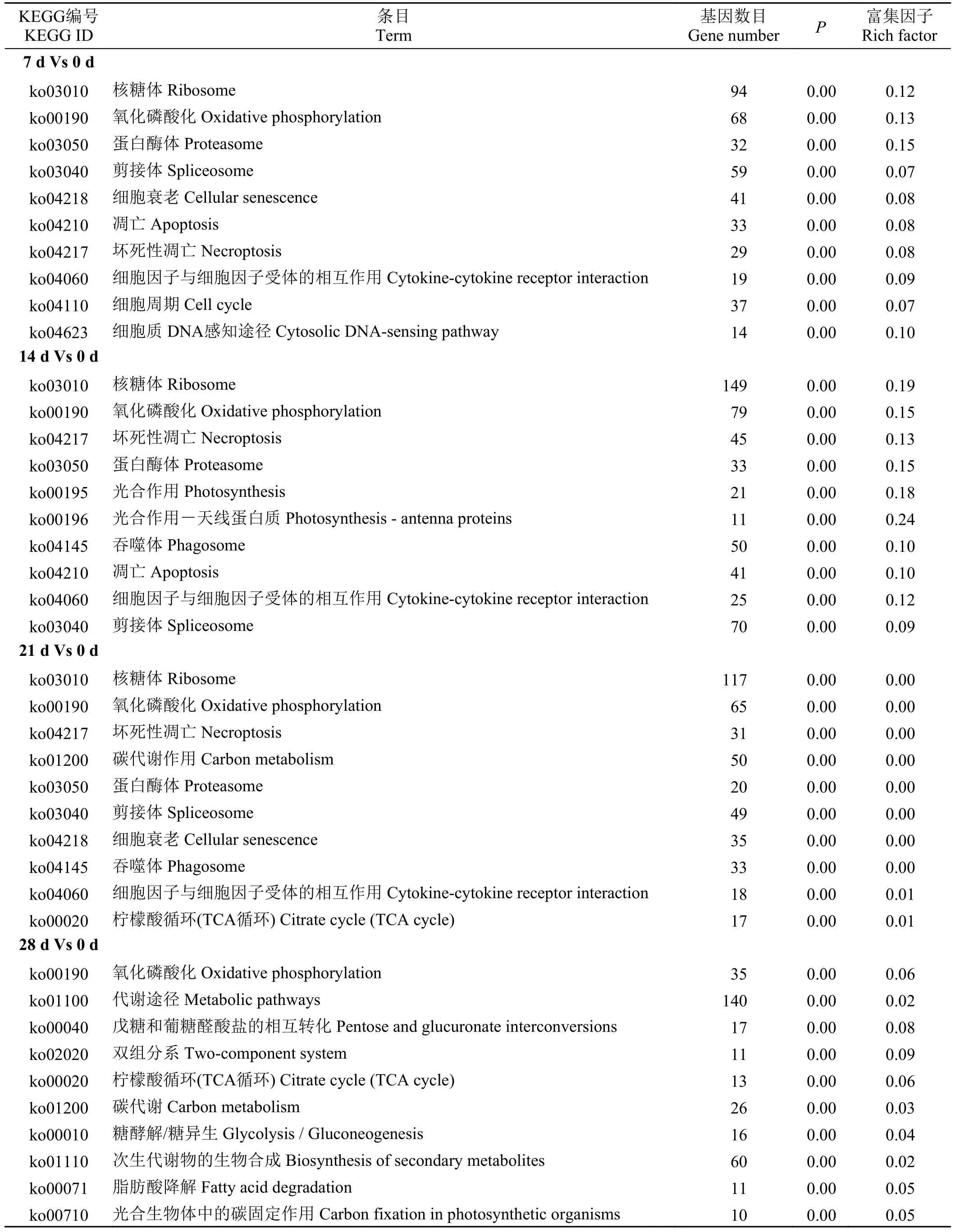
表5 差异表达基因KEGG 富集分析Table 5 KEGG enrichment analysis of differentially expressed genes
2.6 氧化磷酸化通路差异表达基因分析
氧化磷酸化途径差异表达基因随干旱胁迫的变化趋势总体聚为两簇,靠下的一簇基因数量更多,受到干旱胁迫后先上调表达,随后下调表达,干旱胁迫28 d 时表达量最低;靠上的一簇基因在受到干旱胁迫后持续上调表达(图4)。持续上调表达的基因包括复合物Ⅰ (NADH 脱氢酶)的成员ND5、NDUFS2和NDUFV1,复合物Ⅲ (细胞色素bc1 复合体)的成员UQCRFS1等,复合物Ⅳ (细胞色素c 氧化酶)成员COX1和COX3等和复合物(ATP 合成酶)的成员ATPeF1D和ATPeF0C等(图4)。
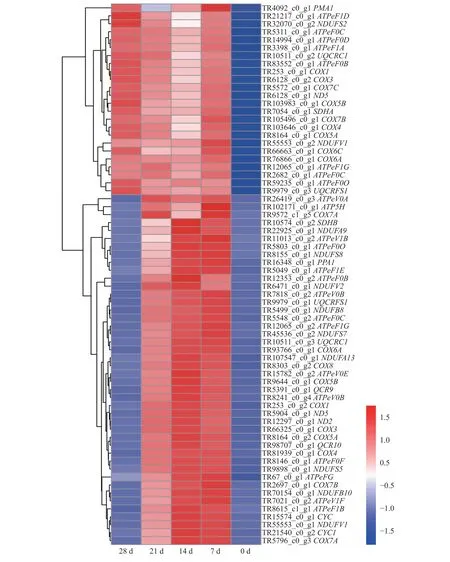
图4 氧化磷酸化途径差异表达基因Figure 4 Differentially expressed genes of oxidative phosphorylation pathway
2.7 胁迫相关差异表达基因分析
胁迫相关基因在干旱胁迫7、14 和21 d 时多数上调表达,28 d 时下调表达基因变多(图5)。差异表达基因主要分布于氧化还原系统、信号、转录因子、热激蛋白、次级代谢物、激素信号、细胞壁、葡聚糖和蛋白质水解等通路上。干旱胁迫7、14 和21 d 时,信号中的Ca2+依赖蛋白激酶CDPK9和CDPK7基因上调;激素信号途径中的生长素(auxin,IAA)、油菜素类固醇(brassinosteroids,BR)、茉莉酸(jasmonic acid,JA)途径差异表达基因上调,ABA 信号通路蛋白磷酸酶2Cs (PP2Cs)分支A 的成员HAI1基因均上调表达;转录因子中ERF、bZIP和MYB家族全部差异表达基因均上调表达;氧化还原系统的氧化还原状态通路中硫氧还蛋白FTR-C、抗坏血酸(ascorbate)和谷胱甘肽(glutathione)CYB-1、谷胱甘肽还原蛋白、歧化酶和过氧化氢酶CAT1、CCS显著上调,POD基因在14 d 时有两个上调;次级代谢物通路中黄酮类合成通路、异戊间二烯化合物合成通路、类苯基丙烷合成通路和蜡质合成通路基因上调(图5)。干旱胁迫28 d 时,Ca2+信号通路少数上调;ABA 信号通路HAI1基因下调;氧化还原状态相关基因只有谷胱甘肽还原蛋白基因上调;转录因子多数下调;次级代谢通路中异戊间二烯化合物合成通路和黄酮类合成通路基因上调(图5)。
3 讨论与结论
藜科C4植物多分布于荒漠地区,其叶片结构可分为Atriplicolid、Kochioid、Kranz-Suaedoid 和Salsoloid 4 种类型,分别存在于滨藜族、樟味藜族、碱蓬族和猪毛菜族[21]。本研究对象雾冰藜属于藜科的樟味藜族雾冰藜属,叶片不具有皮下组织,叶肉细胞和维管束鞘细胞组成弧形结构,而非闭合的环形结构,符合樟味藜族Kochioid-Ⅲ型C4植物结构特点[21]。Kochioid-Ⅲ型钩刺雾冰藜(B.hyssopifolia)的维管束没有明显的主维管束[14],而本研究中雾冰藜叶片存在一个较大主维管束,原因可能是物种之间的结构差异和多样性[14]。本研究中雾冰藜在干旱胁迫7 和14 d 叶片显著变厚,7 d 表皮显著增厚,推测在轻度干旱胁迫时雾冰藜通过叶片和表皮的增厚抵御干旱胁迫[2]。本研中雾冰藜干旱胁迫14 d 时主维管束面积显著减小,21 和28 d 恢复变大,轻度干旱会导致雾冰藜主维管束面积减小这一结果与草地早熟禾在干旱胁迫下维管束面积减小的结果相似[22],推测重度干旱时雾冰藜通过恢复增大主维管束面积保障水分和养分的运输能力,抵御重度干旱胁迫[7]。雾冰藜叶片贮水组织厚度在干旱胁迫21 和28 d 连续显著减小,推测随着干旱胁迫持续时间的延长,雾冰藜通过消耗贮水组织中贮存的水分来维持细胞水分平衡[23]。
Ca2+被认为是帮助植物应对环境胁迫的关键第二信使。Ca2+依赖蛋白激酶(CDPKs)是植物中最具特征的Ca2+传感器[24],也是植物应对非生物胁迫的重要调节因子[25]。拟南芥(Arabidopsis thaliana)AtCPK6过表达系的耐旱性更强[26]。AtCPK10参与拟南芥的耐旱性,并在ABA 和Ca2+触发的气孔运动中发挥重要作用[27]。雾冰藜Ca2+信号通路CDPK9和CDPK7基因在干旱胁迫7~21 d 时显著上调。这两个基因均属于CDPKs成员,推测雾冰藜在轻度到重度干旱胁迫下可通过上调Ca2+传感器蛋白激酶基因CDPK9和CPK7增强对干旱胁迫的耐受性。
ABA 信号通路是植物干旱胁迫反应的核心。蛋白磷酸酶2Cs (PP2Cs)是ABA 信号途径中的负调控因子,通过阻断催化裂口和去磷酸化激活环使SnRk2 激酶不活跃[1]。HAI1和HAI2是拟南芥蛋白磷酸酶2Cs (PP2Cs)分支A 的成员,HAI1是干旱胁迫过程中脯氨酸和渗透调节溶质积累的负调节因子[28]。本研究雾冰藜HAI1基因在干旱胁迫7~21 d时均上调表达,而28 d 时下调表达,推测在重度干旱胁迫下雾冰藜通过下调PP2Cs 成员HAI2基因促进SnRk2 激酶的激活,从而磷酸化下游转录因子[1]。
植物中已报道多个转录因子家族可以通过结合目标基因的顺式作用元件帮助植物抵御干旱胁迫。番茄(Solanum lycopersicum) bZIP 家族成员SlAREB调控胁迫应答基因,其过量表达可提高植物对水分胁迫的耐受性[29]。水稻(Oryza sativa)OsbZIP62过表达可提高水稻耐旱性,并与ABA 信号途径蛋白激酶互作[30]。水稻中AP2/ERF (APETALA2/ethyleneresponsive element binding factors)家族的OsERF101过表达植株对干旱胁迫的抗性和耐受性更强[31]。对6 个OsMYB成员响应干旱和盐胁迫的表达分析结果表明其参与了个体和联合的非生物胁迫响应[32]。白刺(Oryza sativa)转录组测序结果表明MYB、AP2/ERF、WRKY等转录因子参与干旱胁迫响应[10]。本研究雾冰藜在干旱胁迫7~21 d 时ERF、bZIP和MYB转录因子的全部成员均显著上调表达,28 d时有一个ERF,一个bZIP,两个MYB上调表达,推测雾冰藜通过上调这些转录因子抵御干旱胁迫。
活性氧(ROS)的产生是各种代谢反应的副产物。非生物胁迫下ROS 的产生使植物表现出毒性症状,过量的ROS 对植物细胞碳水化合物、脂核酸和蛋白质造成光氧化损伤[2]。本研究雾冰藜H2O2含量分别在干旱胁迫14 和21 d 显著增加,说明干旱胁迫导致雾冰藜体内活性氧含量的过量产生。SOD 可以将O2—转化为H2O2,随后由POD 和CAT等清除过量的H2O2产生水和二氧化碳[2,4]。干旱胁迫下甘草(Glycyrrhiza uralensis)叶片DEGs 涉及抗氧化酶活性生物过程且SOD 活性显著增加[33]。本研究雾冰藜在干旱胁迫7~21 d 时CCS显著上调,而POD基因在14 d 时有两个上调;与之相符合的是雾冰藜SOD 活性在干旱胁迫21 和28 d 显著增大,POD 活性在干旱胁迫14 d 显著增大。推测在轻度和中度干旱胁迫下雾冰藜通过上调CCS和POD基因来提高SOD 和POD 的酶活性。雾冰藜在干旱胁迫28 d 时,谷胱甘肽家族蛋白基因上调,H2O2含量在干旱胁迫28 d 显著减少,还原型谷胱甘肽和H2O2在酶的催化下生成氧化型谷胱甘肽和水,这一过程帮助清除过量的H2O2[5],推测在重度干旱胁迫下雾冰藜通过上调谷胱甘肽家族蛋白基因增加非酶自由基清除剂谷胱甘肽含量,帮助清除H2O2。CAT 活性在干旱胁迫时显著下调,推测CAT 不是雾冰藜清除ROS 的主要酶类。另外,雾冰藜黄酮类合成通路基因在干旱胁迫7 d 到28 d 均有显著上调、脯氨酸含量在干旱胁迫21 d 时显著增加。黄酮类和脯氨酸是非酶自由基清除剂,可帮助抵御干旱胁迫带来的氧自由基破坏[5]。
呼吸作用氧化磷酸化进行的场所是线粒体,是指在细胞内的有机物(糖、脂质和氨基酸等)经过氧化作用分解成CO2和H2O,并和磷酸化作用偶联使ADP 和Pi 合成ATP 的过程,产生的ATP 是植物细胞生命活动的能量来源。氧化磷酸化电子传递链包括NADH 脱氢酶(复合体Ⅰ)、琥珀酸脱氢酶(复合体Ⅱ)、细胞色素bc1 复合体(复合体Ⅲ)和细胞色素c 氧化酶(复合体Ⅳ),磷酸化过程发生在ATP 合酶(复合体Ⅴ)中[34]。干旱等胁迫会阻碍氧化途径的电子传递过程,从而影响后续ATP 的合成[35]。植物在干旱胁迫下呼吸速率增加,光合作用固定的碳消耗增多,但是ATP 合成降低,且ROS 的产生过量[36]。本研究中雾冰藜干旱胁迫处理不同时长的差异表达基因KEGG 代谢途径均富集于氧化磷酸化途径,这与花生(Arachis hypogaea)干旱抗性和感性材料间差异表达基因KEGG 富集分析结果一致[37]。拟南芥(Oryza sativa)呼吸作用氧化磷酸化过程参与响应生物胁迫,其电子传递链上的ppr40-1(复合体Ⅲ基因)突变体表现为应激敏感性增强、ROS 积累增多、膜脂过氧化增强和SOD 酶活性提高[38]。本研究雾冰藜氧化磷酸化途径基因在干旱胁迫7~21 d 均显著上调表达,电子传递链的4 个复合体和ATP 合酶复合体Ⅴ均响应干旱胁迫,呼吸作用增强,ATP合成增加;干旱胁迫28 d 时仍有部分基因上调。雾冰藜POD 活性在干旱胁迫14 d 时显著增强,SOD活性在干旱胁迫21 d 时显著增强,推测雾冰藜通过上调氧化磷酸化通路基因增强能量代谢,同时提高POD 和SOD 活性,抵御干旱胁迫。
综上,轻度和中度干旱胁迫下雾冰藜叶片和表皮变厚,受体激酶、G 蛋白、MAP 激酶、光及Ca2+信号通路接收和传导胁迫信号,呼吸作用氧化磷酸化途径DEGs 全部上调,抗氧化酶系统CCS和POD等基因上调同时SOD 和POD 的酶活性增强,脯氨酸含量增多。重度干旱胁迫下叶片贮水组织厚度急剧减小,氧化磷酸化途径部分基因上调,非酶自由基清除剂谷胱甘肽家族蛋白基因上调帮助清除过量H2O2,ABA 信号途径的抗旱负调控因子PP2Cs成员基因下调。ERF、bZIP和MYB转录因子,及非酶自由基清除剂黄酮类物质合成通路基因在不同程度干旱胁迫下均上调表达。研究结果为后期雾冰藜抗旱关键基因的挖掘和功能验证提供数据参考。
