基于TaqMan 探针的实时荧光LAMP检测肉制品中鸭源性成分研究
2023-12-11柳梦思时国强高娜婷焦义然孙旭飞孟亚南董振国
柳梦思,时国强,高娜婷,焦义然,孙旭飞,孟亚南,董振国
(1.河北三狮生物科技有限公司,河北 石家庄 050035;2.河北农业大学 食品科技学院,河北 保定 071000;3.河北农业大学 生命科学学院,河北 保定 071000)
近年来,公众对肉制品的消费需求逐年增长[1~2]。随着食品加工工艺不断提高,很大程度改变了食材原有的色泽、味道、纹理、气味等特性,传统的感官鉴别技术已无法对食材的真伪进行准确的鉴定[3-5]。其中,肉类及肉制品掺假已成为食品质量控制面临的重要挑战之一[6]。由于鸭肉的纹理色泽和牛羊肉较为接近,一些不法商家为获得高额利润,会以廉价的鸭肉冒充高价的牛羊肉进行销售[7-8]。因此,建立快速有效的鸭源性成分鉴定对于肉制品行业的监管具有重要的现实意义。
目前,肉类认证检测技术以定性检测为主,主要包括光谱法、质谱法、色谱法、酶联免疫吸附(Enzyme linked immunosorbent assay,ELISA)法、聚合酶链式反应(Polymerase chain reaction,PCR)法、环介导等温扩增(Loop-mediated isothermal amplification,LAMP)法等[9-18]。其中光谱法、质谱法和色谱法需要昂贵且精密的仪器,所用试剂价格较高,检测成本高,且对操作人员的专业素质要求较高,限制了其在肉类检测中的推广应用;ELISA 法操作步骤繁琐,检测时间长,且样品加工处理可能导致蛋白质变性,在加工肉制品中的应用受到限制;PCR 法依赖于昂贵的热循环仪,且需要繁琐的凝胶电泳来判定结果;LAMP 由于其快速简便、仪器廉价等优势迅速发展起来[19-23]。但常规LAMP 法需要通过凝胶电泳法判定结果,无法进行定量检测,易产生非特性扩增,造成“假阳性”[24]。
本研究通过引入TapMan 探针,建立基于TapMan探针的实时荧光LAMP 方法(TaqMan-LAMP),与常规LAMP 法相比,TaqMan-LAMP 既可以实现定性检测,又可以实现定量检测,可有效避免非特异性扩增,为肉制品中鸭源性成分的定量检测提供新的实用方法。
1 材料与方法
1.1 试验材料
试验用动物源样品:包括鸭肉、牛肉、羊肉、猪肉、鸡肉、马肉、驴肉、虾肉、鸽子肉、鹦鹉肉、狐狸肉、鱿鱼、鲤鱼、鼠肉、水貂均购自各大型超市及电商平台的单一品类生鲜肉,并经国家标准方法GB/T38164-2019[25]进行验证。市售待检样品:通过菜市场、超市及各线上平台共采购了47 份牛、羊、猪肉制品,包括牛肉速冻水饺、羊肉速冻水饺、猪肉速冻水饺、牛肉干、牛肉卷、黑椒牛肉馅饼半成品、合成牛排、撒尿牛丸、牛肉汉堡饼、生羊肉串、熟羊肉串、羊肉卷、羊肉烧麦、羊肉烤包子、猪肉脯、猪肉四喜丸子、猪肉香肠、猪肉小笼包、牛肉小笼包等。
1.2 仪器
BBEX-32 全自动核酸提取纯化仪(广州湾区生物科技有限公司);Q162D 实时荧光定量PCR 仪(河北三狮生物科技有限公司)。
1.3 核酸提取
根据Baypure 磁珠法动物组织基因组DNA 提取试剂盒(广州湾区生物科技有限公司)说明书要求对各样品进行DNA 提取,核酸样本冷藏备用。
1.4 引物探针设计
从Genbank 数据库中找到鸭线粒体cytb基因(GenBank:EU585609.1)序列保守区域,使用primer explorer v5 网站设计LAMP 引物组,包括内引物(FIP/BIP)、外引物(F3/B3)及环引物(LB/LF)。分别使用LB/LF 设计为LBP/LFP 探针,于3′端与5′端修饰荧光基团-FAM 与淬灭基团-BHQ1。引物及探针由上海生工合成,序列见表1 和表2。

表1 TaqMan-LAMP 引物和探针序列Table 1 The primer and probe sequences of TaqMan-LAMP
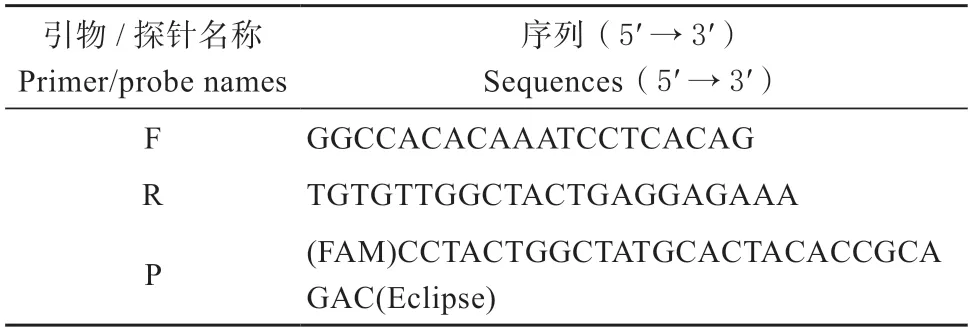
表2 荧光定量PCR 引物和探针序列Table 2 The primer and probe sequences of realtime fluorescence quantitative PCR
参照GB/T38164—2019 合成鸭源特异性引物和探针,序列见表2。
1.5 TaqMan-LAMP 检测方法的建立
LAMP 检测方 法包含:1×ThermoPol Buffer(Vazyme),8U Bst DNA Polymerase Large Fragment(Vazyme),1.4 mmol MgSO4(Vazyme),1.4 mmol dNTPs(Sanshibio),0.5 μL SYTO-9(life technology),FIP 和BIP 各2.0 μmol,F3 和B3 各0.5 μmol,0.5 μmol LB/LF,1.0 μL 模板DNA,(根据试验设计选择是否添加),ddH2O 补足25 μL,反应条件:60 ℃,1 min(采集荧光FAM),40 个循环。
TaqMan-LAMP 检测方法包含:1×ThermoPol Buffer(Vazyme),8U Bst DNA Polymerase Large Fragment(Vazyme),5U Taq DNA polymerase(E001,Sanshibio),1.4 mmol MgSO4(Vazyme),1.4 mmol dNTPs(Sanshibio),FIP 和BIP 各2.0 μmol,F3 和B3 各0.5 μmol,1.5 μmol LB/LF 与LFP/LBP 组合,根据试验设计选择组合添加,1.0 μL 模板DNA,ddH2O 补足25 μL,反应条件为:60 ℃,1 min(采集荧光FAM),40 个循环。
实时荧 光PCR 检测方 法:2× Probe qPCR Mix(EH002,Sanshibio),F、R 和P 各5.0 μmol,5.0 μL 模板DNA,ddH2O 补足25 μL,反应条件:95 ℃/2 min,95 ℃/15 s,65 ℃/80 s(采集荧光FAM),40 个循环。
1.6 特异性试验
使用TaqMan-LAMP 检测方法分别对提取的鸭肉、牛肉、羊肉、猪肉、鸡肉、马肉、驴肉、虾肉、鸽子肉、鹦鹉肉、狐狸肉、鱿鱼、鲤鱼、鼠肉及水貂等基因组DNA 检测,以无酶无菌水为阴性对照,测试TaqMan-LAMP 体系的特异性。
1.7 灵敏度试验
将鸭肉与羊肉混合,使鸭肉质量浓度依次为10%、1%、0.1%、0.01%、0.001%、0.0001%,充分混匀后,进行核酸提取,分别使用LAMP、TaqMan-LAMP 和实时荧光PCR 法对各梯度核酸模板进行测试,并计算扩增结果的线性相关系数(R2)>0.980 为灵敏度合格。
1.8 重复性试验
采用TaqMan-LAMP 检测方法对低质量浓度鸭源核酸样品进行8 次重复测试,以ddH2O 为阴性对照,对Ct值的变异系数CV值进行计算,CV<3%为灵敏度合格。
1.9 实际样品检测
同时使用LAMP、TaqMan-LAMP 和实时荧光PCR 法对市售47 份肉制品鸭源成分进行检测,以实时荧光PCR 作为对照,确定该检测方法的相对敏感性、相对特异性、相对符合率,对该检测方法作出评价。分别按下列公式进行计算:
相对敏感性=真阳性数/(真阳性数+假阴性数);
相对特异性=真阴性数/(真阴性数+假阳性数);
相对符合率=(真阳性数+真阴性数)/被检总数。
2 结果与分析
2.1 TaqMan-LAMP 体系建立
在LAMP 检测方法的内引物(FIP、BIP)和外引物(F3、B3)上,加入不同环引物或环引物探针组合,分别建立了LAMP(无LB/LF)、LAMP(LF)、LAMP(LB)和LAMP(LB/LF)4 种LAMP 检测体系,以及LAMP(LBP/LF)与LAMP(LB/LFP)2种TaqMan-LAMP 检测方法,以荧光定量PCR 法作为对照,对同一鸭源核酸进行检测,结果见表3。
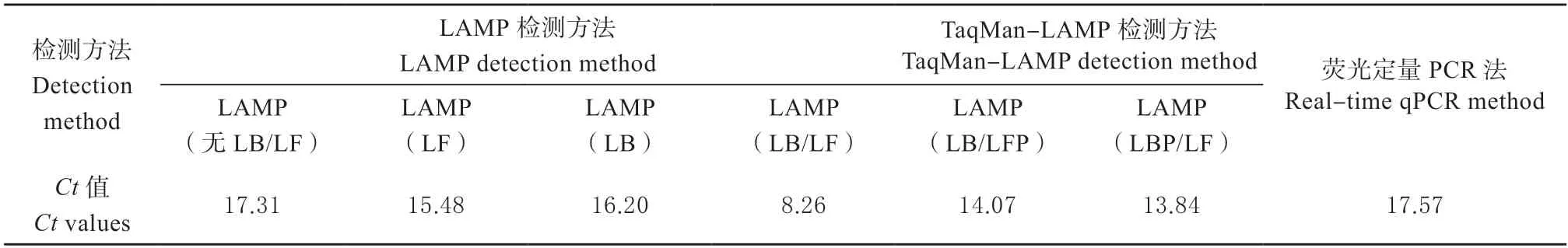
表3 不同检测体系的检测结果Table 3 Results of the different detection systems
结果显示,所建立的恒温检测方法(Ct值对应的即为检测时间)相对于荧光定量PCR 法(Ct值为17.57,对应的PCR 检测时间约为32 min),检测时间更短。双环引物LAMP 比无环引物及单环引物的检测时间均更短,表明体系中加入的环引物在形成扩增元过程中起到了加速的作用。将其中一条环引物引入荧光/淬灭基团,由于LAMP(LBP+LF)较LAMP(LB+LFP)检测时间更短,故优选LAMP(LBP+LF)为TaqMan-LAMP 检测体系进行鸭源性成分检测。
2.2 特异性检测结果
为验证引物的特异性,本研究分别以提取的鸭肉、牛肉、羊肉、猪肉、鸡肉、马肉、驴肉、虾肉、鸽子肉、鹦鹉肉、狐狸肉、鱿鱼、鲤鱼、鼠肉和水貂等基因组DNA 作为模板,以ddH2O 作为阴性对照,采用TaqMan-LAMP 方法进行检测。结果如图1 所示,只有鸭肉出现典型的“S”型扩增曲线,呈现阳性结果,而其他动物源性成分均未出现扩增曲线,判定为阴性结果。表明TaqMan-LAMP 检测方法具有良好的特异性。
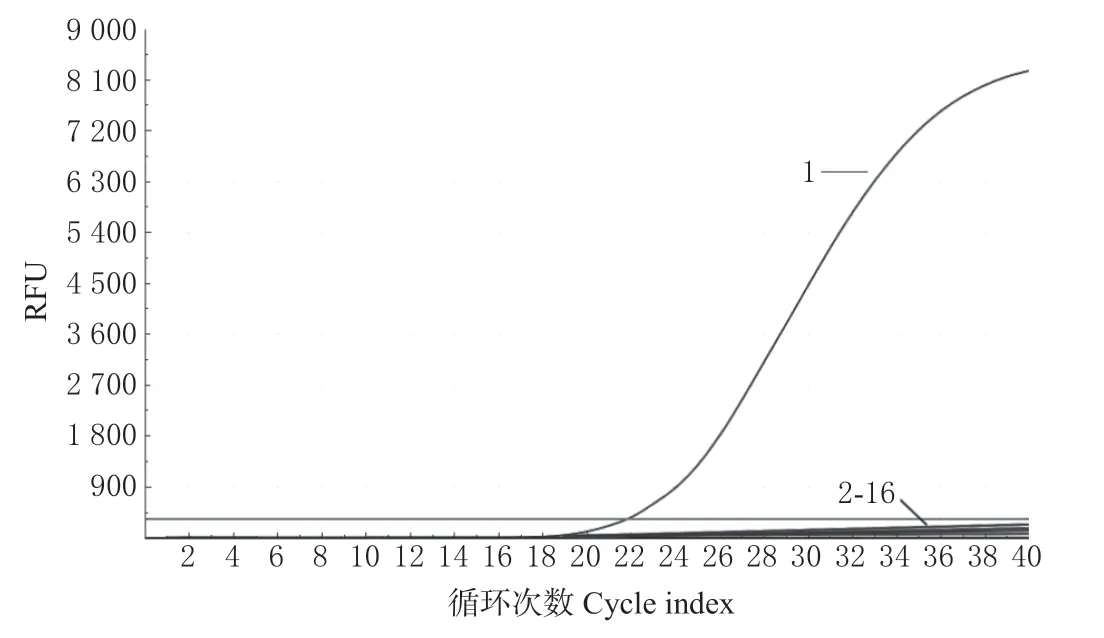
图1 TaqMan-LAMP 检测方法特异性检测结果Fig. 1 Specificity result of TaqMan-LAMP method
2.3 灵敏度检测结果
将鸭肉分别与生羊肉混合,使其质量浓度(w/w)依次为10%、1%、0.1%、0.01%、0.001%、0.0001%,充分混匀后,进行核酸提取,分别采用LAMP、TaqMan-LAMP 和荧光定量PCR 法进行检测,结果见表4。
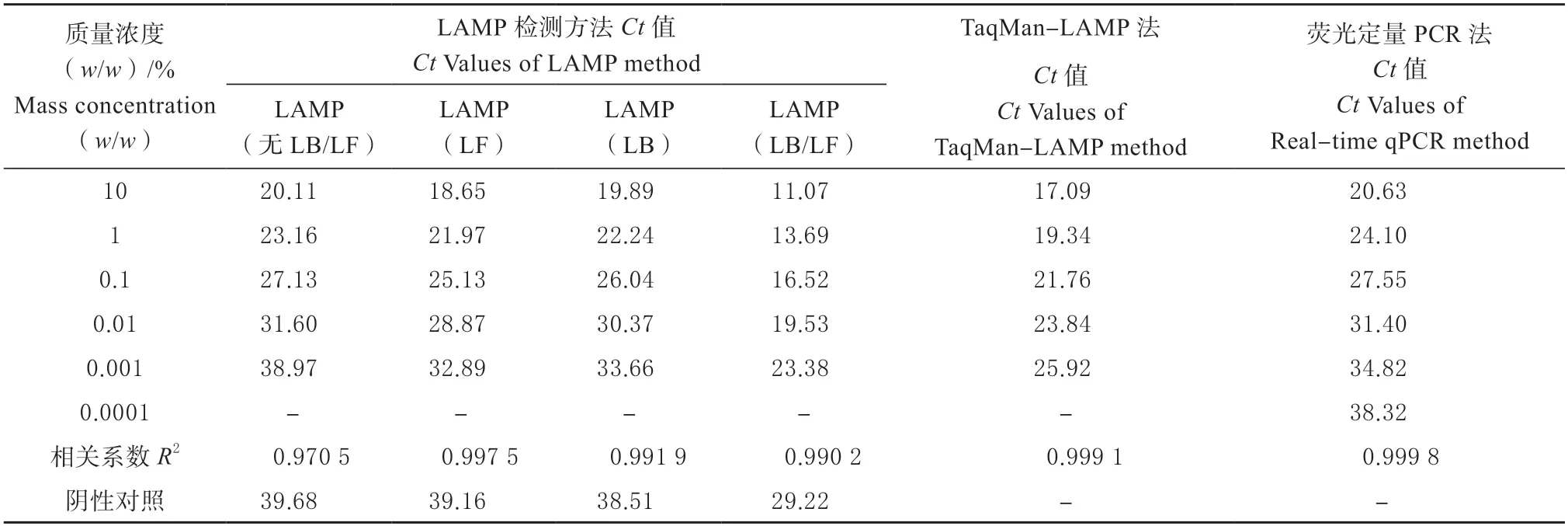
表4 灵敏度检测结果Table 4 Test results of sensibility
结果显示,与LAMP 检测方法相比,TaqMan-LAMP 法灵敏度一致,均为0.001%(w/w),且阴性对照无“假阳性”结果;与荧光定量PCR 法相比,TaqMan-LAMP 法扩增结果的线性相关系数(R2)相当,均大于0.999,且可在更短时间(25.92 min)内完成灵敏度为0.001%(w/w)的准确检测。
2.4 重复性检测结果
采用TaqMan-LAMP 检测体系对低质量浓度0.001%鸭源核酸样品进行8 次重复测试,以ddH2O为阴性对照,检测结果如图2 所示。

图2 重复性检测结果Fig. 2 Repeatability of test results
对Ct值的变异系数CV值进行计算,CV值为1.99%。TaqMan-LAMP 检测方法灵敏度合格,检测结果稳定。
2.5 实际样品结果
以GB/T38164-2019 实时荧光PCR 法鸭源检测方法为对照,使用TaqMan-LAMP 和LAMP(LB/LF)检测体系同时对收集的47 份肉制品进行平行测试,见表5。结果显示,LAMP(LB/LF)检测体系的相对敏感性为100%,但出现了2 份“假阳性”结果,故影响了相对特异性和相对符合率(分别为88.89%和95.74%);而本研究所建立的TaqMan-LAMP 检测方法相对敏感性、相对特异性和相对符合率均为100%。
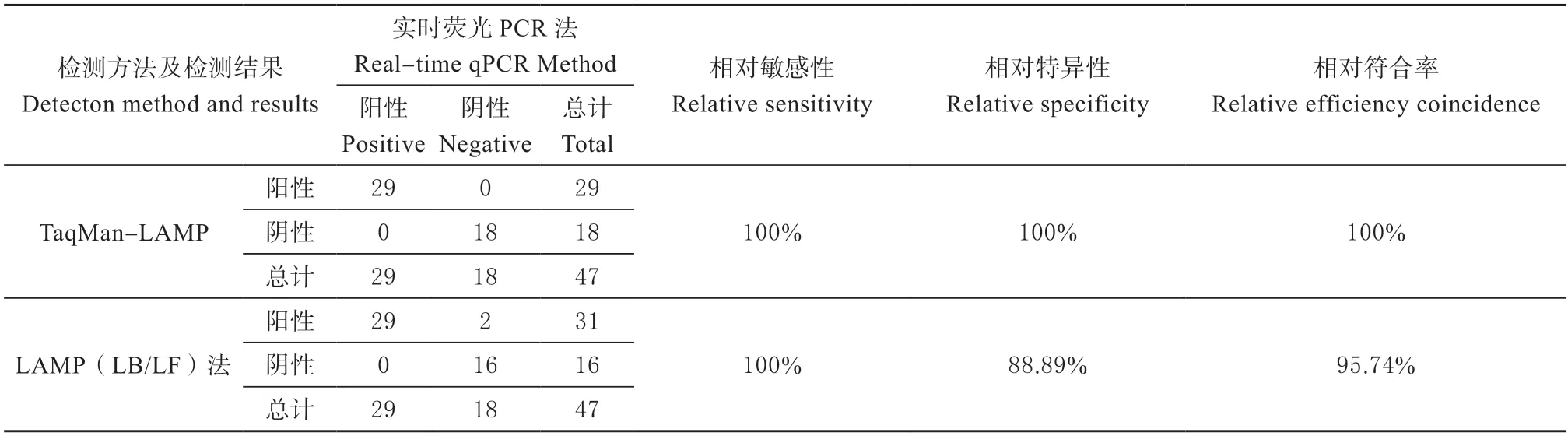
表5 实际样品检测结果Table 5 Accuracy of test results
3 结论
本研究建立了快速有效的TaqMan-LAMP 检测方法,用于检测肉制品中的鸭源性成分。结果表明,该检测方法的特异性良好,可在30 min 内完成准确检测,灵敏度为0.001%(w/w),重复性好。通过对47 份实际样品检测,与国标法相比,该方法相对敏感性、特异性和符合率均为100%。总之,本研究建立的鸭源性成分TaqMan-LAMP 检测方法快速、特异性强、灵敏度高,适用于肉制品中鸭源性成分的快速检测,为肉制品中掺假成分的检测提供了一种新方法。
