高代自交系茄子CR 耐低温生理特性及转录组学分析
2023-12-11张敬敬高秀瑞潘秀清武彦荣
宋 雪,李 冰,张敬敬,高秀瑞,潘秀清,武彦荣
(河北省农林科学院 经济作物研究所,河北 石家庄 050051)
茄子(Solanum melongenaL.)是起源于亚洲热带地区的喜温茄科植物,在蔬菜消费中占重要地位。我国地缘广阔,南北温差较大,茄子种植过程中往往面临低温灾害。低温胁迫条件严重影响茄子植物的生长发育,导致产量严重降低[1]。低温胁迫对茄子种子萌发有抑制作用,谢顺赞等的研究发现5 ℃低温处理茄子发芽势和发芽率显著下降[2]。低温使茄子幼苗光合系统反应中心受到损伤,光合电子传递过程受到抑制,随着低温胁迫时间的延长,幼苗叶片的净光合速率下降,胞间CO2浓度先升高后降低,蒸腾速率和气孔导度则先下降后增加[3]。低温胁迫条件下,茄子叶片中可溶性糖、脯氨酸、丙二醛(MDA)含量,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性以及电解质渗透率等都明显增加,可作为茄子植物的耐寒特性的参考指标[4-6]。外源施用多胺、CaC12、褪黑素、植物激素及稀土元素铈可以提高茄子植物的耐低温能力[7]。通过嫁接技术提高茄子抗寒能力在生产上得到广泛应用[8],为克服低温胁迫提供了可靠的技术保障。除了通过栽培管理措施提高茄子耐低温能力,筛选耐低温优质品种是解决生产问题的一个重要途径。我国茄子种质资源丰富,由于其自身遗传特性和长期自然选择,耐低温能力普遍较差。因此,筛选高抗或高耐低温的茄子品种,并发掘抗寒的关键基因,可为培育高产优质茄子新品种提供基因资源。
随着植物抗逆育种研究的深入,耐低温种质筛选和抗低温相关基因的鉴定成为研究热点[9]。提高茄子种植品种的耐低温特性,需要遗传物质上解析耐低温胁迫的机理,发掘耐低温关键基因。本研究以耐低温自交系茄子材料CR 为对象,研究低温胁迫下的生理特性变化。以不耐低温茄子品种NCR 为对照,通过转录学研究筛选差异表达基因(DEGs),为进一步挖掘茄子耐低温相关基因提供线索,以期为茄子耐低温基因工程提供理论支撑。
1 材料与方法
1.1 植物材料
本研究使用的茄子植物是河北省农林科学院经济作物研究所瓜类课题组保存的自交系CR 和NCR。CR 是早熟品种,果实圆形,表皮为黑紫色。NCR 是中晚熟茄子新品种,果实圆形,果肉紧实,口感好,抗病性强。
1.2 冷害指数分析
茄子幼苗在园区温室培养长至3~4 片真叶时,挑选长势和叶数相对一致的幼苗放置于人工气候箱内,设置3 个平行组,每组每个品种6 棵,分别放置于3 个条件一致的人工气候箱内,设置温度25~28 ℃,相对湿度60%~70%,14 h/10 h 的光照/黑暗周期。在人工气候箱内预处理1 d 后,将温度设为3 ℃进行低温胁迫处理,其他条件不变。处理时间分别为0(预处理)、1、3、6 d,对处理后的幼苗表型进行冷害程度统计分析。冷害指数参照王孝宣等[10]的标准对每株幼苗冷害状况进行分级,0 级:植株生长正常,无冷害症状;1 级:仅有少数叶片的边缘发生轻度皱缩萎焉;2 级:半数以下的叶片萎焉死亡;3 级:半数以上的叶片发生萎蔫死亡;4 级:植株全部死亡。冷害指数(CI)=(1×S1+2×S2+3×S3+4×S4)/(低温胁迫总株数×4),S为相应冷害级的苗数。试验重复了3 次。
1.3 电解质渗透率测定
茄子植物在人工气候箱内3 ℃条件下处理1、3、6 d 后,随机采集3 片成熟叶,用去离子水冲洗干净,从叶片表面去除无机盐离子和各种杂质。室温风干后剪碎混匀,称取0.3 g 置于20 mL 试管,加入去离子水15 mL 轻轻振荡充分混匀,静置24 h 后,对叶片的电解质渗透率进行测定,所得值为电解质渗透率E1。所用水的电解质渗透率定义为E0。最后将样品在100 ℃沸水浴中煮浴10 min,待温度降至室温25 ℃后测得电解质渗透率E2[11-13]。
电解质渗透率=(E1-E0)/(E2-E0)× 100%,试验重复3 次。
1.4 丙二醛含量测定
茄子叶片丙二醛含量用丙二醛(微量法)试剂盒法测定(苏州科铭)。茄子植物在人工气候箱内3 ℃条件下处理1、3、6 d 后,每个时间点随机采集3 片成熟叶,剪碎混匀后取0.1 g 叶片,迅速加入1 mL 提取液冰浴匀浆。10 000 g 4 ℃离心10 min 后置于冰上待测。吸取 0.3 mL 试剂放置于1.5 mL 离心管,再加入0.1 mL 提取物样本,充分混匀。于95 ℃水浴30 min 后冰浴冷却,10 000 g25 ℃离心10 min,取200 μL 上清液于微量石英比色皿中测定532 和600 nm 处的吸光度,记为A532和A600,根据532 与600 nm 吸光度的差值计算MDA 含量。试验重复3 次。
1.5 转录组分析
1.5.1 测序叶片样品的准备 在常温预处理对照条件和低温处理1 d 后分别收取CR 和NCR 植株叶片,迅速用锡箔纸包裹并放入液氮进行快速冷冻,冷冻后的叶片样品于-80 ℃冰箱保存。试验共设4 个处理:常温CR(CR_CK),低温处理1 d 的CR,常温NCR(NCR_CK),低温处理1 d 的NCR。每个处理重复取样3 次进行样转录组测序。
1.5.2 RNA 提取和cDNA 文库的构建 转录组分析委托北京诺禾生物科技有限公司完成。用Trizol提取总RNA,在Agilent 2100 bioanalyzer 中对RNA的完整性和总量进行检测。用Oligo(dT)磁珠富集带有polyA 尾的mRNA,在Fragmentation Buffer中用二价阳离子将得到的mRNA 随机打断。将片段化的mRNA 作为模版,用随机寡核苷酸引物在M-MuLV 逆转录酶体系中合成cDNA 第1 条链。随后用RNaseH 降解RNA 链,并在DNA 聚合酶I 体系下,以dNTPs 为原料合成cDNA 第2 条链。纯化后的双链cDNA 经过末端修复、加A 尾并连接测序接头,用AMPure XP beads 筛选20~370 bp 左右的cDNA。经PCR 扩增纯化后获得文库。
1.5.3 数据分析 利用Illumina HiSeqTM 测序平台进行转录组测序分析。剔除原始数据中含有接头、不确定碱基或低质量测序片段。基因表达水平用FPKM(指每百万碱基对测序的转录本序列片段的每千碱基片段的预期数量)值来表示。用DESeq2软件(1.20.0)进行2 个比较组合之间的差异表达分析。用Benjamini 和Hochberg 的方法来调整所得P值以控制错误发现率。参考茄子基因组信息数据对测序所得基因信息进行注释(http://eggplant-hq.cn/Eggplant/)。通过clusterProfiler 3.8.1 软件对差异表达基因进行GO 富集分析,并对差异表达基因涉及的KEGG 通路进行分析。
2 结果与分析
2.1 高代自交系CR 的冷害指数分析
高代自交系CR 在处理后1 和3 d,都没有出现萎焉,处理后6 d,少数植株的叶片出现萎焉,冷害指数为0.04。高代自交系NCR 处理后1 d,就出现明显的萎焉,3 和6 d 后萎焉程度逐渐增加,在观察的3 个时间点,冷害指数分别是0.22、0.36 和0.47(图1-A)。高代自交系CR 在低温处理6 d 后虽然也出现萎焉,但冷害指数仅为自交系NCR 的1/10。低温处理后CR 的冷害指数显著低于NCR(P<0.01),比NCR 表现出更高的耐低温能力。

图1 低温胁迫对茄子自交系CR 冷害指数、电解质渗透率和丙二醛含量的影响Fig. 1 Effects of low temperature stress on chilling injury index,electrolyte permeability and MDA content in eggplants
2.2 低温胁迫对高代自交系CR 电解质渗透的影响
高代自交系CR 低温处理后1、3 和6 d 的电解质渗透率分别为21.05%、22.66%、23.59%,随着低温处理时间的增加,电解质渗透率虽然也呈逐步增加大的趋势,但不同时间点之间的数值差异很小。低温处理6 d 的电解质渗透率与1 d 相比增加了12.07%。高代自交系NCR 电解质渗透率1、3 和6 d 分别为25.33%、29.36%和43.75%,从1~6 d 的增幅为72.72%,高于CR 品种12.07%。低温造成CR 叶片的电解质渗透率显著低于NCR(P<0.01)(图1-B)。
2.3 低温胁迫高代自交系CR 中丙二醛含量分析
2 个自交系品种未经低温胁迫处理,叶片中检测出来的丙二醛含量没有区别(图1-C)。低温处理后1、3 和6 d,2 个自交系品种的丙二醛含量都随着处理时间增加而增加。自交系CR 中丙二醛含量增加的量显著低于NCR 品种(P<0.05)。自交系CR 的丙二醛含量在低温处理后第6 天比第1 天增加11.77%。相比之下,自交系NCR 在低温处理后第6 天比第1 天增加了20.33%(图1-C)。由此可以看出,CR 的耐低温生理特性比NCR 优异,表现出较强的抗寒能力。
2.4 转录组测序质量控制
转录组测序研究4 种处理12 个样品中总共得到556 367 312 条原始序列(Raw reads),去除含有接头的、低质量的Raw reads,得到滤后序列(Clean reads)541 986 614 条,用于后续分析。Q20 和Q30分别表示碱基识别出错的概率为1%和0.1%。在得到的滤后序列中,Q20 值均大于97%,而Q30 值均达到91%以上。此外,GC 百分率都大于42%(表1)。由表2 结果可知,从Clean reads 中得到的序列与茄子参考基因组比较分析,完全比对到参考基因组的reads 占总reads 数量的94%以上,唯一比对位置序列的比对率在89%以上,多个比对位置序列比对率在4.91%以下,外显子比对率81%以上。转录组测序的质量可靠,能够保证分析结果的准确性。
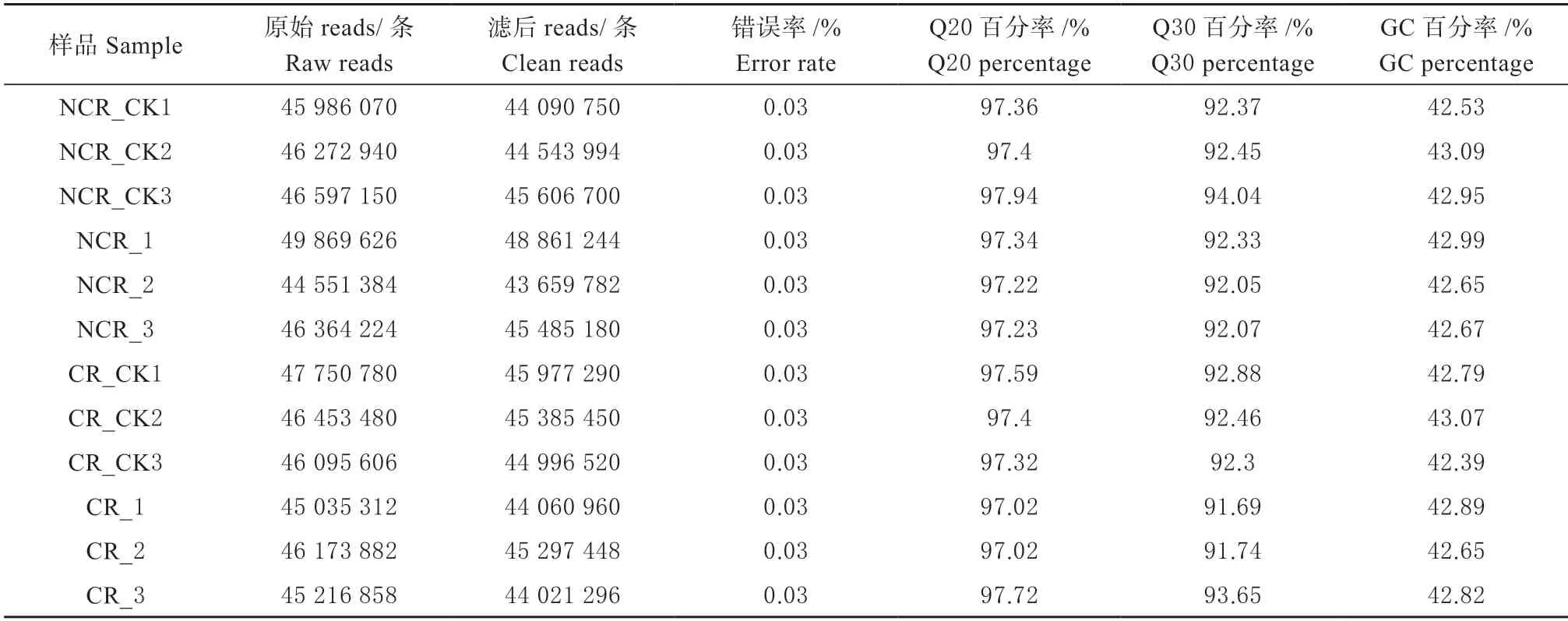
表1 12 个样本转录组数据测序质量Table 1 The quality of 12 samples for transcriptome sequencing
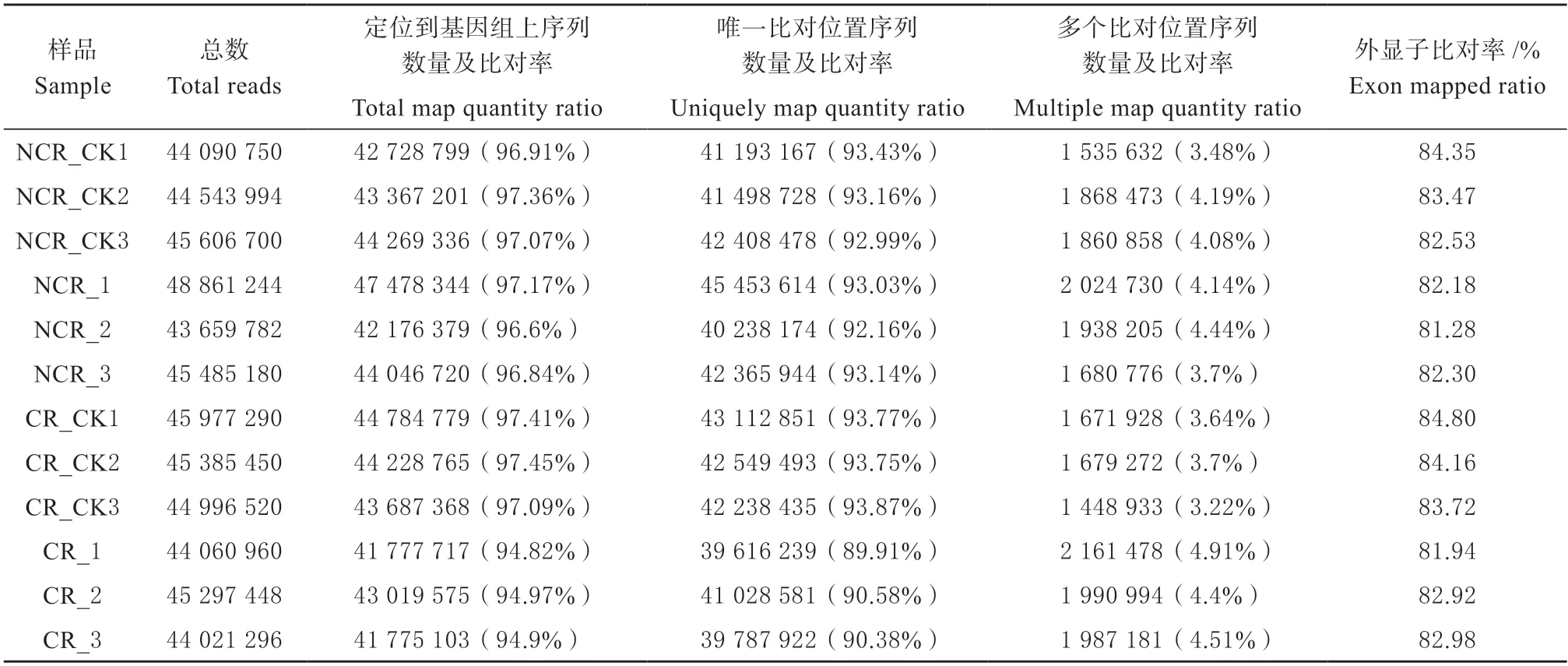
表2 与参考基因组比对结果Table 2 Summary of sequence comparison with reference genome
2.5 基因表达数据分析
为明确低温处理条件下2 个自交系茄子的差异表达基因的情况,利用FPKM 法计算编码基因 的表达 量(筛选条件为padj<0.05 且|log2FoldChange|>1)。选择表达量差异大于2 倍(P≤0.05)的差异表达基因,绘制差异基因表达火山图(图2)。自交系CR 低温与常温对照(CR_CK)相比,总共有6 113 个基因的表达水平发生变化,其中3 378 个上调,2 735 个下调。而NCR 低温与常温对照(NCR_CK)相比,有7 670 个基因的表达水平发生显著变化,其中4 030 个基因表达水平上调,3 640 个基因表达水平下调。2 个不同品种间低温处理后产生了754 个差异基因,其中429 个上调,325 个下调。结果表明,2 个茄子品种经过低温处理后,存在一定的基因表达差异,从而为筛选相关基因进行耐低温的鉴定提供了基础。
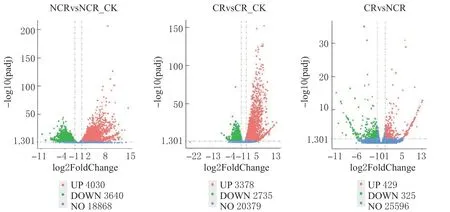
图2 2 个茄子品种处于低温与对照间差异基因表达Volcano-plot 分布图Fig. 2 Volcano-plot of DEGs between two eggplant varieties in response to low temperature
2.6 自交系CR 低温胁迫条件下特有的表达基因
通过常温和低温胁迫下的比较转录组学分析,从2 个自交系CR 和NCR 中分别得到了各自应对低温胁迫的差异表达基因(图3)。将这些差异表达基因进行进一步分析,发现2 个自交系在常温下NCR_CK 和CR_CK 相比差异表达基因数为726 个,说明常温条件下2个品种在基因表达谱上存在差异。受低温胁迫条件下,自交系CR 与NCR 相比差异表达基因是754 个。除去2 个品种在常温对照下本身就存在差异表达基因181 个基因外,由低温处理造成2 个品种间的差异表达基因为573 个。为了筛选CR 特有的表达基因,将转录组数据进行进一步分析,得到了80 个仅在低温处理CR 品种中特异性表达的基因。

图3 差异表达基因韦恩图Fig. 3 Venn diagram of differentially expressed genes
2.7 自交系CR 低温特有表达基因的GO 和KEGG富集分析
对上述分析得到的80 个差异基因进行GO 富集分析(图4),这些基因涉及生物学过程(Biological process,BP)、细胞组 分(Cellular component,CC)及分子功能(Molecular function,MF)3 个GO 大类。生物学过程大类中差异表达基因涉及无机物响应(GO:0010035)、非生物刺激响应(GO:0009628)、金属离子输运(GO:0030001)、核小体装配(GO:0006334)、染色质组装(GO:0031497)、核小体组织(GO:0034728)、DNA 包装(GO:0006323)、染色质的组成或分解(GO:0006333)、蛋白质-DNA 复合物组装(GO:0065004)、蛋白质-DNA 复合亚基组织(GO:0071824)。细胞组分GO 类中含有核小体(GO:0000786)、核染色质(GO:0000785)、蛋白质复合体(GO:0032993)。
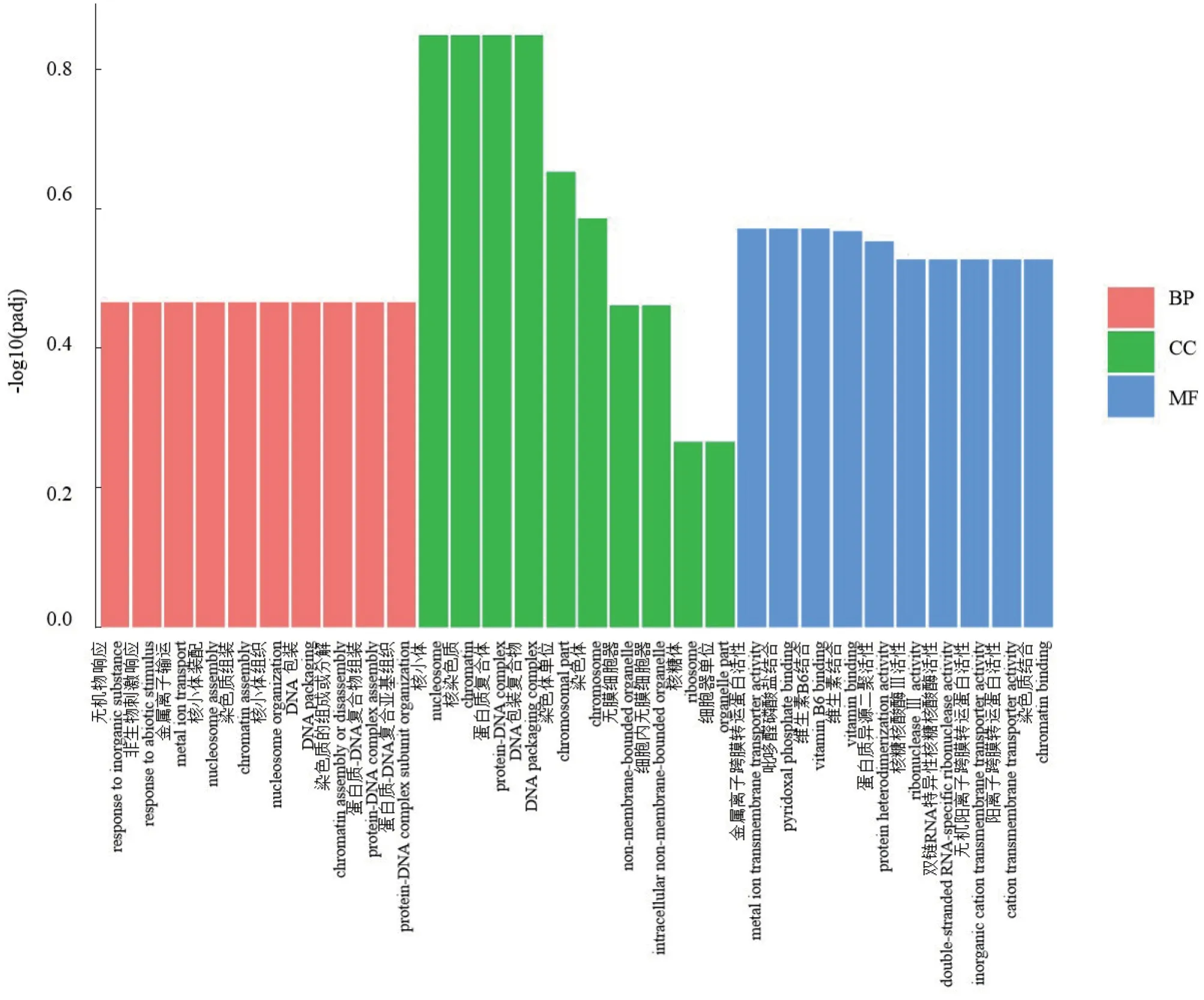
图4 80 个差异基因的前30 条目GO 的功能分类Fig. 4 Enriched GO analysis for 80 DEGs
DNA 包装复合物(GO:0044815)、染色体单位(GO:0044427)、染色体(GO:0005694)、无膜细胞器(GO:0043228)、细胞内无膜细胞器(GO:0043232)、核糖体(GO:0005840)、细胞器单位(GO:0044422)。金属离子跨膜转运蛋白活性(GO:0046873)、吡哆醛磷盐结合(GO:0030170)、维生素B6 结合(GO:0070279)、维生素结合(GO:0019842)、蛋白质异源二聚活性(GO:0046982)、核糖核酸酶Ⅲ活性(GO:0004525)、双链RNA 特异性核糖核酸酶活性(GO:0032296)、无机阳离子跨膜转运蛋白活性(GO:0022890)、阳离子跨膜转运蛋白活性(GO:0008324)和染色质结合(GO:0003682)分子功能通路。
自交系CR 低温胁迫下特异性表达的80 个基因经KEGG 分析,富集到8 个代谢通路(图5)。差异基因主要集中在植物激素信号转导(sly04075),植物与病原物互作(sly04626),半胱氨酸和蛋氨酸代谢(sly00270),苯丙氨酸代谢(sly00360),MAPK 植物信号通路(sly04016),糖胺聚糖降解(sly00531),类固醇生物合成(sly00100),二萜生物合成(sly00904)等8 个代谢通路。其中二萜生物合成、类固醇生物合成通路显著性富集(P<0.05)。说明二萜生物合(gene ID:Smechr1200036/Smechr0702775)和类固醇生物合成(gene ID:Smechr0600296/Smechr0602729)代谢物在茄子耐冷性差异方面存在重要作用。
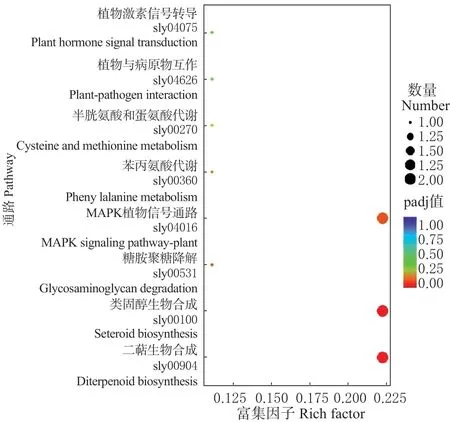
图5 80 个差异基因的KEGG 分析Fig. 5 The KEGG analysis for 80 DEGs
3 讨论与结论
低温处理后电解质渗透率大小是衡量植物抗寒性强弱的指标之一,电解质渗透率增加幅度越大,细胞膜受伤害的程度越高,植物的抗寒性越弱[14-15]。对自交系CR 电解质渗透率检测后发现低温处理第6天比第1 天增加12.07%,而NCR 增加了72.72%,这与CR 材料中冷害指数和丙二醛含量变化一致,均说明CR 是耐寒生理指标优异的一个自交系。
低温是典型的环境胁迫因素之一,影响植物的生长发育[1,9]。植物对低温胁迫的响应并非是完全被动的反应,而是一种积极主动的应激过程。低温诱导了相关基因的表达,通过积累小分子抗性物质及抗氧化系统的活化来缓解低温胁迫造成的机械伤害和生理伤害,从而提高植物的抗性[16]。通过对自交系品种CR 和NCR 低温处理后的转录组测序分析,筛选出80 个CR 特有的差异基因,上调表达的基因中主要参与染色体或染色质复制和重塑、脱水反应、跨膜转运、信号转导和蛋白泛素降解等相关途径。下调表达的基因主要参与细胞色素P450、麦角甾醇生物合成等相关路径。
脱水蛋白与植物抗逆性密切相关,耐旱耐冻性强的品系在胁迫条件下积累的脱水蛋白水平高于耐受性弱的品系[17]。冬季和春季小麦和燕麦抗冻性与脱水蛋白基因表达的时序性和水平相关,耐旱耐冻性强的品系在胁迫条件下积累的脱水蛋白水平高于耐受性弱的品系[18]。本研究筛选到的差异表达基因中与脱水相关的2 个基因Smechr0800088 和Smechr0200704 都在CR 品种中增强表达,这与其他植物中的研究结果一致:脱水蛋白的高水平表达与耐冷能力相关。
At1g61340(Smechr0201805)基因为F-box 基因家族成员,是植物中最大的蛋白质家族之一。F-box 蛋白作为SCF 复合体中泛素连接酶E3 的关键组分而在植物生长发育、激素信号传导、花器官发育和自交不亲和反应中发挥重要的调节作用[19]。F-box 蛋白介导的泛素降解途径还参与了植物应对非生物及生物胁迫的响应过程[20]。低温诱导下,具有F-box 结构的水稻CDM7(cold-inducing differential methylation)特异性表达[21]。水 稻miR393 靶定编码E3 的F-box 蛋白中TIR1,低温胁迫下miR393 表达上调,导致TIR1 mRNA 的降解,并抑制其翻译过程,降低生长素效应并抑制植物生长,提高植物的低温适应性[22]。
编码细胞色素P450 的Smechr1200036 和麦角甾醇的编码基因Smechr0602729 在CR 品种中表达量下调。植物细胞色素P450 响应生物或非生物胁迫因子,参与生物体内许多物质的生物合成与分解代谢[23-25]。麦角甾醇主要存在于酵母菌、霉菌和某些植物中,不仅参与细胞膜的功能维持,而且是细胞内多种生物学过程的重要调控因子。酵母细胞膜上麦角甾醇含量的高低与细胞对外界不良环境的抵抗力有重要关系[26]。这2 个基因与茄子耐低温能力的相关性有待进一步探索。
