深州蜜桃果实腐烂病病原菌鉴定及拮抗菌株的筛选
2023-12-11刘君盈孙新康崔钟池王海燕
刘君盈,孙新康,崔钟池,王海燕
(河北农业大学 植物保护学院/河北省农作物病虫害生物防治技术创新中心,河北 保定 071000)
桃(Prunus persica(L.)Batsch),蔷薇科、李属植物。桃在中国已有4 000 年以上的栽培历史[1],据统计2021 年中国桃种植面积和产量分别为89.0 万hm2和1 599.3 万t,均居世界第一位[2]。中国传统“四大蜜桃产区”,分别是河北深州、浙江奉化、江苏阳山和山东肥城,其中,河北深州蜜桃已有2 000 多年的栽培历史[3]。近年来,随着深州市蜜桃栽培面积不断扩大,桃果实在生长发育过程中,易受到各种病虫为害。8—9 月份正值蜜桃成熟期,采收季节常遇高温湿热天气,储运过程中易受到各种损伤,更容易受到多种病原菌的侵染引起果实腐烂。
目前,我国已报道引起桃腐烂的病害有10 种,如桃褐腐病、炭疽病、灰霉病和软腐病等,自幼果期至成熟期均可受到危害,造成蜜桃果实变软和腐烂,严重影响蜜桃产量和质量[1,4]。据国内外报道,目前造成桃褐腐病(Peach brown rot)的病原菌分别为美澳型核果链核盘菌(Monilinia fructicola)、果产链核盘菌(M.fructigena)、梅生链核盘菌(M.mumecol)、多子座链核盘菌(M.polystroma)和松散链核盘菌(M.laxa)与云南链核盘菌(M.yunnanensis)[5];桃炭疽病(Peach anthracnose)病原菌分别由胶孢炭疽菌(Colletotrichum gloeosporioide)和尖孢炭疽菌(C.acutatum)侵染造成,且2 种病原为复合小种[6]。目前胶孢炭疽菌(C.gloeosporioides)被细分为果生炭疽菌(C.fructicola)和暹罗炭疽菌(C.siamense)[7]。近年来,存在2 种病害同时发生的现象,其初期症状难以分辨,后期造成桃果实严重腐烂,使蜜桃丧失商品价值[8],严重影响了深州蜜桃的产量和质量,减少了果农的经济收益。
化学防治是防治桃褐腐病和炭疽病的主要方法,化学药剂虽能有效、快速地达到防治目的,但长期使用化学农药不仅会污染环境,造成农药残留,而且对一些非靶标的植物、微生物,甚至人类的安全造成了潜在的威胁[9-10]。生物防治可以减少对环境的干扰,具有绿色安全等特点,目前已成为研究的热点[11]。本研究拟通过利用传统病原鉴定结合多基因分子鉴定对患病蜜桃病原菌进行鉴定,并以鉴定出的病原菌为靶标,进行拮抗细菌的筛选,以期为深州蜜桃腐烂病的生物防治提供依据,为蜜桃腐烂病的综合防治提供思路。
1 材料与方法
1.1 病果采集与病原菌分离培养
2021 年9 月调查河北省深州市深州镇10 处蜜桃果园。在果实近成熟期对腐烂果实进地观察,每个桃园采集发病的蜜桃样本10 份。采用组织分离法对发病果实进行病原菌分离纯化,选取具有典型发病症状的蜜桃,用灭菌刀片在果实病健交界处切取0.5 cm×0.5 cm 若干小方块,将其放入70%的酒精浸泡15 s,10%次氯酸钠溶液进行表面消毒30 s,最后用无菌水清洗3~4 次,用灭菌滤纸吸去多余水分后,置于PDA 平板上,26 ℃培养箱暗培养5 d,待菌丝长出后,用无菌接种环接种到新培养基上纯化培养。待菌落长出后分别置于4 ℃和-80 ℃保存。
1.2 病原菌形态学观察
将分离获得的纯培养物置于PDA 培养基,26 ℃暗培养5 d,观察菌落生长变化、形态和颜色,待产孢后在显微镜下观察分生孢子的类型、形状、颜色,并测量孢子大小。
1.3 致病性测定
按照柯赫氏法则将分离得到的病原菌进行离体回接。选取健康、外观整齐、成熟度以及大小相似的蜜桃果实,75%酒精浸泡消毒后,无菌水冲洗3 次。在果实表面用无菌接种针轻微刺伤,同时用打孔器从新鲜菌落的边缘打取菌饼,倒置菌饼贴于果面刺伤处,并置于塑料箱中,以不接菌处理为对照。将塑料箱置于26 ℃培养箱暗培养,定期观察果实发病情况,待果实发病具有明显特征时,对病组织重新分离和鉴定,与接种前病原菌形态相同即可确定为致病菌。
1.4 病原菌的分子鉴定
采用CTAB 法分别提取2 种病原菌的DNA。以提取的DNA 作为PCR 扩增模板,利用引物ITS、GAPDH、TUB2 对菌株H-1、H-2、H-3 进行检测,利用引 物ITS、ACT、CAL、CHS-1、GAPDH、TUB2 对菌株T-1、T-2、T-3 进行 检测[12-13]。PCR反应总 体系为25 μL,含 有Master Mix12.5 μL、ddH2O 9.5 μL、上下游引物和模板DNA 各1 μL,经1%琼脂糖凝胶电泳检测。将PCR 产物送上海生工生物工程有限公司测序。利用MAFFT version7 进行序列比对,利用Bio Edit 软件进行序列串联,利用MAGE11 软件,采用邻接法构建系统发育树。
1.5 拮抗细菌的筛选
以蜜桃腐烂病原菌H-1、H-2、H-3 和T-1、T-2、T-3 为靶标菌,采用平板对峙法筛选有效的拮抗细菌。在PDA 培养基平板背面中心点处接种生长5 d 的致病菌菌饼(直径5 mm),距中心点左右两侧2.5 cm处接5 mm 拮抗细菌菌饼,每个处理3 次重复,对照组不接细菌,只接真菌菌饼。置于26 ℃恒温培养5 d,观察是否出现污染状况,根据抑菌带宽度计算抑制率,抑菌率(%)=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100。
2 结果与分析
2.1 深州蜜桃果实腐烂病发生情况
通过对深州蜜桃果实腐烂病田间调查发现,桃果实主要病害有桃褐腐病、炭疽病、软腐病等。温暖高湿、枝叶荫蔽的环境有利于病原菌的发生和传播,严重时整棵桃树大部分果实都会出现腐烂的现象。桃腐烂病发生分为几种类型:蜜桃果实摘袋后,有些果实病斑逐渐结合,导致整个果实腐烂,病部果肉变为褐色,病斑表面产生灰褐色绒球状霉簇(图1-A);有些果实底部或腰部出现褐色圆形或椭圆形病斑,病斑处果肉变软(图1-B);有些果实病斑表面凹陷,产生橘红色小粒点(图1-C)。这些导致蜜桃腐烂的症状肉眼难以区分,且发病率在50%~75%,直接影响蜜桃品质和产量。

图1 桃果实田间腐烂的症状Fig. 1 The symptoms of peach fruit rot in the field
2.2 深州市蜜桃果实腐烂病病原菌的分离与形态学鉴定
采用组织分离法对症状相似的病果进行病原菌分离,分离纯化获得6 株病原菌,根据病原菌在PDA 培养基上的菌落形态,挑选6 株代表性菌株进行后续试验,编号分别为H-1、H-2、H-3 和T-1、T-2、T-3(图2-A,B)。将菌株H-1、H-2、H-3 分别接种于PDA 培养基上,菌株H-1、H-2、H-3 在PDA培养基上的菌落形态完全一致,初期菌丝生长速度较慢,大部分菌落边缘完整,部分菌落边缘有缺陷,呈花瓣状,菌落颜色为偏灰黄色或灰褐色,中间颜色深边缘颜色浅(图2-A 正面、A1 背面),呈轮纹状排列。在显微镜下观察,H-1 分生孢子透明,呈椭圆形或柠檬形,链状,有分枝(图2-A2),孢子平均大小为15.3 μm×10.5 μm,根据菌落形态和孢子形态初步鉴定病原菌为子囊菌链核盘菌(Moniliniaspp.)的病菌。

图2 代表性菌株H-1 和T-1 形态特征Fig. 2 Morphological characteristics of the representative isolate H-1 and T-1
将T-1、T-2、T-3 菌株分别接种于PDA 培养基上培养,菌株T-1、T-2、T-3 在PDA 培养基上的菌落形态完全一致,菌丝生长致密呈白色,菌丝生长速度较快,菌落平整,边缘整齐(图2-B),后期菌落背面呈黑褐色(图2-B1)。通过在显微镜下观察发现T-1、T-2、T-3 分生孢子为单细胞,透明,圆柱形至纺锤形(图2-B2),孢子平均大小为(9.7~12.1)μm×(3.1~4.5)μm,根据菌 落形态和孢子形态初步鉴定病原菌为胶孢炭疽复合种(Colletotrichumloeosporioidesspecies complex)。
2.3 深州蜜桃果实腐烂病病原菌的致病性验证
根据柯赫氏法则进行回接试验,将菌株H-1、H-2、H-3 接种于蜜桃果实7 d 后,蜜桃果实出现了淡褐色近圆形病斑(图3-A),病斑部位出现灰色或淡黄色绒球状霉簇,病部果肉褐变;将菌株T-1、T-2、T-3 接种于蜜桃果实,7 d 后蜜桃果实出现了淡褐色近圆形水渍状病斑(图3-B),而对照组果实均无发病症状(图3-A1,B1)。分别对人工接种发病的果实再次进行病菌分离,成功分离获得与原病原菌一致的菌株,证明分离到的病原菌为致病菌。
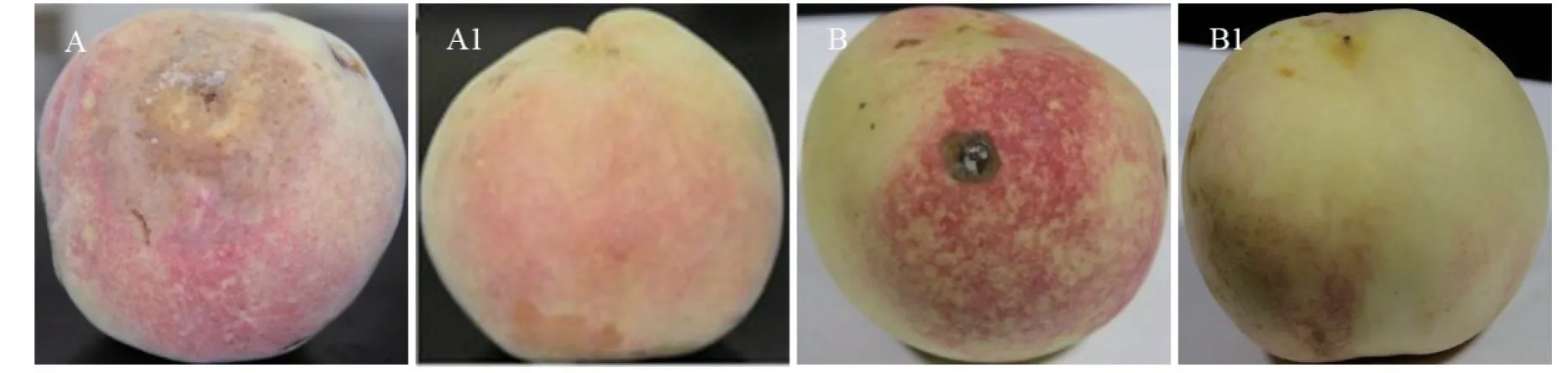
图3 致病性检测Fig. 3 Pathogenicity assay
2.4 深州蜜桃果实腐烂病病原菌的分子生物学鉴定
将病原菌H-1、H-2、H-3 基因组中的ITS、GAPDH、TUB2 序列在与GenBank 中进行BLAST比 对,发 现H-1、H-2、H-3 基因组中的ITS、GAPDH、TUB2 序列与M.fructicolastrain 等菌株相似性为100%。进一步利用MAGE 11 软件,采用邻接法构建系统发育树,聚类结果显示,菌株H-1、H-2、H-3 与模式菌株M.fructicolastrain M15.4A_Nc_Ch 和M.fructicolastrain shhf15 聚集于同一分支上,自展值为100%(图4-A)。菌株序列上传NCBI,基因编号分别为ITS: ON26211、GAPDH:ON303282、TUB2: ON303279。结合病原菌形态学鉴定,证明患病蜜桃果实中分离到的真菌为美澳型核果链核盘菌(M.fructicola)。

图4 M. fructicola A 和C. siamense B 序列比对构建系统发育树Fig. 4 Phylogenetic tree of M. fructicola A and C. siamense B trains constructed with the sequence alignment results
将病原 菌T-1、T-2、T-3 基因组中的ITS、ACT、CAL、CHS-1、GAPDH、TUB2 序列在 与GenBank 中进行BLAST 比对,发现T-1、T-2、T-3基因组中的ITS、ACT、CAL、CHS-1、GAPDH、TUB2 序列与C.siamensestrain 等菌株相似性为100%,进一步利用MAGE 11 软件,采用邻接法构建系统发育树,聚类结果显示,菌株T-1、T-2、T-3 与模式菌株C.siamenseSDQD5 聚集于同一分支上,自展值为98.4%(图4-B)。菌株序列上传至NCBI,基因编号分别为ITS:ON063324、ACT:ON099443、CAL:ON099446、CHS-1:ON099449、GAPDH:ON099452、TUB2:ON099455。结合病原菌形态学鉴定,证明患病蜜桃果实中分离到的真菌为暹罗炭疽菌(C.siamense)。
2.5 深州蜜桃果实腐烂病病菌室内拮抗细菌的筛选
为筛选出对桃褐腐病和桃炭疽病病原菌具有抑制效果的拮抗细菌,对实验室保存的102 株拮抗细菌(编号为JK-1 至JK-102)进行抑菌筛选试验,结果获得6 株拮抗细菌对M.fructicola抑菌率达到50% 以上;9 株拮抗细菌对C.siamense抑菌率达到50%以上。平板对峙试验结果表明,拮抗菌株JK-21 和JK-47 对桃褐腐病原菌和桃炭疽病病原菌均具有明显的抑制效果(图5)。

图5 拮抗细菌JK-21 和JK-47 在PDA 平板上对M. fructicola 和C. siamense 的抑制效果Fig. 5 Antagonistic effect of bacteria JK-21 and JK-47 against M. fructicola and C. siamense on PDA plate
JK-21 对桃褐腐病和桃炭疽病病原菌抑菌平均直径分别为1.833 和1.967 cm;JK-47 对桃褐腐病和桃炭疽病病原菌抑菌平均直径分别为1.633 和2.667 cm,拮抗菌株JK-21 对桃褐腐和桃炭疽病病原菌抑菌率最高,分别为75.1%和70%;拮抗菌株JK-47对桃褐腐和桃炭疽病病原菌抑菌率次之,分别为77.8%和59.7%。因此,后续可选用这2 株拮抗细菌为桃褐腐和桃炭疽病病原菌的生防菌,进一步展开相关研究。
3 结论与讨论
本研究通过对深州桃园进行调查发现深州蜜桃腐烂发生情况,对河北省深州蜜桃腐烂病样品进行组织分离、纯化、柯赫氏法则实验验证病原菌菌株种类。根据培养病原菌菌株、孢子形态观察、多基因序列系统发育分析和致病性检测,结合已报道的关于褐腐病菌和炭疽病菌的描述[14-15],鉴定引起蜜桃腐烂病的两种病原菌分别为美澳型核果链核盘菌(M.fructicola)和暹罗炭疽菌(C.siamense)。本研究为探究河北深州蜜桃腐烂病的田间防控提供了依据。
褐腐病菌和炭疽病菌寄主范围广泛,具有丰富的遗传多样性,其形态特征、致病力和近似种等之间差异微小,有时会存在多种病菌同时侵染同一种寄主上的现象,对病害诊断造成影响[16-19]。病原菌的鉴定通常采用形态观察、分子生物学鉴定和多基因序列分析,多基因序列分析可以鉴定不同属之间的亲缘关系,也有人利用多基因系统发育分析结合形态学特征分析的综合方法,用于鉴定病原菌种类[17];李河等[18]利用ITS、CAL 和GAPDH 基因进行综合分析,根据形态特征及多基因系统发育树分析,对采集自我国6 个省市油茶产区的炭疽病样进行了鉴定,其中23 株病原菌被鉴定为果生刺盘孢菌C.fructicola。张丽琼[19]通过构建G3PDH 和TUB2系统发育进化树,并结合形态学鉴定,明确了引起上海地区桃褐腐病病原菌主要为M.fructicola。参考以上研究方法,本研究依据ITS、GAPDH、TUB2 多基因序列分析构建多基因系统发育树和形态学分析,明确了深州地区引起蜜桃褐腐病病原菌为美澳型链核盘菌(M.fructicola),基于ITS、GAPDH、TUB2、ACT、CAL、CHS-1 等多基 因序列分析构建多基因系统发育树和形态学分析,明确了深州地区引起桃炭疽病病原菌为暹罗炭疽菌(C.siamense)。
在桃果实生长期间,喷施杀菌剂仍是桃果实病害防治的主要手段,常用药剂有多菌灵、百菌清、吡唑醚菌酯等,为了增加桃产量及减少各种病害,长期使用化学药剂会导致病原菌产生抗药性,增加药剂残留量以及污染环境等问题。近年来,生物防治因其安全、高效、无残留等特点在病害防控领域逐渐成为研究的热点,目前已有报道从高产桃园土壤中分离、筛选具有防治作用的细菌菌株,对不同病原菌引起的桃褐腐病均具有良好的抑制效果,袁雪等[21]筛选到特基拉芽孢杆菌Bacillus tequilensis对桃褐腐病病原菌的抑菌率为74.48%,拮抗细菌可能降解致病因子,导致致病因子不能正常的发挥作用,减少了病原菌对桃的侵染。潘朝勃等[22]筛选到对杧果炭疽有防治效果的枯草芽胞杆菌Bacillus subtilis,抑菌率在88.83%。本研究通过筛选获得拮抗细菌JK-21 对美澳型核果褐腐病菌(M.fructicola)和暹罗 炭疽菌(C.siamense)的抑菌率分别为75.1% 和70%;JK-47 对美澳型核果褐腐病菌(M.fructicola)和暹罗炭疽菌(C.siamense)的抑菌率分别为77.8%和59.7%,对预防深州蜜桃果实病害发生具有重要的应用价值,后续关于2 种生防菌的作用生防机制及田间的应用防效有待进一步研究。
