尿路上皮癌抗原1促进滋养细胞功能及对上皮-间质转化转化的调控作用
2023-12-11孙建华张逸杨丽萍周立卢喜洋李久现陈萍
孙建华,张逸,杨丽萍,周立,卢喜洋,李久现,陈萍
1河南中医药大学第一临床医学院,河南 郑州 450046;2河南中医药大学第一附属医院妇产科,河南 郑州450099
异位妊娠是妇产科常见的急腹症,也是导致妊娠早期孕妇出血性死亡的主要原因,发病率约2%,其中输卵管妊娠(TP)最为常见[1,3]。做为二氢叶酸还原酶抑制剂,甲氨蝶呤可以抑制滋养细胞增殖,破坏绒毛活性,是目前治疗TP的一线用药,但存在肝、肾功能损害、脱发、骨髓抑制等不良反应[1]。因此,深入了解TP发生、发展的分子机制,探索新的治疗靶点仍至关重要。
LncRNA是一种长度大于200 nt的RNA分子,不参与蛋白质编码,但可以调控细胞增殖、分化、侵袭、迁移、凋亡等多种生物学功能的发挥[4,5],LncRNA表达异常和胃癌、食管鳞状细胞癌、膀胱癌等多种肿瘤疾病的发生有关[6-8],还可引起复发性流产、先兆子痫等妇产科疾病[9-13]。尿路上皮癌抗原1(UCA1)是一种首次在膀胱癌中发现并得名的lncRNA,其表达失调不仅可以促进肿瘤的发生、发展[8,14],还和子痫前期、妊娠期高血压、妊娠丢失等多种妇产科疾病的发生有关[15-18]。研究表明,UCA1低表达可使滋养细胞侵袭、迁移能力减弱,造成滋养细胞侵袭不足,从而导致流产等疾病发生[17,18]。而输卵管妊娠破裂导致的急腹症却和滋养细胞不断向输卵管侵袭密切相关。然而,UCA1是否介导了TP的发病机制仍不清楚。
本研究拟制备TP滋养细胞模型探讨UCA1表达变化,观察UCA1对滋养细胞侵袭、迁移等生物学功能的作用,并对其潜在分子机制进行评价,以期为TP药物治疗的靶点探索提供参考。
1 材料和方法
1.1 材料细胞株
人绒毛膜滋养层细胞株HTR-8/SVneo购自广州吉妮欧生物科技有限公司。
1.2 主要试剂耗材与仪器
无水乙醇、甲醇(上海阿拉丁生化科技股份有限公司),胎牛血清、双抗(青链霉素、链霉素)、RPMI 1640培养基、Opti-MEM培养基、PBS 缓冲液、基质胶(Gibico),多聚甲醛固定液、结晶紫(白鲨生物科技公司),Lipofectamine3000(Thermo),UCA1 siRNA、UCA1 阴性对照(广州达弘生物科技有限公司),实时荧光定量PCR试剂盒(Promega),RIPA蛋白裂解液(弗德生物科技有限公司),Trizol、SDS-PAGE凝胶配制试剂盒(上海翊圣生物科技有限公司),PVDF膜(Merck Millipore),兔抗E-cadherin 抗体(SAB),兔抗Vimentin 抗体(Abcam),兔抗N-cadherin抗体、兔抗integrin β3抗体、山羊抗兔荧光二抗(CST),细胞培养皿、细胞培养板、Transwell培养小室(Corning),离心机(Eppendorf),倒置光学显微镜(AxioObserver),Real time PCR引物序列由擎科生物科技有限公司合成,酶标仪(Tecan),电泳仪、转膜电泳槽(Bio-rad)、逆转录仪、qPCR 仪名称(BIO-RAD)。
1.3 方法
1.3.1 细胞模型制备 行划痕实验(具体见1.3.4)后加入IL-6干预HTR-8/SVneo细胞,使其终浓度为5 ng/mL。根据是否采用IL-6干预将两组细胞分别命名为IL-6组及其空白对照NC组。
1.3.2 细胞培养 HTR-8/SVneo细胞以RPMI 1640培养基(10%FBS、1%青链霉素双抗)于37 ℃、5%CO2的细胞培养箱中进行常规培养。细胞铺满培养皿表面75%~85%时,以0.25%的胰酶消化传代。
1.3.3 细胞转染 细胞接种于六孔板后以10%FBS(不含抗生素)培养,贴壁过夜使细胞密度达30%~50%。用125 μLOpti-MEM稀释5 μLlipo3000,125 μLOpti-MEM稀释2 μg siRNA,把稀释的lipo3000和siRNA轻轻混匀,室温孵育15 min,加入待转染细胞的培养基中。根据是否转染UCA1 siRNA 将两组细胞分别命名为si-UCA1组及其阴性对照NC组。
1.3.4 划痕实验检测细胞迁移 显微镜下观察细胞融合约90%时,用200 μL的枪头垂直于6孔板板底用力划痕。用PBS 将细胞轻轻漂洗后吸弃,加入2 mL 1%FBS 并于显微镜下拍照(×40),继续放入培养箱中培养24 h。显微镜下观察HTR-8/SVneo 细胞迁移情况并拍照记录及观察比较。
1.3.5 Transwell侵袭实验检测细胞侵袭 Matrigel基质胶溶解稀释后铺于Transwell小室,37 ℃孵育过夜使胶凝固。细胞消化后以无血清的培养基进行洗涤并重悬,调整细胞密度至1×105/mL,每小室加入200 μL细胞悬液,20%的FBS加入下室,于37 ℃、5%CO2的细胞培养箱中孵育24 h取出,PBS漂洗后用4%多聚甲醛固定、100%甲醇透化、0.1%结晶紫染色液染色,棉签轻轻擦去上室内细胞,于倒置显微镜下观察并记录各组穿膜细胞数并拍照(×100),每个小室随机选择5个视野进行拍照。
1.3.6 RT-qPCR 检测细胞mRNA 及UCA1 表达水平按Trizol试剂盒说明书提取细胞总RNA。按试剂盒说明书将提取的总RNA逆转录为cDNA。PCR扩增反应条件:95 ℃10 min进行变性;45℃1 min退火;95 ℃5 s,60 ℃60 s,40个循环进行扩增。以GAPDH基因为内参,以2-ΔΔCt法对目标基因进行检测。引物序列见表1。

表1 qRT-PCR引物序列Tab.1 Primer sequences for quantitative real-time PCR
1.3.7 Western blot 检测各组细胞相关蛋白表达水平将处理完成的细胞以PBS漂洗3次,加入RIPA缓冲液进行充分裂解,提取总蛋白,检测浓度后加入loading buffer并煮沸变性。SDS-PAGE凝胶电泳分离等量的蛋白质,经转膜、封闭后加一抗4 ℃孵育过夜,加二抗常温孵育1 h,TBST冲洗后进行显影并于凝胶成像系统曝光取像。使用Image J软件分析条带灰度值,根据内参GAPDH进行灰度值校正,再以对照组为标准进行归一化处理。
1.4 统计学分析
采用SPSS 21.0软件进行数据统计分析,GraphPad prism7软件进行绘图。数据以均数±标准差表示,两组间数据差异采用t检验进行比较,P<0.05时认为差异具有统计学意义。
2 结果
2.1 IL-6 对HTR-8/SVneo 细胞迁移及UCA1 表达的影响
与空白组比较,IL-6处理组细胞迁移距离明显增加,UCA1表达含量显著上调(P<0.01,图1)。
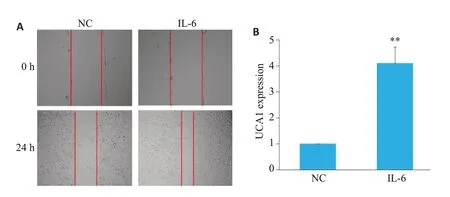
图1 IL-6对HTR-8/SVneo细胞迁移及UCA1表达的影响Fig.1 Effect of IL-6 on HTR-8/SVneo cell migration and UCA1 expression.A:Wound healing assay of the cells(Original magnification:×40).B:UCA 1 expression level in control and IL-6-treated cells.**P<0.01 vs negative control(NC)group.
2.2 将UCA1 siRNA瞬时转染至HTR-8/SVneo细胞对UCA1表达进行下调
将UCA1 siRNA瞬时转染至HTR-8/SVneo细胞,qRT-PCR实验结果显示,UCA1 siRNA转染后HTR-8/SVneo细胞UCA1表达显著下调(P<0.01,图2)。
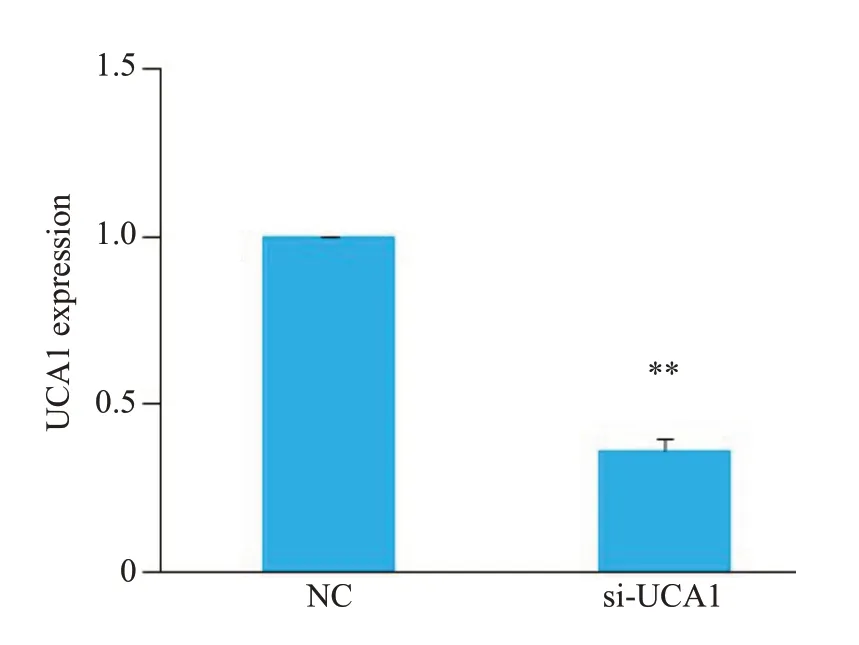
图2 转染UCA1 siRNA后两组HTR-8/SVneo细胞UCA1表达Fig.2 Changes in expression level of UCA1 in HTR-8/SVneo cells after transfection with UCA1 siRNA.**P<0.01 vs NC group.
2.3 下调UCA1表达抑制HTR-8/SVneo细胞迁移和侵袭
采用划痕实验检测细胞迁移,Transwell实验检测细胞侵袭,结果显示,si-UCA1组细胞迁移距离明显小于对照组,细胞侵袭个数明显少于对照组(P<0.01,图3)。

图3 两组HTR-8/SVneo细胞迁移、侵袭能力比较Fig.3 Changes in migration and invasion abilities of HTR-8/SVneo cells after transfection with UCA1 siRNA.A:Wound healing assay of the cells(×40).B:Transwell invasion assay of the cells(×100).C:Number of invasion cells in NC and si-UCA1 group.**P<0.01 vs NC group.
2.4 下调UCA1表达抑制HTR-8/SVneo细胞上皮-间质转化(EMT)特性
RT-qPCR 结果显示,与对照组比较,转染UCA1 siRNA 后,HTR-8/SVneo 细胞EMT 上皮标志物Ecadherin mRNA 表达显著上调(P<0.01),间质标志物integrin β3、Vimentin、N-cadherin mRNA表达显著下调(P<0.05)。Western Blot结果显示,与对照组比较,转染UCA1 siRNA后,HTR-8/SVneo细胞EMT上皮标志物E-cadherin 蛋白表达显著上调(P<0.01),间质标志物integrin β3、Vimentin、N-cadherin 蛋白表达显著下调(P<0.01,图4)。
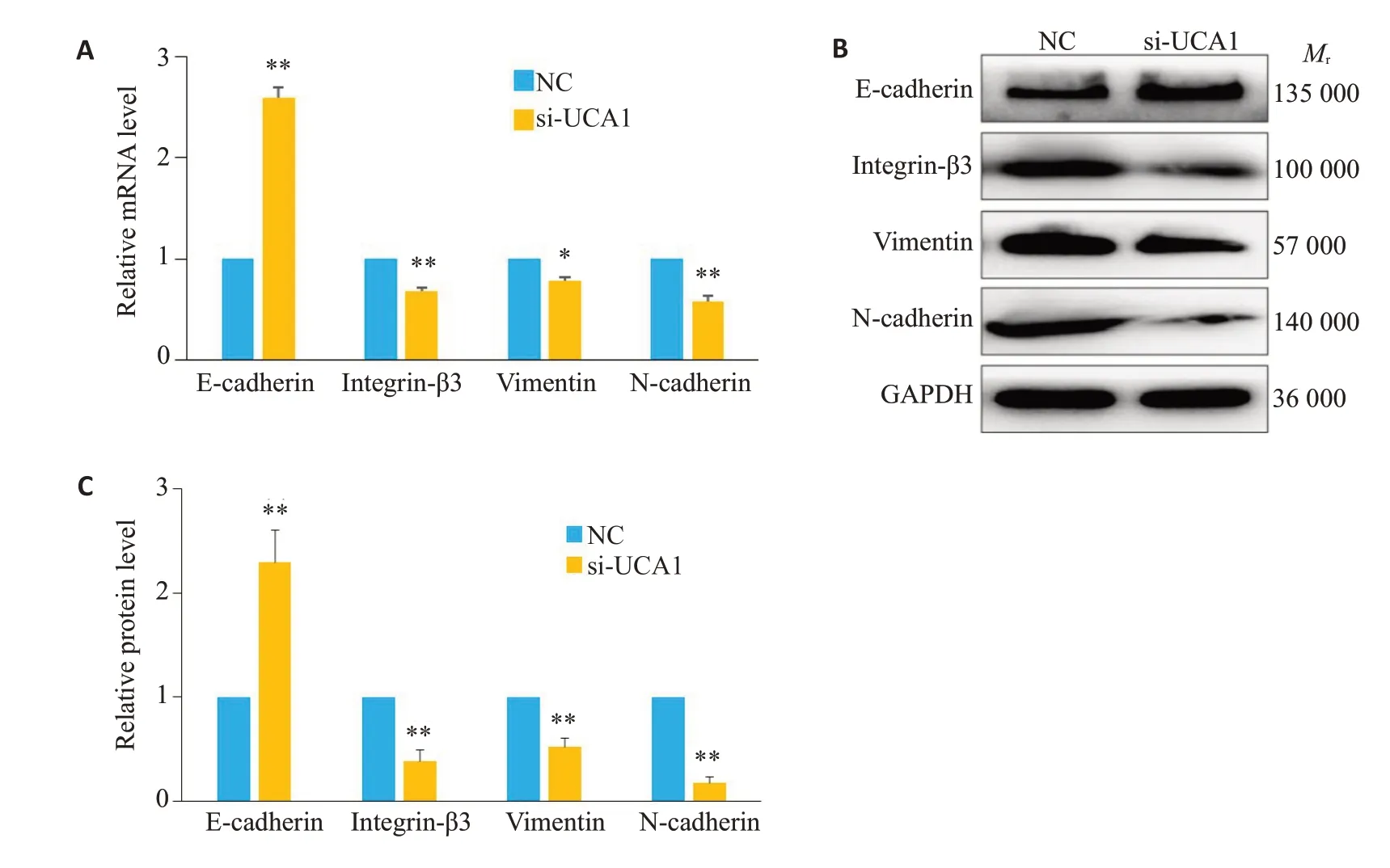
图4 两组HTR-8/SVneo细胞EMT标志物表达Fig.4 Expression levels of mRNA or proteins of EMT markers in HTR-8/SVneo cells transfected with UCA1 siRNA.A: mRNA expressions of the markers.B,C: Relative protein levels of Ecadherin,integrinβ3,vimentin and N-cadherin in HTR-8/SVneo cells in NC and si-UCA1 group.*P<0.05,**P<0.01 vs negative control group.
3 讨论
UCA1是一种人类特异性lncRNA,已有报道显示其参与子痫前期的发病机制。通过促进滋养层细胞局部缺氧适应,UCA1可通过循环外泌体将胎盘应激与内皮损伤联系起来[19]。与此同时,UCA1高表达也被报导和多种肿瘤细胞侵袭及疾病进展相关[20-22]。众所周知,在胚胎着床过程中滋养细胞介导的侵袭、迁移的特点和肿瘤细胞具有高度的相似性[23]。胚胎在子宫内正常着床时,滋养细胞侵袭受到精准调控,使得滋养细胞最终穿透蜕膜层侵袭至肌层内1/3[23]。而发生输卵管妊娠时这种“有控”的调节机制出现紊乱,滋养细胞不断向输卵管肌层及浆膜层过度侵袭可导致输卵管破裂[24]。因此,研究滋养细胞侵袭迁移功能的调控机制,对于发现异位妊娠的潜在治疗靶点具有重要的意义。本研究中,我们通过IL-6干预HTR-8/SVneo细胞模拟输卵管妊娠滋养细胞模型,分别用迁移实验和transwell侵袭实验检测HTR-8/SVneo细胞迁移和侵袭能力,并检测模型条件下UCA1表达水平。结果发现,经IL-6处理后HTR-8/SVneo细胞侵袭及迁移能力均显著增强,且细胞UCA1表达含量明显提高,提示TP滋养细胞侵袭及迁移能力增强可能和UCA1 高表达相关。因此,我们采用小RNA干扰技术敲低UCA1在HTR-8/SVneo细胞中的表达,通过实时荧光定量PCR法检测UCA1表达以验证转染效果,transwell侵袭及迁移实验检测UCA1敲低后HTR-8/SVneo细胞侵袭、迁移能力。结果提示,siRNA干扰后UCA1表达明显下调,HTR-8/SVneo细胞侵袭及迁移能力均明显下降,反向证明了UCA1对滋养细胞侵袭和迁移的促进作用。Shao 及Xu 等团队研究了UCA1 在复发性流产发病中的作用,结果表明敲低UCA1能够抑制HTR-8/SVneo细胞活力并减弱细胞增殖和侵袭迁移能力,这和我们下调UCA1 表达抑制HTR-8/SVneo细胞侵袭、迁移的研究结果一致[17,18]。不同的是,我们首次探讨了UCA1在TP中可能发挥的关键作用。
肿瘤细胞的EMT是一种上皮向间充质转化的生物学过程。在肿瘤进展过程中EMT路径激活可致细胞间连接断裂、细胞极性丧失、基底膜降解及细胞外基质重组,从而促进肿瘤细胞的侵袭、迁移、转移和耐药[25]。EMT发生后上皮标志蛋白E-cadherin表达下调,间质标志蛋白N-cadherin、integrin β3、Vimentin 表达上调[23]。这些标志蛋白除介导肿瘤细胞EMT外,还在其他细胞的粘附及侵袭中发挥关键的调控作用,特别是在滋养细胞的介导的胚胎着床中也充当重要角色。虽然以往文章报道了UCA1通过调控HIF-1a影响胚胎对缺氧环境的适应性,但并未涉及其侵入肌层的功能,且在异位妊娠中的作用亦不明确[19]。既往研究表明,在膀胱癌、乳腺癌等疾病中UCA1表达失调和肿瘤EMT及疾病进展有一定的相关性[26,27]。本研究发现UCA1表达增强可促进滋养细胞侵袭及迁移能力,然而UCA1是否介导滋养细胞EMT 仍不清楚,因此我们采用qRT-PCR 及Western Blot 检测UCA1 沉默后HTR-8/SVneo细胞EMT 上皮及间质标志物mRNA 及蛋白的表达含量,结果显示,上皮标志分子E-cadherin mRNA及蛋白表达上调,间质标 志分子N-cadherin、integrin β3、Vimentin mRNA及蛋白表达下调,提示在滋养细胞中UCA1可以通过影响EMT相关分子促进滋养细胞侵袭和迁移。本研究首次揭示了UCA1可以通过调控EMT促进HTR-8/SVneo细胞侵袭和迁移。然而,本研究未能将UCA1直接调控的miRNA及下游作用靶点进行完整阐述。
综上所述,在发生胚胎着床过程中,LncRNA UCA1可能发挥关键的调控功能,其通过介导EMT相关蛋白高表达,增强滋养细胞的侵袭、迁移能力,从而导致其不断侵袭输卵管的严重危害。本研究初步阐释了UCA1对滋养细胞侵袭、迁移功能的影响及UCA1与EMT相关蛋白的关系,为TP药物治疗突破提供了初步实验依据。