免疫检查点抑制剂在胃肠道恶性肿瘤新辅助治疗中的应用研究进展
2023-12-11杜晓宇范瑞芳许淑梅宋雷许威杨佳兴程允华李路遥马尚阎龙
杜晓宇,范瑞芳,许淑梅,宋雷,许威,杨佳兴,程允华,李路遥,马尚,3,阎龙
(1.中国人民解放军联勤保障部队第九四〇医院 普通外科,甘肃 兰州 730050;2.西北民族大学医学院,甘肃 兰州 730030;3.甘肃省干细胞与基因药物重点实验室,甘肃 兰州 730050;4.甘肃中医药大学 第一临床医学院,甘肃 兰州 730000)
胃肠道恶性肿瘤是目前世界范围内发病率和病死率较高的恶性肿瘤,2020年全世界胃癌(gastric cancer,GC)和结直肠癌(colorectal cancer,CRC)的新发患者数为302 万例,死亡总数为171 万例,GC的发病率与病死率分别位于世界第五和第四,CRC的发病率与病死率分别位于世界第三和第二[1]。中国作为胃肠道恶性肿瘤大国之一,2020年GC 和CRC 的发病率与病死率分别合计为22.7%和21.9%,且大部分胃肠道恶性肿瘤患者在确诊时已处于中晚期/进展期。在治疗方面,外科手术为主辅以放化疗的传统治疗方案虽然能取得一定的效果,但术后复发率仍然较高,5年生存率仍然较低[2-3]。因此,如何降低局部晚期/进展期胃肠道恶性肿瘤患者的术后复发率,延长患者生存时间成为一个急需解决的问题,而旨在降低肿瘤分期、减少术后复发风险和延长患者生存时间的新辅助治疗成为当下研究人员关注的热点。新辅助治疗的目的是降低肿瘤分期,提高完全切除(R0切除) 率,并诱导最大程度的病理缓解,从而延长癌症患者的生存时间[4]。2022年版胃癌诊疗指南[5]针对≥cT3/4 N+M0 期的胃癌患者推荐新辅助化疗。2020年版中国结直肠癌诊疗规范[6]推荐新辅助放化疗仅适用于距肛门<12 cm 的直肠癌,针对初始局部可切除的T4b 期结肠癌推荐通过多学科讨论决定是否行新辅助化疗。当前胃肠道恶性肿瘤的新辅助治疗方案,主要为术前放疗和化疗,治疗效果有待提升。
近些年来,免疫治疗作为一种新型疗法逐渐被人们所关注。临床研究表明,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的新辅助治疗对比辅助治疗可以使黑色素瘤、神经胶质瘤患者得到更佳的生存时间获益[7-8]。最近两项Ⅲ期临床试验结果表明,与化疗相比,帕博丽珠单抗(pembrolizumab,K 药) 联合化疗在局部晚期食管癌/胃食管交界(gastroesophageal junction,GEJ)癌患者中展现出更佳的生存时间获益和相当的安全性[9],K 药单药治疗在不可切除或转移性微卫星不稳定性高(microsatellite instability-high,MSI-H)/错配修复缺陷(mismatch repair deficient,dMMR)CRC患者的无进展生存时间(progression-free survival,PFS)方面提供了具有统计学意义和临床意义的改善[10]。美国食品和药物管理局(Food and Drug Administration,FDA)基于既往Ⅲ期临床试验研究的良好生存效果,批准了程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)抑制剂,如K 药、纳武利尤单抗(nivolumab,O 药)等与细胞毒性T 淋巴细胞相关蛋白4(cytotoxic T lymphocyteassociated protein 4,CTAL-4)抑制剂用于晚期胃肠道恶性肿瘤的一、二线治疗。
随着对新辅助治疗的重视,研究人员开展了多项将ICIs 应用于恶性肿瘤新辅助治疗中的研究探索。CheckMate-816 (NCT02998528) 研究[11]表明,O 药加铂类双药的术前新辅助治疗可显著延长可切除非小细胞肺癌 (non-small cell lung cancer,NSCLC)患者的PFS 且病理学完全缓解(pathologic complete response,pCR)率更高。基于此研究,美国FDA 于2022年3月首次批准O 药用于早期NSCLC患者的新辅助治疗。最近Tang 等[12]利用数据库对PD-1/PD-L1 抑制剂在胃肠道恶性肿瘤新辅助治疗下的单一疗法或联合疗法进行了全面搜索和筛选分析,数据表明与PD-1/PD-L1 单一疗法或双重免疫疗法相比,采用PD-1/PD-L1 抑制剂联合疗法,特别是ICIs 联合化疗的术前新辅助治疗可以提高患者的客观缓解(objective response rate,ORR)率、主要病理缓解(major pathologic response,MPR)率和pCR率,降低免疫相关不良事件的发生率。目前,ICIs并没有获批应用于胃肠道恶性肿瘤的新辅助治疗,但鉴于其在晚期胃肠道恶性肿瘤治疗中的应用效果,研究人员开始探索ICIs 在胃肠道恶性肿瘤新辅助治疗中的应用。
1 ICIs 在晚期胃肠道恶性肿瘤治疗中的应用现状
1.1 ICIs在晚期不可切除/转移性GC化疗免疫组合治疗中的应用现状
临床研究表明ICIs 联合化疗可以显著改善不可切除、转移性或晚期的胃/GEJ 腺癌、人表皮生长因子受体2 (human epidermal growth factor receptor 2,HER-2) 阴性/阳性GC 患者的预后。2020年的一项随机、开放的Ⅲ期研究(CheckMate-649)[13]开启了晚期GC 一线免疫治疗的新时代,研究结果显示对比单独化疗,O 药联合化疗可以显著延长不可切除、非HER-2 阳性晚期胃/GEJ 癌患者的总生存时间(overall survival,OS)并带来显著的PFS 获益。CheckMate-649 (NCT02872116) 研究[13]的成功标志着GC 治疗模式的极大改变,将晚期GC的一线治疗带入免疫治疗时代,FDA 于2021年批准O 药联合含氟嘧啶和铂的化疗方案用于晚期或转移性GC、GEJ 癌和食管腺癌,同年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN) 根据此研究发布的GC 治疗指南指出,HER-2 过表达阴性且PD-L1 的晚期GC 患者一类推荐O 药联合化疗方案。而针对HER-2 阳性GC 患者的诊治,随机、 双盲、 安慰剂对照的Ⅲ期KEYNOTE-811 (NCT03615326) 研究[14]发现,与曲妥珠单抗联合化疗相比,K 药加曲妥珠单抗联合化疗使HER-2 阳性GC 患者的ORR 显著提高、肿瘤体积显著缩小,确立了K 药加曲妥珠单抗联合化疗药物用于局部晚期不可切除或转移性HER-2 阳性胃或GEJ 腺癌患者的一线治疗。上述研究表明,ICIs 的代表药物K 药和O 药均在晚期不可切除/转移性GC 的化疗免疫组合治疗中展现出显著的疗效,从而为ICIs 在局部进展期可切除/潜在可切除GC 新辅助治疗中的应用拓宽了新路径。
1.2 ICIs 在晚期不可切除/转移性CRC 免疫治疗中的应用现状
临床研究表明ICIs 单药和双药可以显著改善晚期不可切除或转移性MSI-H/dMMR CRC 患者的预后。CA209142(CheckMate-142;NCT02060188)[15-16]是一项多中心、开放性、单臂Ⅱ期研究,研究结果显示O 药单药或联合伊匹木单抗治疗均可使不可切除或转移性MSI-H 或dMMR CRC 患者得到临床获益。FDA 分别于2017年和2018年先后批准O 药单药或联合伊匹木单抗用于治疗在氟嘧啶、奥沙利铂和伊立替康治疗后进展的12 岁及以上MSI-H 或dMMR 转移性CRC 患者,从而开启了晚期CRC 一线免疫治疗的新时代。多中心、国际性、开放性、主 动 对 照 、 随 机 的 Ⅲ 期 KEYNOTE-177(NCT02563002)研究[10,17]显示,与化疗相比,K 药使不可切除或转移性MSI-H 或dMMR CRC 患者表现出统计学和临床意义的PFS 改善、持久的抗肿瘤活性和较少的治疗相关不良事件,从而确立了K 药用于MSI-H 或dMMR 转移性CRC 患者的一线治疗。上述研究表明,ICIs 的代表药物K 药和O 药均在晚期不可切除/转移性MSI-H 或dMMR CRC 的免疫治疗中展现出显著的疗效,从而为ICIs 在局部进展期可切除/潜在可切除CRC 新辅助治疗中的应用拓宽了新路径。
2 ICIs在局部进展期GC新辅助治疗中的应用研究
2.1 ICIs 在局部进展期GC 新辅助治疗中的应用现状
最近一项关于GC 新辅助免疫治疗的荟萃分析[18]表明,与新辅助化疗相比,基于ICIs 的新辅助治疗对局部进展期GC 患者的pCR 率更高、毒性更低,并支持在大型多中心随机试验中进一步研究。尽管多项I/Ⅱ期临床研究[19-31]结果显示,ICIs 新辅助治疗在降低肿瘤分期、提高R0切除率和pCR 率等方面取得了显著的效果,但是受限于研究分期短和样本量小,ICIs 暂时还不能应用于局部进展期GC的新辅助治疗。KEYNOTE-585(NCT03221426)[32]是一项正在进行的全球性、多中心、随机、双盲、Ⅲ期研究,最新研究结果显示与安慰剂加化疗相比,新辅助/辅助K 药联合化疗使局部进展期胃或GEJ 腺癌患者的pCR 率实现了统计学意义的改善,其虽未达到无事件生存时间(event-free survival,EFS)的主要终点,但具有改善的趋势[33]。大样本Ⅲ期GC 新辅助免疫疗法的研究结果虽不足以支持PD-1 抑制剂在GC 新辅助治疗中的一线临床应用,但也具有一定的临床意义。后续的大样本Ⅲ期GC新 辅 助 PD-1 抑 制 剂 研 究 (NCT04208347;NCT04139135)[34-35]与新辅助PD-L1 抑制剂研究(MATTERHORN;NCT04592913)[36]将会深入揭示ICIs 在GC 新辅助治疗中的临床应用价值,无论研究结果如何,都将为GC 的新辅助免疫治疗及免疫治疗提供临床与基础研究指导意义(表1)。

表1 正在开展的GC ICIs新辅助治疗Ⅲ期临床试验Table 1 Ongoing Phase Ⅲ clinical trials of neoadjuvant therapy with immune checkpoint inhibitors for GC
2.2 ICIs 在局部进展期GC 患者新辅助治疗中的疗效
2.2.1 ICIs 新辅助治疗对局部进展期GC 患者肿瘤分期和pCR 率的影响一项Ⅱ期试验研究(Neo-PLANET;NCT03631615)[22],治疗方案为新辅助卡瑞丽珠单抗联合放化疗,局部进展期胃或GEJ 腺癌患者接受治疗后的pCR 率为33.3%,总病理学完全缓解(total pathologic complete response,TpCR) 率和MPR 率分别为33.3%、 44.4%,28 例患者(77.8%)达到ypN0(GC 淋巴结阴性)。浙江大学医学院附属第一医院开展了一项前瞻性、单臂Ⅱ期研究(NCT04065282)[23],治疗方案为新辅助信迪利单抗联合化疗,局部进展期可切除胃或GEJ 腺癌患者接受治疗后的pCR 率与MPR 率分别为19.4%(7/36) 和47.2% (17/36),27 例患者(75%) TNM 分期整体下降,21 例患者(58.3%)达到ypN0。2023年美国临床肿瘤学会年会(American Society of Clinical Oncology,ASCO)报道了一项多中心、开放标签、Ⅱ期随机对照试验(randomized controlled trial,RCT)(NCT04250948)[30],治疗方案为新辅助特瑞普利单抗联合化疗,局部进展期可切除胃或GEJ 腺癌患者接受治疗后的pCR 率为24.1%,24 例患者(44.4%) 达到肿瘤消退等级(tumor regression grade,TRG)0/1,25 例患者(46.3%)达到ypT0-2(GC 原发肿瘤深度未到浆膜层)。在以上ICIs 新辅助治疗的最新临床研究中,局部进展期胃或GEJ 癌患者的pCR 率和MPR 率显著提高、肿瘤降期效果显著提升,证实了ICIs 可以在新辅助治疗中显著降低局部进展期GC患者的临床肿瘤分期,提高pCR率。
2.2.2 ICIs 新辅助治疗对局部进展期GC 患者R0 切除率的影响NEONIPIGA (NCT04006262)[19]是一项由 GERCOR 推动的法国单臂、多中心学术Ⅱ期研究,治疗方案为术前O 药和伊匹木单抗治疗以及术后O 药治疗,局部进展期dMMR/ MSI-H 胃或GEJ腺癌患者接受治疗后的R0切除率为100%(29/29)。加拿大麦吉尔大学健康中心/麦吉尔大学健康中心研究所的Alcindor 等[29]开展了一项单中心、开放标签、Simon 二阶段、单臂Ⅱ期研究,治疗方案为新辅助阿维鲁单抗联合化疗,局部进展期胃食管腺癌(gastroesophageal adenocarcinoma,GEA) 患者接受治疗后的R0切除率为96%。南京大学医学院附属鼓楼医院开展了一项前瞻性、多中心、单臂Ⅱ期研究(SHARED)[21],治疗方案为新辅助信迪利单抗联合同步放化疗 (concurrent radiotherapy,cCRT),局部进展期胃或GEJ 腺癌患者接受治疗后的R0切除率为94.7%。以上研究显示,局部进展期GC 患者经ICIs 新辅助治疗后的R0切除率均大于90%,证实了ICIs 可以在新辅助治疗中显著提高局部进展期GC 患者的R0切除率。
2.2.3 ICIs 新辅助治疗对局部进展期GC 患者生存时间的影响梅奥诊所(Mayo clinic)开展了一项前瞻性、单臂Ib/Ⅱ期试验研究(NCT02730546)[25],与一项独立的倾向评分匹配队列(接受CROSS 治疗而不进行免疫治疗)患者相比,PD-L1 高表达可切除GEJ 腺癌患者经新辅助K 药联合放化疗后可获得更长的PFS 和OS。华中科技大学同济医学院附属协和医院开展了一项前瞻性、单组、开放标签的Ⅱ期试验(NCT04890392)[26],治疗方案为新辅助替雷利珠单抗联合替加氟/吉美嘧啶/奥替拉西(S-1)加奥沙利铂(SOX),局部进展期胃或GEJ癌患者接受治疗后的一年总无复发生存时间(recurrence-free survival,RFS) 和OS 分别为90.0%和91.4%。KEYNOTE-585 研究[32]Ⅲ期结果显示,与单独化疗相比,新辅助/辅助K 药联合化疗具有改善局部进展期胃或GEJ 腺癌患者EFS 的趋势,但没有统计学意义。在上述研究中,采用ICIs 新辅助治疗后,局部进展期GC 患者的PFS、RFS、OS 或EFS指标并未到达有效终点,其原因可能是Ⅱ期临床研究样本量过少和随访时间过短,Ⅲ期临床研究数量匮乏。ICIs 在局部进展期GC 新辅助治疗中的生存时间获益效果有待进一步探究和观察。
3 ICIs 在局部进展期CRC 新辅助治疗中的应用研究
3.1 ICIs 在局部进展期CRC 新辅助治疗中的应用现状
最近一项关于CRC 新辅助免疫治疗的单中心真实世界队列研究[39]表明,单药PD-1 抑制剂的新辅助免疫疗法对dMMR/MSI-H 局部进展期结直肠癌(locally advanced colorectal cancer,LACRC) 患者足够安全且非常有效,需要大型、多中心、随机对照Ⅲ期临床试验来验证ICIs 的新辅助免疫疗法在LACRC 的长期疗效和安全性、最佳周期数和预测性生物标志物。研究ICIs 新辅助治疗的多项I/Ⅱ期小样本临床试验[40-53]虽使LACRC 患者获得良好的临床获益,但不能充分支持ICIs 新辅助治疗在LACRC 的应用。正在进行的Ⅲ期研究(NCT04928807、 NCT05484024、 NCT05215379、NCT05752136)[54-57]或将推动ICIs 的新辅助免疫疗法在LACRC 的一线应用治疗(表2)。
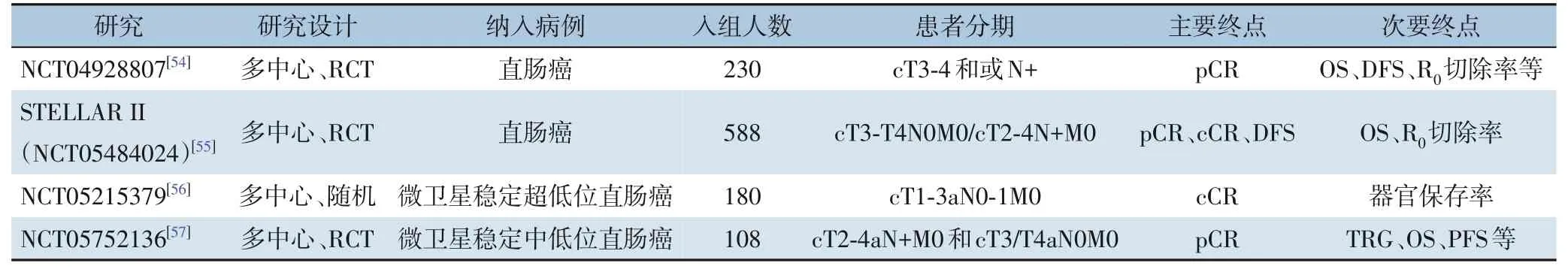
表2 正在开展的CRC ICIs新辅助治疗Ⅲ期临床试验Table 2 Ongoing phase Ⅲ clinical trials of neoadjuvant therapy with immune checkpoint inhibitors for CRC
3.2 ICIs 在局部进展期CRC 患者新辅助治疗中的疗效
3.2.1 ICIs 新辅助治疗对局部进展期CRC 患者肿瘤分期和pCR 率的影响广州中山大学开展了一项开放标签、单臂、Ⅱ 期研究(NCT04304209)[42],治疗方案为新辅助信迪利单抗治疗,dMMR 局部进展期结肠癌患者接受治疗后的pCR 率为50%(3/6),94%(15/16)患者在治疗后首次评估时的肿瘤体积缩小。贝鲁特美国大学医学中心的Shamseddine等[43]开展了一项前瞻性、单臂、多中心Ⅱ期试验(NCT03503630),治疗方案为新辅助放疗后mFOLFOX 联合阿维鲁单抗治疗,局部进展期直肠癌(locally advanced rectal cancer,LARC)患者接受治疗后的pCR 率(TRG 0)为25%(3/12)、MPR 率为50%(6/12),8 例患者(66.6%)达到ypN0。在以上ICIs 新辅助治疗的最新临床研究中,LACRC患者的pCR 率和MPR 率显著提高、肿瘤降期的效果显著提升,证实了ICIs 可以在新辅助治疗中显著降低LACRC 患者的临床肿瘤分期,提高pCR 率。
3.2.2 ICIs 新辅助治疗对局部进展期CRC 患者R0切除率的影响NICHE-2 研究[40]是一项非随机、多中心研究,治疗方案为新辅助O 药和伊匹木单抗治疗,dMMR 局部进展期结肠癌患者接受治疗后的R0切除率为100%。广东中山大学附属第六医院开展了一项单中心、开放标签、平行组、随机、Ⅱ期研究(PICC;NCT03926338)[41],治疗方案为新辅助特瑞普利单抗单药或联合塞来昔布,MSI-H 或dMMR LACRC 患者接受治疗后的R0切除率为100%(34/34)。以上研究显示,LACRC 患者经ICIs 新辅助治疗后的R0切除率较高,证实了ICIs 可以在新辅助治疗中显著提高LACRC 患者的R0切除率。
3.2.3 ICIs 新辅助治疗对局部进展期CRC 患者生存时间的影响多项Ⅱ期临床研究的生存期数据仍在随访中,难以评价ICIs 新辅助治疗对局部进展期CRC 患者生存时间的影响。不过,近期中山大学肿瘤防治中心开展了一项多中心真实世界队列研究[58],该研究纳入了国内3 家中心接受PD-1 抑制剂新辅助治疗的73 例CRC 患者,患者大多为LACRC,结果显示PD-1 抑制剂新辅助治疗在局部dMMR CRC 展现出显著疗效和低复发率。此研究不但是现今CRC 新辅助免疫治疗领域样本量最大的研究,而且是该领域关于长期疗效的首次报道。这在一定程度上说明ICIs 新辅助治疗可以降低局部dMMR CRC 患者的复发转移率,从而改善长期生存。未来发布的Ⅲ期研究结果将会揭示ICIs 新辅助治疗能否使LACRC 患者取得生存时间获益。
4 ICIs 在胃肠道恶性肿瘤新辅助治疗中的安全性
ICONIC是一项单臂Ⅱ期试验(NCT03399071)[59],旨在研究阿维鲁单抗联合FLOT 在可切除食管胃腺癌(oesophagogastric adenocarcinoma,OGA) 围手术期的安全性和有效性,中期安全性分析结果显示,术前新辅助和术后辅助阿维鲁单抗联合FLOT 在可切除OGA 患者手术中未导致意外或异常严重的围手术期并发症。山东大学齐鲁医学院开展了一项单 中 心 、 开 放 、 单 臂 的 Ⅱ 期 研 究(NCT03878472)[24],治疗方案为新辅助卡瑞丽珠单抗联合抗血管生成药物阿帕替尼,局部进展期GC 患者接受治疗后的3~4 级及以上不良反应率为8% (2/25),无Ⅲ级及以上手术并发症。NCRTPD1-LARC 是首都医科大学北京友谊医院开展的一项 前 瞻 性 、 多 中 心 、 单 臂 Ⅱ 期 研 究(NCT04911517)[44],治疗方案为长疗程新辅助放化疗联合替雷利珠单抗,LARC 患者接受治疗后的3~4 级及以上不良反应率为3.8%,未发生4 或5 级不良事件;Ⅲ级及以上手术并发症发生率为3.8%(1/26),未出现术中并发症。以上研究显示,采用ICIs 新辅助治疗后,局部进展期胃肠道恶性肿瘤患者发生的不良反应和手术并发症可接受,说明ICIs在局部进展期胃肠道恶性肿瘤新辅助治疗中的安全性可控。
5 ICIs 在胃肠道恶性肿瘤新辅助治疗中的作用机制
ICIs 是肿瘤免疫治疗的主要方法。在免疫检查点阻断(immune checkpoint blockade,ICB) 方法中,最突出的两种方法是阻断细胞毒性T 淋巴细胞相关蛋白4(CTLA-4 或CD152)和PD-1 或CD279 与PD-L1 或CD274 或B7-H1 之间的相互作用[60],从而增强T 细胞的激活、阻止肿瘤细胞的免疫逃逸。在肿瘤微环境(tumor microenvironment,TME) 中,CD8 T 细胞承担了杀死肿瘤细胞的作用,而调节性T 细胞(regulatory T cell,Treg) 是最具代表性的CD4 免疫抑制细胞[61]。研究[62]表明,可能存在新辅助PD-(L)1 阻断后增强全身抗肿瘤T 细胞免疫的两种潜在机制。一是PD-(L)1 阻断可以导致肿瘤特异性T 细胞克隆在肿瘤微环境中的“原位”扩增;二是PD-(L)1 阻断可以在含肿瘤抗原的树突状细胞(dendritic cells,DC)拾取肿瘤抗原并运输到肿瘤引流淋巴结(tumor-draining lymph node,TDLN)的过程及TDLN 部位发挥作用,增强肿瘤特异性T 细胞的生产性刺激或部分逆转耐受诱导。活化的T 细胞通过传出淋巴管进入循环,然后进入组织。许多研究表明,原发肿瘤内的DC 可以直接启动T 细胞反应,TDLN 也是肿瘤抗原呈递肿瘤特异性T 细胞的关键位点,并且这一过程是通过PD-1通路阻断来增强[62]。Memarnejadian 等[63]在小鼠肿瘤模型中显示,抗PD-1 治疗通过防止亚优势克隆的自相残杀来减轻免疫优势,从而促进抗肿瘤CD8 T细胞反应性中的表位扩散。由以上研究推测,新辅助ICIs 通过在肿瘤细胞的免疫检查点阻断,尤其是新辅助PD-1 阻断,将会导致术前肿瘤特异性T细胞在TME 中的克隆和抗肿瘤CD8 T 细胞的表位扩散,从而最终提高胃肠道恶性肿瘤及其他肿瘤患者的RFS 时间。
6 总结与展望
目前,以ICIs 为基础的多种化疗免疫组合疗法已经被批准用于不可切除、转移性或晚期GC 的一线治疗,以ICIs 为基础的单双免疫治疗已经被批准用于不可切除、转移性或晚期MSI-H/dMMR CRC的一线治疗,并且多个大型Ⅲ期临床研究显示出ICIs 联合化疗与单双ICIs 的治疗效果优于单纯化疗。鉴于此,众多研究人员开始探索是否可以将ICIs 应用到局部进展期可切除/潜在可切除胃肠道恶性肿瘤的新辅助治疗中,最新的多项Ⅱ期临床试验结果表明,ICIs 新辅助治疗可以使胃肠道恶性肿瘤患者得到显著获益,降低患者的肿瘤分期,提高R0切除率和pCR 率,安全性良好。然而,这些Ⅱ期临床研究和Ⅲ期GC 临床研究(KEYNOTE-585)并没有证实这种治疗方法可以给患者带来生存获益,其原因可能是Ⅱ期临床研究样本量过少和随访时间过短,Ⅲ期临床研究数量匮乏。随着多项大样本Ⅲ期临床研究(NCT04208347、NCT04139135、MATTERHORN、STELLAR Ⅱ) 的进展,或将阐明ICIs 在胃肠道恶性肿瘤患者新辅助治疗中的应用效果,ICIs 新辅助治疗在胃肠道恶性肿瘤患者中的应用前景值得期待。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:杜晓宇负责文稿写作;杨佳兴、程允华、李路遥和马尚负责收集复习文献;范瑞芳、许淑梅、宋雷和许威负责校对及修改;阎龙负责指导审阅文章。
