钯催化串联环化反应合成2-苄基-3,4-二羰基-6-苯基-9-乙烯基-2-氮杂螺[4.4]壬烷-7,7-二羧酸乙酯
——介绍一个有机化学综合实验
2023-12-11罗一诚高延峰林维晟苗志伟
罗一诚,高延峰,林维晟,苗志伟,*
1 南开大学化学学院,元素有机化学国家重点实验室,天津 300071
2 武夷学院生态与资源工程学院,福建 武夷山 354300
有机化学综合实验是化学专业本科生在完成有机化学和基础有机化学实验课程学习基础上,针对高年级学生开设的有机化学专业课程。南开大学化学学院在实际工作中将教学与科研紧密结合,通过加强“有机化学综合实验”课程建设,培养学生实际科研能力,帮助学生锻炼实验技能、养成良好的实验习惯、培养创新意识[1-3]。有机化学综合实验课程特点是综合性强,实验内容涉及实验室安全保护措施培训、有机合成实验基本操作训练和实验进程监测方法、反应后处理及化合物纯化方法、有机化合物结构表征手段(核磁共振氢谱、碳谱、高分辨质谱)的运用、有机化学常用作图软件Chemdraw的使用等综合知识的学习和掌握,对培养学生的科研思维和创新意识具有重要意义。本文介绍的有机化学综合实验是南开大学化学学院本科生参加国家大学生创新创业训练计划的研究成果,是以训练本科生的综合实验能力、开拓知识视野、提高科研创新能力为目的而设计的一个有机化学综合实验。
利用过渡金属催化串联环化反应构建分子结构复杂的天然产物分子,以及具有生物和药物活性的复杂分子的策略在有机合成研究领域得到广泛应用[4]。虽然过渡金属催化的有机反应通常具有较高的产率和良好的反应选择性,但由于反应条件严苛,试剂价格昂贵,较少出现在本科教学实验中。本文介绍的有机化学综合实验是以2-乙烯基环丙烷-1,1-二甲酸二乙酯和1-苄基-4-亚苄基-2,3-吡咯烷酮为反应物,利用钯催化串联环化反应高效合成2-苄基-3,4-二羰基-6-苯基-9-乙烯基-2-氮杂螺[4.4]壬烷-7,7-二羧酸乙酯化合物(图1),该实验合成路线长、涉及的实验操作步骤多、综合性强,适合针对化学专业高年级本科生开设,有利于提高学生的实验操作水平,锻炼学生的科研能力。
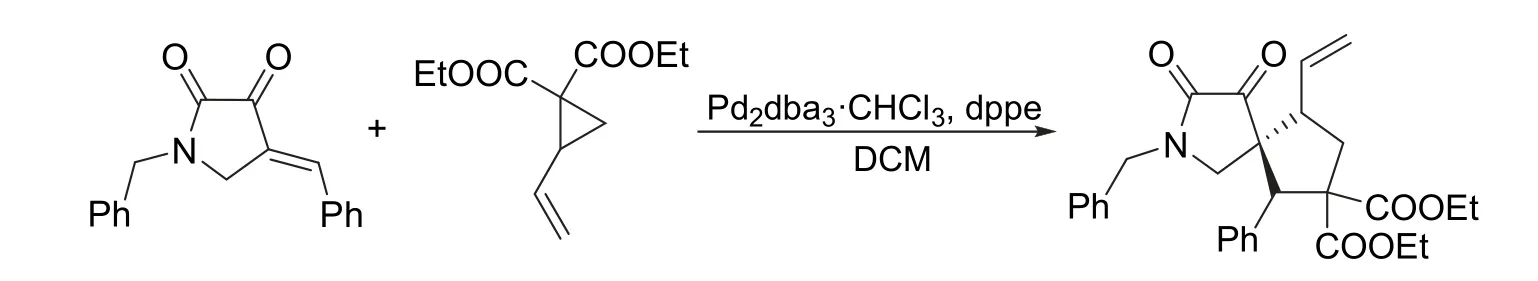
图1 2-苄基-3,4-二羰基-6-苯基-9-乙烯基-2-氮杂螺[4.4]壬烷-7,7-二羧酸乙酯的合成路线
1 实验目的
(1) 掌握多步有机合成的方法和实验操作步骤;
(2) 学习监测反应进程的手段和有机化合物分离纯化方法;
(3) 掌握利用核磁共振氢谱(1H NMR)、碳谱(13C NMR)和高分辨质谱(HRMS)鉴定化合物结构的技术;
(4) 了解实验室安全操作规程及自我保护的方法。
2 仪器和试剂
实验所需要的仪器及其型号和制造商(表1)。

表1 实验所需主要仪器
实验所需试剂及纯度和生产厂家(表2)。
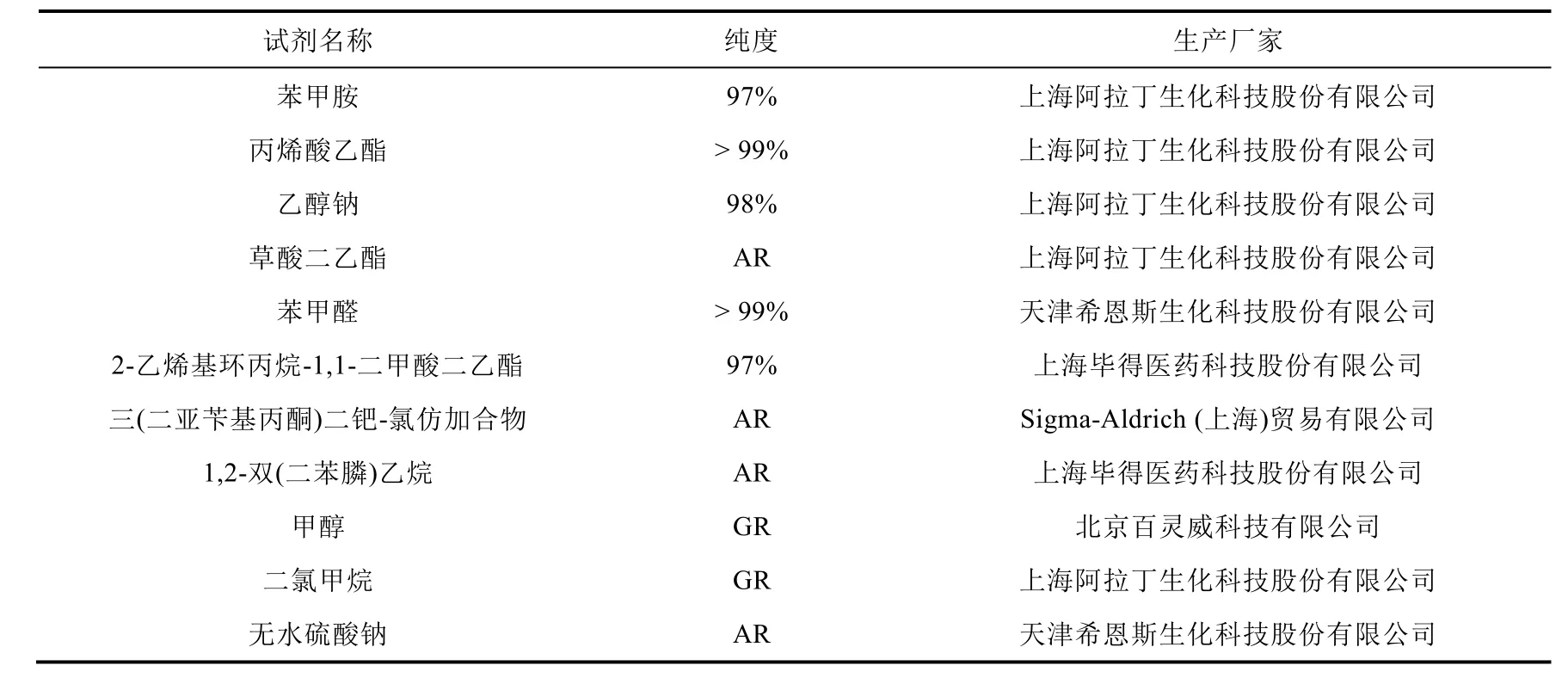
表2 实验所需主要试剂
3 实验步骤
3.1 1-苄基-4-亚苄基-2,3-吡咯烷酮7的合成(图2) [5]
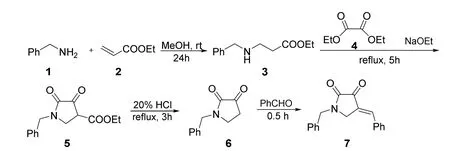
图2 1-苄基-4-亚苄基-2,3-吡咯烷酮的合成
将苄胺1 (2.14 g,20 mmol)溶于25 mL甲醇,在氮气保护下加入新蒸的丙烯酸乙酯2 (2.00 g,20 mmol),将此无色混合物在室温下搅拌24 h。减压浓缩除去溶剂得无色油状物,蒸馏收集多余的苄胺,得到白色固体3 (3.52 g,收率:85%)。将乙醇钠(1.22 g,18 mmol)溶于10 mL干燥乙醚中,氮气保护下加入草酸二乙酯(2.63 g,18 mmol),然后将3溶于10 mL干燥乙醚中,搅拌下逐滴加入反应体系中。反应回流5 h后利用旋转蒸发仪蒸除溶剂得到淡黄色固体,用温水(100 mL)溶解后用20%稀盐酸酸化至弱酸性(pH = 5-6)。静置过滤后用冰水洗涤沉淀,干燥后得到1-苄基-4-乙酯基-2,3-吡咯烷酮5 (3.99 g,收率:90%)。
向1-苄基-4-乙酯基-2,3-吡咯烷酮5 (3.13 g,12 mmol)中加入80 mL 20%稀盐酸,加热回流至无二氧化碳放出,所有固体溶解。冷却后加入苯甲醛(2.55 g,24 mmol),向反应体系中通入干燥氯化氢气体,持续30 min,至反应溶液逐渐出现固体,静置30 min。用石油醚溶解稀释固体后用95%乙醇重结晶2次,过滤即得产物1-苄基-4-亚苄基-2,3-吡咯烷酮7 (2.53 g,收率:76%)。
3.2 2-乙烯基环丙烷-1,1-二甲酸二乙酯10的合成(图3) [6]
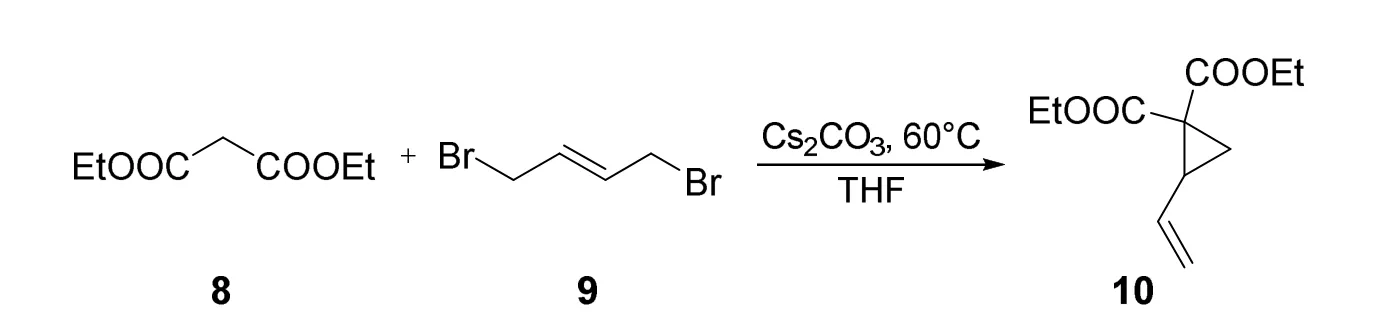
图3 2-乙烯基环丙烷-1,1-二甲酸二乙酯的合成
将(E)-1,4-二溴丁-2-烯9 (3.0 g,14 mmol)溶于70 mL四氢呋喃中,然后依次加入丙二酸二乙酯8(2.14 mL,14 mmol)和碳酸铯(11.4 g,35.1 mmol),将反应体系置于60 °C下反应16 h,反应结束后,向反应体系中加入50 mL饱和氯化铵水溶液,再用乙酸乙酯(50 mL × 2)萃取水相,将有机相合并后用无水硫酸钠干燥,抽滤、浓缩后经柱层析纯化(V石油醚:V乙酸乙酯= 9 : 1),得到产物10 (2.53 g,收率:76%)。
3.3 1-苄基-4-亚苄基-2,3-吡咯烷酮与乙烯基环丙烷的[3+2]环加成反应(图4)
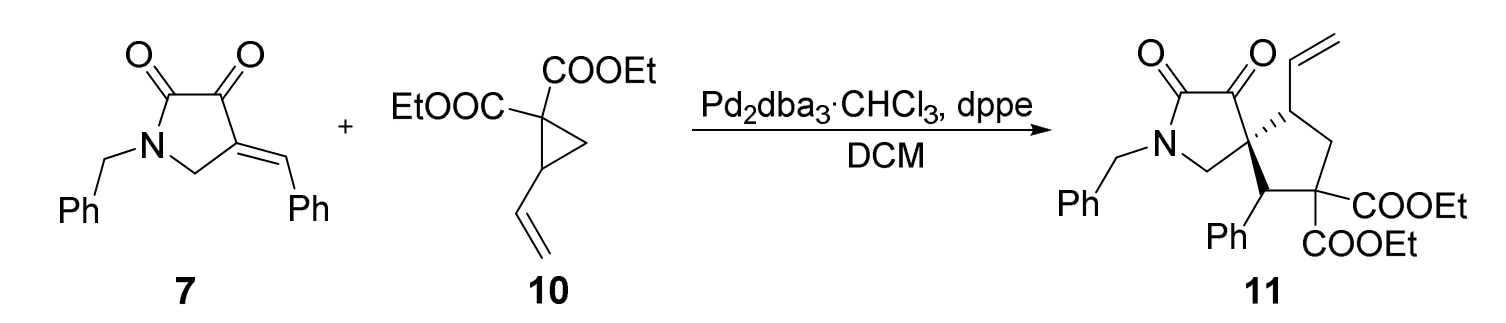
图4 1-苄基-4-亚苄基-2,3-吡咯烷酮与乙烯基环丙烷的[3+2]环加成反应
将1-苄基-4-亚苄基-2,3-吡咯烷酮7 (1.11 g,4 mmol)加入50 mL史莱克管中,加入1,2-双(二苯基膦)乙烷dppe (0.160 g,10%,摩尔分数)和Pd2dba3·CHCl3(0.409 g,10%,摩尔分数),通入氮气保护。向史莱克管中加入2-乙烯基环丙烷-1,1-二甲酸二乙酯10 (1.02 g,4.8 mmol)和15 mL二氯甲烷(DCM),室温搅拌并利用薄层色谱(TLC)监测反应进程。反应完成后加入10 mL饱和氯化铵溶液淬灭反应,利用二氯甲烷(20 mL × 3)萃取,合并有机相并用无水硫酸镁干燥,抽滤、浓缩后经柱层析分离(V石油醚:V乙酸乙酯= 7 : 1),得产物11 (1.67 g,收率:85%)。
4 结果与讨论
4.1 1-苄基-4-亚苄基-2,3-吡咯烷酮7的结构表征
通过1H NMR和13C NMR表征了化合物7的分子结构。1H NMR中δ4.54为氮α位(烯丙位)的两个氢,δ4.73为氮α位(苄位)的两个氢,δ7.55-7.59为亚苄基双键上的氢,其余低场共10个氢为苯环上的氢。13C NMR中δ47.1的信号峰为氮α位(烯丙位)sp3碳的化学位移,δ47.5为氮α位(苄位)sp3碳的化学位移,δ187.3为与亚苄基双键共轭羰基的碳对应的化学位移,δ160.6为酰胺结构羰基碳的化学位移,δ136.2和136.0为亚苄基双键碳对应的化学位移,剩余信号均为芳香碳所对应的化学位移。黄色固体;熔点:180-182 °C;1H NMR (400 MHz, DMSO-d6):δ7.60-7.64 (m, 2H), 7.55-7.59 (m, 1H), 7.47-7.53(m, 3H), 7.32-7.40 (m, 5H), 4.73 (s, 2H), 4.54 (s, 2H);13C NMR (100 MHz, DMSO-d6):δ187.3, 160.6,136.2, 136.0, 133.8, 131.8, 131.6, 129.7, 129.2, 128.7, 128.5, 128.1, 127.9, 126.6, 47.5, 47.1;HRMS (ESI)m/zcalcd. for278.1176,found 278.1179。
4.2 2-乙烯基环丙烷-1,1-二甲酸二乙酯10的结构表征
通过1H NMR和13C NMR表征了化合物10的分子结构。1H NMR中δ1.28-1.21为两个甲基的氢,δ1.51和1.66是环丙烷中CH2的氢,δ2.55为环丙烷上烯丙位的氢,δ4.29-4.08的四个氢对应两个乙基上CH2的氢,剩余δ5.43-5.06对应乙烯基上的三个双键氢。13C NMR中δ14.0和14.1对应两个甲基碳,δ20.2、30.9和35.8对应环丙烷的三个碳,δ61.3和61.5对应两个乙基上氧α位的碳,δ118.3和133.1对应乙烯基的双键碳,δ167.3和169.5对应两个羰基碳。无色液体;1H NMR (400 MHz, CDCl3)δ5.43-5.23(m, 1 H), 5.26 (dd,J= 9.45 Hz, 1.95 Hz, 1H), 5.06 (dd,J= 5.85 Hz, 2.1 Hz, 1H), 4.29-4.08 (m, 4H), 2.55(q,J= 8.7 Hz, 1H), 1.66 (dd,J= 6.3 Hz, 5.1 Hz, 1H), 1.51 (dd,J= 6.9 Hz, 4.8 Hz, 1H), 1.28-1.21 (m,6H);13C NMR (100 MHz, CDCl3)δ169.5, 167.3, 133.1, 118.3, 61.5, 61.3, 35.8, 30.9, 20.2, 14.1, 14.0;HRMS (ESI)m/zcalcd. for,found 213.1124。
4.3 2-苄基-3,4-二羰基-6-苯基-9-乙烯基-2-氮杂螺[4.4]壬烷-7,7-二羧酸乙酯11的结构表征
通过1H NMR和13C NMR以及高分辨质谱对产物11进行了表征。1H NMR中δ0.81和1.15的两个三重信号峰分别为两个乙酯上的甲基氢,δ3.75-3.61和4.24-4.06的两个多重峰对应乙酯上的两个亚甲基氢,δ4.93和5.02的两个双重峰对应烯基端位亚甲基,而δ5.34的三个双重峰则是烯基非端位的氢。δ4.37和4.55对应苄位亚甲基氢,δ4.63单峰对应苄位的氢,δ3.96对应烯丙位碳上的氢。13C NMR中δ171.4和171.5对应乙酯上的羰基碳,δ158.9对应酰胺结构上的羰基碳,δ201.9对应酰胺结构α位的羰基碳。高分辨质谱测试结果与产物11相匹配。白色固体,熔点:225-227 °C。1H NMR (400 MHz,CDCl3)δ7.24 (dd,J= 5.0, 1.9 Hz, 3H), 7.15-7.02 (m, 5H), 6.90 (d,J= 7.4 Hz, 2H), 5.34 (ddd,J= 17.1,10.4, 6.6 Hz, 1H), 5.02 (d,J= 17.1 Hz, 1H), 4.93 (d,J= 10.4 Hz, 1H), 4.63 (s, 1H), 4.55 (d,J= 14.3 Hz,1H), 4.37 (d,J= 14.3 Hz, 1H), 4.24-4.06 (m, 2H), 3.96 (m, 1H), 3.75-3.61 (m, 2H), 3.39 (d,J= 12.1 Hz,1H), 2.88 (dt,J= 13.2, 6.6 Hz, 1H), 2.63 (t,J= 13.6 Hz, 1H), 2.42 (dd,J= 14.0, 6.6 Hz, 1H), 1.15 (t,J=7.1 Hz, 3H), 0.81 (t,J= 7.2 Hz, 3H);13C NMR (101 MHz, CDCl3)δ201.9, 171.5, 171.4, 158.9, 134.5,134.4, 132.3, 129.3, 128.9, 128.7, 128.5, 128.3, 127.8, 119.9, 62.4, 62.1, 61.9, 57.9, 57.4, 52.2, 48.4, 44.2,38.7, 13.9, 13.4;HRMS (ESI)m/zcalcd. for,found 490.2227。
白酒作为中国传统产业的重要组成部分,在中国扩大对外开放的进程中,一定会大有作为。茅台的国际市场,也必将迎来一个新的发展机遇期。
4.4 反应机理讨论
合成化合物7的反应机理如图5所示[7]:首先苄胺在甲醇溶剂中于室温下即可与丙烯酸甲酯发生Michael加成反应生成中间产物3。随后在乙醇钠作用下,中间产物3酯基α-H离去,碳负离子与氮原子上的孤对电子分别进攻草酸二乙酯的酯羰基,发生环化反应生成1-苄基-4-乙酯基-2,3-吡咯烷酮5。化合物5在酸性条件下水解生成化合物14,然后加热发生脱羧反应生成化合物6。化合物6在酸性条件下羰基结合氢质子生成化合物15,其共振结构16与苯甲醛发生加成反应生成化合物17,随后脱除一分子水生成1-苄基-4-亚苄基-2,3-吡咯烷酮7。
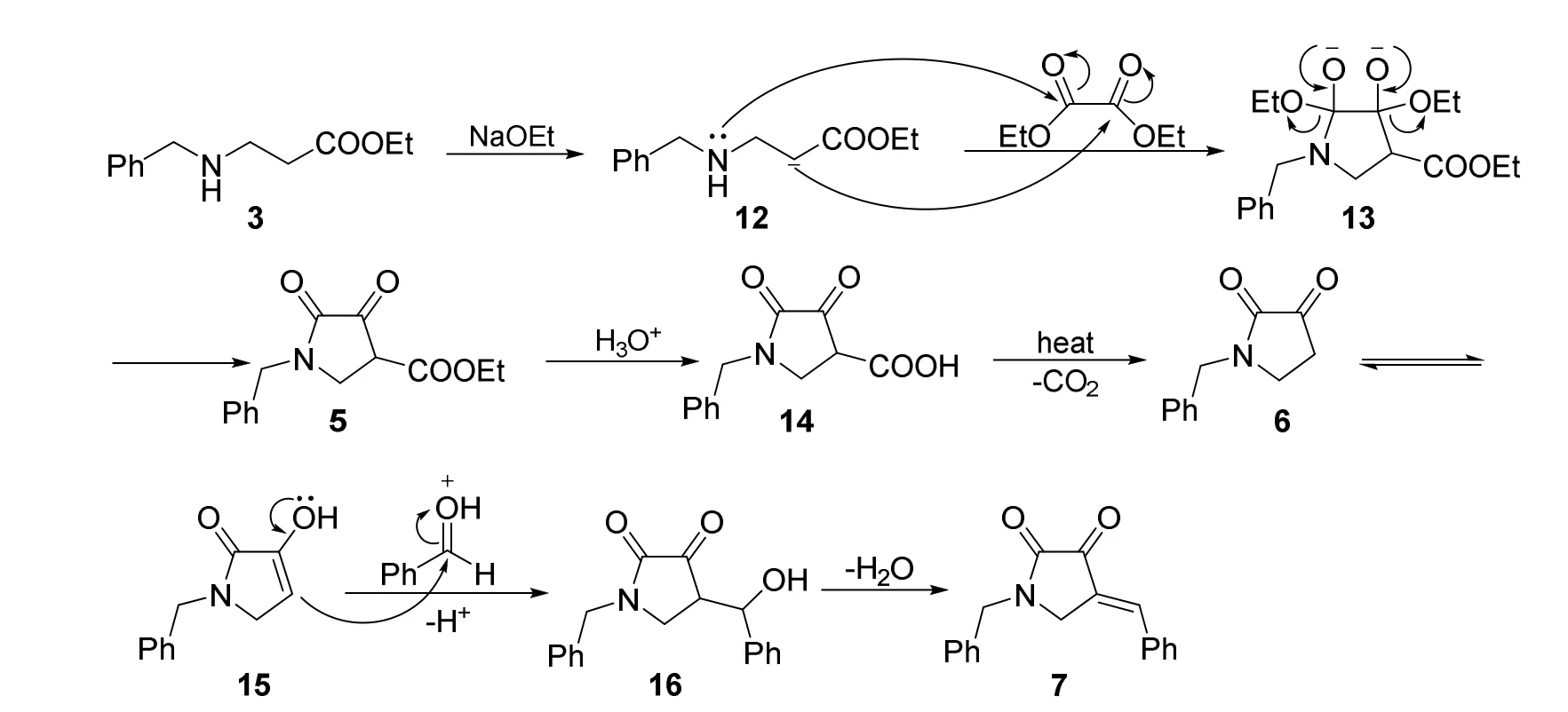
图5 合成化合物7的反应机理
通过查阅文献[8],推断1-苄基-4-亚苄基-2,3-吡咯烷酮与乙烯基环丙烷发生的[3+2]环加成反应中,零价钯首先与配体dppe结合形成配体-钯催化剂(Pd(0)/Ln),然后与2-乙烯基环丙烷-1,1-二甲酸二乙酯10发生氧化加成反应生成中间体Int-I,中间体Int-I与1-苄基-4-亚苄基-2,3-吡咯烷酮7反应生成中间体Int-II,进一步发生[3+2]环加成反应并脱除配体-钯催化剂(Pd(0)/Ln)得到产物11 (图6)。
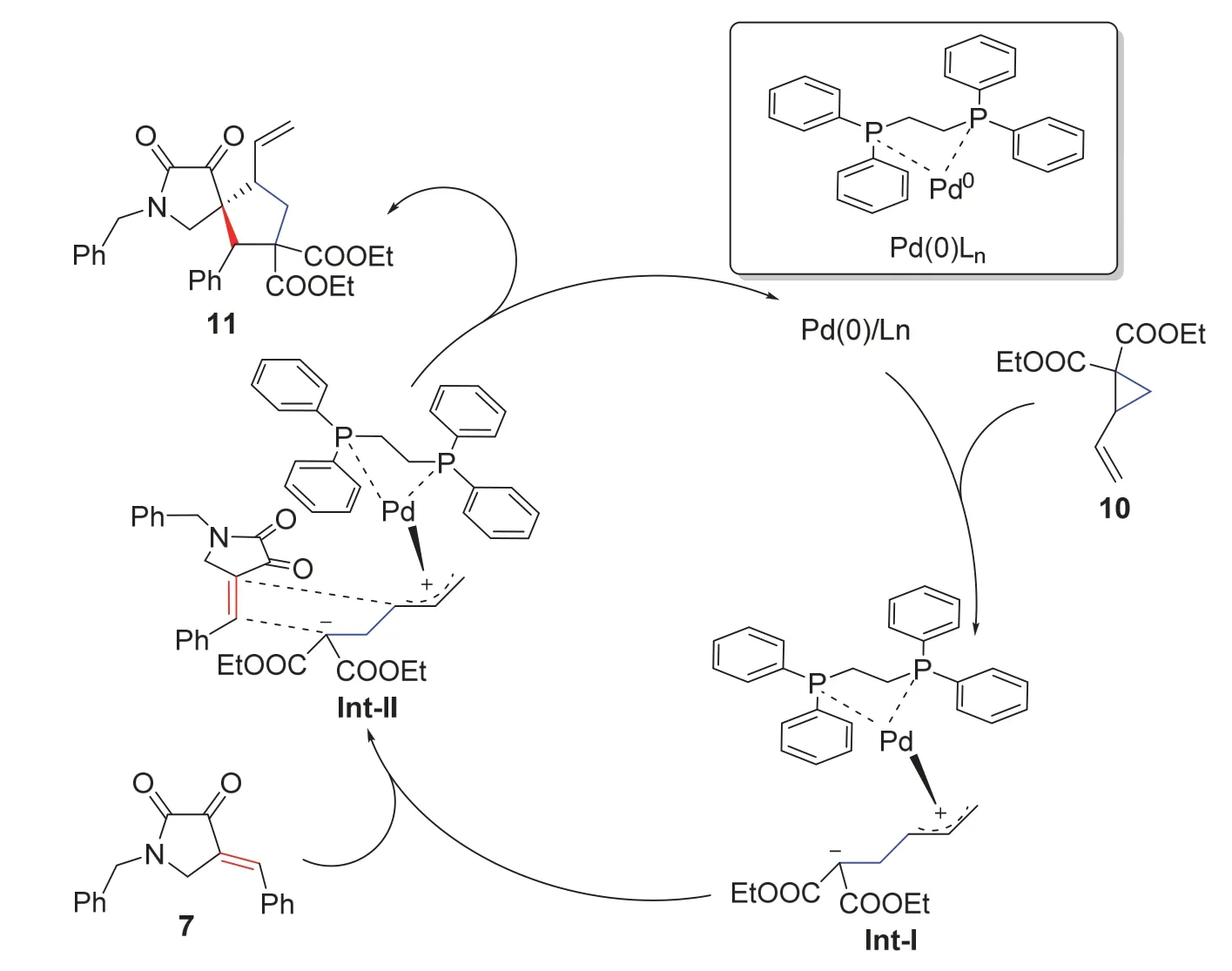
图6 合成化合物11的反应机理
5 有机化学综合实验的实施步骤和实施效果
南开大学化学学院从2009年起实施“基础学科拔尖学生培养试验计划”,鼓励学生积极参加国家大学生创新创业训练计划,同时利用“夏季小学期”针对高年级本科生开展科研训练,集中安排课时长、操作步骤多、创新性强的有机化学综合实验。参加有机化学综合实验的学生每学期30名,教学安排一般以2-3人为一组进行实验,因为该实验合成路线较长,因此采用“汇聚合成”策略进行实验,即安排两名学生分别合成化合物7和10,然后以化合物7和10为原料共同完成目标化合物11的合成。由于其中有的实验步骤反应时间较长,所以实验采用“间歇式”操作,例如苄胺1与丙烯酸乙酯2的反应需要室温下搅拌24 h,可以在每天早晨实验开始时即开启电磁搅拌,然后学生可以安排进行其他实验内容,到晚上当天实验结束后关闭搅拌,第二天早晨继续反应直到达到反应时间。该反应的特点是反应的化学选择性好,副产物很少,因此采用“间歇式”操作对反应没有大的不良影响。
该综合实验在提升学生“三基”方面效果显著,在提高学生的基本知识和基本理论方面,指导教师引导学生分析每一步化学反应的反应类型,然后带领学生根据有机化学理论课程学习中的知识要点,开展反应机理的讨论,进一步提出采取什么操作步骤能够有效提高反应收率。通过这种学习模式,能够切实加强学生的基本知识,提高基本理论水平,将有机化学基本理论与实践紧密联系,引导学生学习“活的化学”,让学生在实验过程中切实体验有机化学“从理论到实践再到理论”的循环提高过程,有效提高了有机化学理论课程的学习效果。
在加强基本技能训练方面,该综合实验更是独具特色,因为是多步有机化学合成实验,要求学生必须做到每一步所合成的化合物结构正确而且产率达标,这样才能够保证后续实验顺利进行。同时在实验中学习使用史莱克管作为反应容器,利用基础有机化学实验中很少使用的“双排管”进行无水无氧的规范操作,锻炼学生的实验操作动手能力。获得所合成的目标化合物以后,在负责大型仪器老师的指导下,利用核磁共振仪和高分辨质谱仪进行结构表征,用实验数据结果支持所合成化合物的结构正确,这样既加强了学生基本技能的训练,又有效避免了在普通有机化学实验中存在的“瞎子摸象”和“指鹿为马”现象,真正让学生体会到科学实验必须建立在坚实的实验数据基础上,科学研究必须坚持实事求是的科学精神。
有机化学综合实验经过近五年的实践取得了良好的教学效果,参加课程学习的同学普遍反映课程内容新颖,贴近科研实际,能够全面锻炼实验能力。2018级本科生毛沅浩通过参加有机化学综合实验课程的学习,明显提高了对有机化学的学习兴趣,同时带动其他课程成绩的提高,最终成功保送中国科学院上海有机化学研究所攻读博士学位。2019级本科生刘家汇在课后感言中表示,“有机化学综合实验课程内容丰富,涉及的知识面广,将有机化学基础理论知识与科研实践紧密结合,使我在实验中真正体会到科学研究的规范、严谨、细致,这是我在大学期间修读的收获最大的一门实验课程。”据统计,2017-2021年优秀本科毕业论文获奖者中87%的学生修读了有机化学综合实验课程而且考试成绩优秀。通过开展有机化学综合实验,有效提高了学生的科研能力,为后续进行本科毕业论文设计和今后从事科学研究工作奠定了良好的基础。
6 实验教学实施建议
本实验涉及多步反应和化合物结构表征,实验内容较多,适于化学专业高年级本科生开设。建议指导教师和助教注意以下几点:
(2) 督促学生充分做好实验预习,查阅相关文献,熟悉每一步反应原理和操作步骤。在实验开始前强调有机化学实验室安全规则和实验室废液处理要求;
(3) 指导教师在实验课讲授阶段对反应机理进行分析讲解,为实验的顺利进行做好理论准备;为了培养学生的创新能力和独立思考能力,指导教师可以要求学生在实验预习报告中通过搜索SCI Finder数据库,写出文献已经报道的目标化合物的合成方法,在此基础上可以实验小组为单位,鼓励学生提出新的合成路线,供课堂讨论;
(4) 实验完成后在教师指导下,由学生独立完成核磁共振谱图、高分辨质谱分析和化合物结构推测;
(5) 指导学生做好实验记录并进行实验数据分析,介绍相关绘图软件(Chemdraw)的使用方法,实验报告强调对实验结果的分析与讨论,帮助学生养成科学严谨的科研习惯,提高学生的科研思维能力;
(6) 实验中需要使用干燥氯化氢气体,可以利用氯化钠与浓硫酸为原料进行制备,向反应体系中通入干燥氯化氢气体时需要注意安装尾气接收装置,防止大量氯化氢气体泄漏在实验室中。
7 结语
本文所推荐的有机化学综合实验是南开大学化学学院将国家大学生创新创业训练计划的研究成果转化成教学实验的典型案例,该实验内容丰富,涵盖了多步化学合成、产物分离纯化、结构表征等多个重要环节,具有安全性高、重现性好、内容综合、便于推广等特点。实验过程中学生独立使用各类有机合成实验仪器进行化合物的合成和纯化,利用各类大型分析仪器对化合物进行结构分析表征,在教师指导下独立分析实验数据,使学生完整掌握科研工作的全过程,巩固有机化学理论学习成果,做到理论与实践相结合。通过开展有机化学综合实验,使学生了解有机合成的基本规律,激发科研兴趣,锻炼学生的科研能力,为进行本科毕业论文设计和今后从事科学研究工作奠定了坚实的基础。
致谢:谨以此文庆祝南开大学元素有机化学研究所建所60周年。
