超声处理对牡蛎肌浆蛋白结构和溶解性的影响
2023-12-08左硕静李逍燕刘晓涵张晴怀向前桑亚新
左硕静,李逍燕,刘晓涵,张晴,怀向前,桑亚新
(河北农业大学食品科技学院,河北 保定 071000)
牡蛎(Crassostreagigas)是一类营养价值很高的海水产品,富含人体所必需的蛋白质、维生素、矿物质和微量元素等,可以抗肿瘤、抗氧化、抗疲劳以及降血压,具有很高的药用和营养价值[1]。肌浆蛋白(sarcoplasmic protein,SP)是牡蛎所含的重要蛋白,位于肌肉细胞中,主要存在于肌纤维鞘和肌原纤维蛋白之间,占肌肉蛋白质量的30%~35%,因其易溶于水,也被称为水溶性蛋白[2]。肌浆蛋白虽然易于制备提取,但是产量较低,且对加工条件较为苛刻,环境因素、生产过程中的处理方法等都会导致肌浆蛋白功能特性的降低,最终造成肌浆蛋白的流失,进而影响产品风味和功能[3],通过现有的研究发现,蛋白质改性不仅能改变蛋白质的结构,还能改善蛋白质的功能特性,使蛋白资源得到更广泛的应用。
超声波是一种绿色的食品物理加工技术,它通过空化效应产生机械剪切和湍流效应,并通过形成局部瞬时高压来影响蛋白质分子的空间结构和功能特性[4],已广泛应用到蛋清蛋白[5]、大豆蛋白[6]、豌豆蛋白[7]等食品的加工研究当中。Chen 等[8]发现超声处理可通过空化作用诱导肌球蛋白产生“应激反应”和群体效应,使蛋白形成更稳定的结构以抵抗空化力的负面影响。Thalía 等[9]研究发现,高压超声处理可以有效改变牛蹄豆分离蛋白的体外消化率和溶解度。超声技术可以有效改善蛋白质理化性质,但在贝类蛋白加工中应用相对较少。本文主要探究在200 W 超声功率下,不同超声处理时间对牡蛎肌浆蛋白结构的影响和蛋白聚集行为的变化,进一步了解超声处理对蛋白溶解性的影响,以期为牡蛎蛋白的研究及贝类加工提供依据及参考。
1 材料与方法
1.1 材料与试剂
新鲜牡蛎:市售;甲醇、乙酸、尿素、氯化钠、磷酸氢二钠、磷酸二氢钠、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、5,5'-二硫双-(2-硝基苯甲酸)[5,5'-dithiobis(2-nitrrobenzoic acid),DTNB]、8-苯胺-1-萘磺酸盐(8-anilino-1-naphthalenesulfonic acid,ANS),牛血清白蛋白(bovine serum albumin,BSA):美国Sigma 公司;考马斯亮蓝G250、蛋白Marker(10~250 kDa)、5 倍上样缓冲液:赛文创新(北京)科技有限公司。以上化学试剂均为分析纯。
1.2 仪器与设备
TGL-16M 高速台式冷冻离心机:湖南湘仪实验室仪器开发有限公司;JP96L 均质机:中国苏泊尔公司;JY92-IIDN 超声粉碎机:宁波新芝生物科技股份有限公司;Tanon 4600 凝胶成像仪:上海天能科技有限公司;F-320 荧光分光光度计:天津港东仪器有限公司;N5000 紫外可见分光光度计:上海佑科仪器有限公司。
1.3 方法
1.3.1 原料预处理
新鲜牡蛎用冰块运送到实验室,清洗牡蛎外壳,去壳取肉,用蒸馏水冲洗两次,将牡蛎肉切成小块,4 ℃储藏并尽快使用。
1.3.2 肌浆蛋白的提取
参考Liu 等[10]的方法提取肌浆蛋白并稍作修改。将牡蛎肉与20 mmol/L 磷酸盐缓冲液(含100 mmol/L氯化钠,1 mmol/L EDTA,pH7)以体积比1∶4 混合并在冰水浴中均质90 s,在4 ℃下6 790×g条件下离心20 min,收集上清液,即得肌浆蛋白。以牛血清白蛋白为标准溶液,采用双缩脲法测定SP 的浓度。
1.3.3 超声处理肌浆蛋白
调整SP 浓度为5 mg/mL,在200 W 的超声功率下分别处理0、10、20、30、40、50 min,处理后的样品在4 ℃保存并在48 h 内使用。
1.3.4 肌浆蛋白一级结构测定
参考Laemmli[11]的方法进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)并稍作修改,将稀释后的SP 溶液(2 mg/mL)与5 μL 的SDS-PAGE 缓冲液混合,在沸水中煮沸10 min,使用10%分离胶和5%浓缩胶,上样量为20 μL,使用100 V 的恒定电流直到指示剂高于凝胶边缘约5 mm 停止电泳。电泳结束后,考马斯亮蓝G250 染色10 min,随后用5%甲醇溶液和7.5%乙酸溶液脱色。脱色后,在凝胶成像仪上成像。
1.3.5 肌浆蛋白内源性荧光的测定
参考Jia 等[12]的方法并稍作修改。用磷酸盐缓冲液稀释SP 溶液至浓度0.5 mg/mL,设置激发波长为295 nm,发射光谱为300~420 nm,设定激发波长与发射波长之间的狭缝宽度为10.0 nm,用荧光分光光度计测定内源性荧光。
1.3.6 肌浆蛋白表面疏水性的测定
参考Jiang 等[13]的方法,用磷酸盐缓冲液将SP 溶液稀释至浓度0、0.2、0.4、0.6、0.8、1.0 mg/mL,分别取5 mL各浓度的SP 溶液与25 mL 的ANS 溶液(含8 mmol/L ANS,20 mmol/L 磷酸盐缓冲液,pH7.5)混合,25 ℃黑暗处反应25 min,用荧光分光光度计记录激发波长为374 nm 和发射波长为485 nm 处的荧光强度。以荧光强度对蛋白质浓度作曲线,曲线的初始斜率为SP 的表面疏水性。
1.3.7 肌浆蛋白巯基与二硫键含量的测定
总巯基含量:参考Zhang 等[14]的方法测定,并稍作修改。将0.5 mL 的SP 溶液(1 mg/mL)溶解于4.5 mL 含8 mol/L 尿素和10 mmol/L EDTA(pH6)的溶液,并加入100 μL 的Ellman 溶液(含10 mmol/L DTNB,0.1 mol 磷酸二氢钠),混合均匀后,25 ℃黑暗处静置反应25 min,用紫外可见分光光度计在412 nm 处测定吸光度,以不含DTNB 的SP 溶液为空白对照。总巯基含量(X,μmol/g)计算公式如下。
式中:A412为412 nm 处样品吸光度;A412r为412 nm处空白试剂吸光度;k 为消光系数13 600 mol/(L·cm);c为样品中蛋白浓度,mg/mL。
游离巯基含量:参考Guo 等[15]的方法测定,将5 mL的SP 溶液(1 mg/mL)与20 μL DTNB 溶液混合,25 ℃反应25 min,紫外可见分光光度计在412 nm 处测定吸光度,以不含DTNB 的SP 溶液为空白对照。游离巯基含量(Y,μmol/g)计算公式如下。
式中:A412为412 nm 处样品吸光度;A412r为412 nm处空白试剂吸光度;k 为消光系数13 600 mol/(L·cm);c为样品中蛋白浓度,mg/mL。
二硫键含量(Z,μmol/g)计算公式如下。
式中:X为总巯基含量,μmol/g;Y为游离巯基含量,μmol/g。
1.3.8 肌浆蛋白浊度的测定
参考Liu 等[16]的方法测定浊度。稀释SP 溶液至1 mg/mL,在室温下反应30 min,用紫外可见分光光度计在340 nm 下测定其吸光度,同时做试剂空白。
1.3.9 肌浆蛋白溶解性的测定
参考Liu 等[17]的方法测定溶解性,并稍作修改。稀释SP 溶液浓度至5 mg/mL,在4 ℃下以6 790×g条件下离心20 min,用双缩脲法测定离心前后上清液中的蛋白含量,用上清液蛋白浓度与未作处理的蛋白浓度之比来计算蛋白溶解性(W,%),公式如下。
式中:M1为上清液中蛋白含量,mg;M2为溶液中总蛋白含量,mg。
1.4 数据分析
所有试验均至少重复进行3 次。所有数据均以平均值±标准差表示。采用SPSS 22.0 软件进行单因素方差分析。
2 结果与分析
2.1 不同超声处理时间对肌浆蛋白一级结构的影响
应用SDS-PAGE 观察超声处理时间对SP 的影响,探究不同超声处理时间对SP 一级结构的影响。不同超声处理时间下牡蛎肌浆蛋白SDS-PAGE 图谱如图1所示。

图1 不同超声处理时间下肌浆蛋白SDS-PAGE 图谱Fig.1 SDS-PAGE of sarcoplasmic proteins at different time points of ultrasonic treatment
由图1 可知,所有样品均表现出明显的SP 蛋白特征条带,包括C 蛋白(150 kDa)、辅肌动蛋白(110 kDa)、肌酸激酶(44 kDa)、T 肌钙蛋白(38 kDa)[18-19]。与对照组相比,可以观察到超声处理时间并没有改变蛋白分子质量的大小,这一现象表明,在200 W 下超声处理0~50 min,不会对SP 一级结构产生影响。
2.2 不同超声处理时间对肌浆蛋白内源性荧光强度的影响
内源性荧光光谱主要反映SP 的三级结构,内源性荧光是由于蛋白芳香族氨基酸残基的激发和释放,特别是色氨酸[20]。当色氨酸周围构象发生变化时,内源性荧光强度会随之发生波动,因此,SP 的三级结构的变化可由荧光强度的变化来确定。不同超声处理时间对牡蛎SP 荧光强度影响如图2所示。

图2 超声处理时间对肌浆蛋白荧光强度的影响Fig.2 Effect of ultrasonic treatment time on fluorescence intensity of sarcoplasmic proteins
由图2 可知,荧光强度随超声处理时间的延长呈现先降低后升高的趋势,在40 min 达到最低,说明超声处理使SP 部分或完全展开,包埋在内部的色氨酸、苯丙氨酸、酪氨酸暴露在极性环境中,极性溶剂会使发色基团发生荧光猝灭作用,使荧光强度降低。到50 min时,荧光强度又升高,可能是由于表面疏水性增加,暴露的疏水氨基酸残基之间的疏水相互作用而形成可溶性蛋白质聚集体[21],暴露的芳香族氨基酸重新迁移到蛋白分子内部。荧光强度的变化表明,超声波处理可以改变SP 的三级结构。
2.3 不同超声处理时间对肌浆蛋白表面疏水性的影响
表面疏水性是维持蛋白质高级结构的主要作用力,可以反映蛋白质疏水性基团的含量,是表征蛋白质构象和聚集行为的重要指标[22]。不同超声处理时间对牡蛎SP 表面疏水性影响如图3所示。
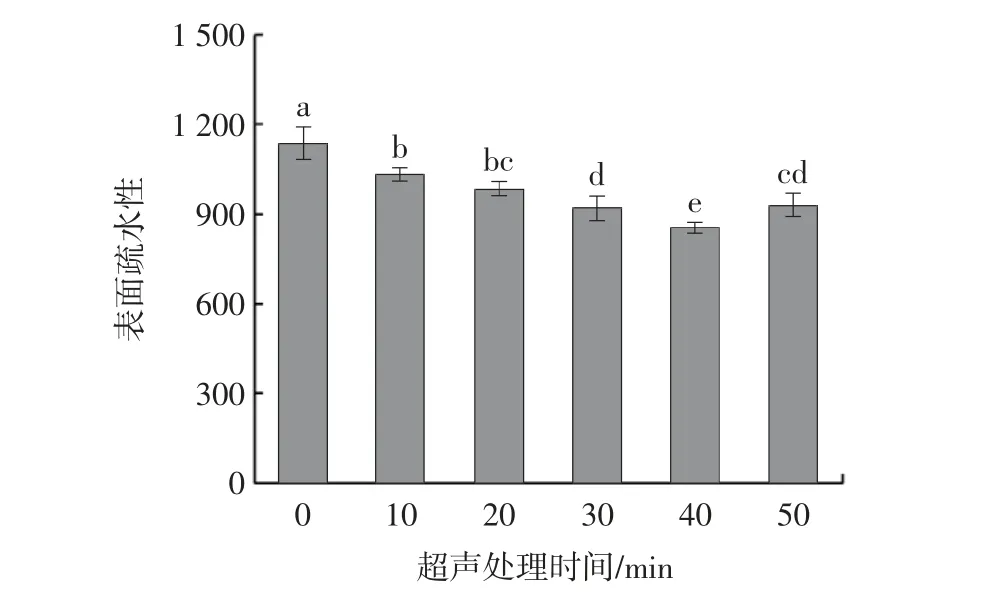
图3 超声处理时间对肌浆蛋白表面疏水性的影响Fig.3 Effect of ultrasonic treatment time on surface hydrophobicity of sarcoplasmic proteins
由图3 可知,表面疏水性随超声处理时间的延长,呈现先减小后增大的趋势,在40 min 处达到最小值(861.96),与对照组相比降低了24.30%,超声波处理过程中产生的空化效应可以破坏蛋白质分子疏水区周围水分子的“包合物”结构,非共价相互作用被破坏,蛋白质分子暴露于水-空气界面,表面疏水性下降。表面疏水性降低会增强蛋白质与水之间的相互作用,从而进一步影响聚集体的产生和溶解度的变化[23]。当超声处理时间为50 min 时,表面疏水性又显著增加(P<0.05),但低于对照组,可能是由于长时间的超声处理产生的空化和剪切作用促进了SP 大分子聚集体分解成小分子蛋白,从而暴露了部分内部的疏水基团,而且超声波使气泡破裂,其过程中释放的能量提供了疏水相互作用的能量[24],使表面疏水性增加。
2.4 不同超声处理时间对肌浆蛋白总巯基和游离巯基含量的影响
巯基是SP 的关键官能团,主要反映蛋白高级结构的变化[25]。总巯基是指暴露在蛋白表面和包埋在蛋白内部区域的巯基总和,而游离巯基是指暴露于蛋白表面的巯基[26]。不同超声处理时间对牡蛎SP 总巯基与游离巯基含量的影响如图4 和图5所示。
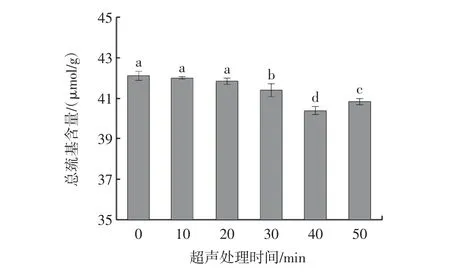
图4 超声处理时间对肌浆蛋白总巯基含量的影响Fig.4 Effect of ultrasonic treatment time on total sulfhydryl content of sarcoplasmic proteins
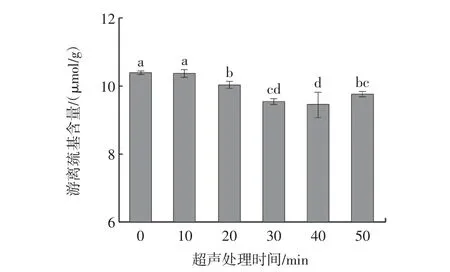
图5 超声处理时间对肌浆蛋白游离巯基含量的影响Fig.5 Effect of ultrasonic treatment time on free sulfhydryl content of sarcoplasmic proteins
由图4 可知,总巯基含量随超声处理时间的延长,呈现先下降后上升的趋势,在0~20 min 无显著变化,在30 min 时显著下降,并在40 min 时达最低,为40.42 μmol/g。由于超声波处理破坏了蛋白分子间的非共价相互作用,蛋白质分子展开,内部巯基基团暴露[27],使游离巯基含量增加。同时游离巯基基团易被过氧化氢大量氧化,游离巯基氧化速率高于其暴露速率,最终导致总巯基含量降低。另外,超声处理过程中产生的高剪切力易打断分子之间的化学键,蛋白发生聚集变性,覆盖一些巯基,使可检测到的游离巯基含量减少,总巯基含量下降。当超声处理时间达50 min 时,总巯基含量明显增加,但低于对照组。主要由于游离巯基氧化速率低于其暴露速率,导致总巯基含量上升。
由图5 可知,游离巯基含量随超声处理时间的延长呈现先下降后上升的趋势,在20 min 处开始显著下降(P<0.05),并在40 min 处达最小值,为9.46 μmol/g,由于超声波处理使水分子中产生瞬态自由基,交叉反应形成过氧化氢,过氧化氢将暴露的游离巯基不可逆地氧化为更稳定的亚磺酸或磺酸,使游离巯基含量下降,同时干扰了分子间巯基-二硫键的交换[28]。当超声处理时间为50 min 时,游离巯基含量上升但低于对照组,可能由于长时间的超声处理造成蛋白结构进一步展开,内部巯基暴露,使游离巯基增加。
2.5 不同超声处理时间对肌浆蛋白二硫键含量的影响
二硫键对维持蛋白质空间结构稳定具有重要作用[29],同时也与蛋白的聚集和解离有关。不同超声处理时间对牡蛎SP 二硫键含量的影响如图6所示。
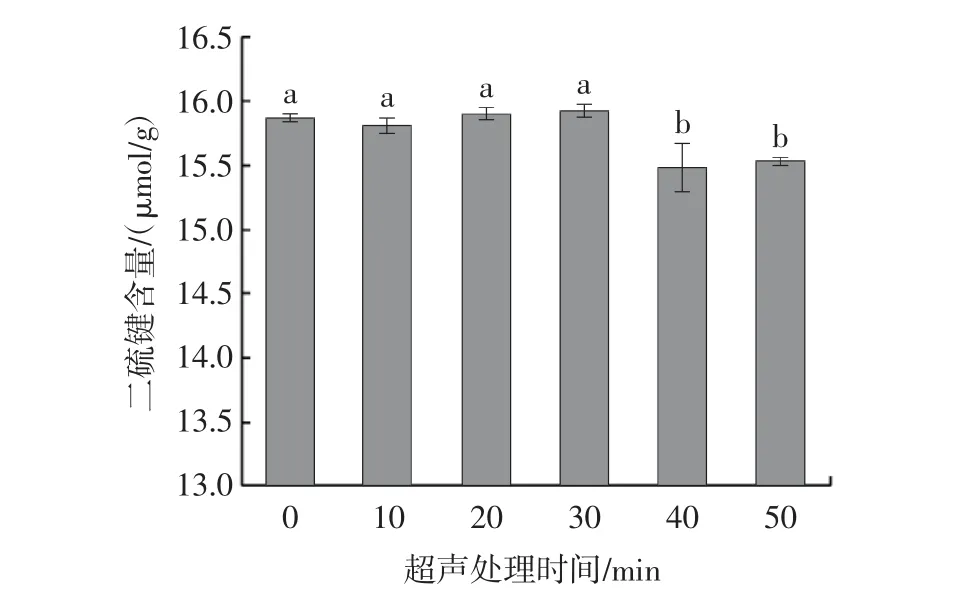
图6 超声处理时间对肌浆蛋白二硫键含量的影响Fig.6 Effect of ultrasonic treatment time on disulfide bond content of sarcoplasmic proteins
由图6 可知,在0~30 min 内随着超声处理时间的延长,二硫键含量无显著变化;超声处理40~50 min 时二硫键含量较前30 min 显著降低(P<0.05)。二硫键含量下降可能是由于在超声过程中超声波的空化现象产生的湍流、高剪切力使肌浆蛋白部分展开[30],二硫键断裂氧化形成巯基。由于超声处理破坏了维持蛋白质三级结构的二硫键,使得蛋白质的稳定性降低。
2.6 不同超声处理时间对肌浆蛋白浊度的影响
浊度可以反映蛋白的聚集程度、溶解性[31],与粒径大小密切相关。不同超声处理时间对牡蛎SP 浊度影响如图7所示。
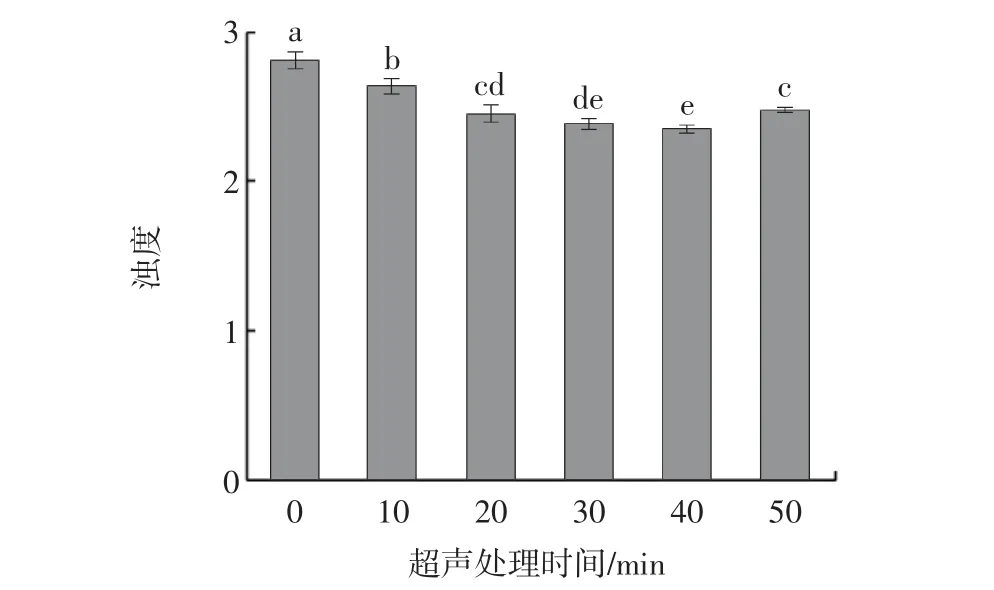
图7 超声处理时间对肌浆蛋白浊度的影响Fig.7 Effect of ultrasound treatment time on turbidity of sarcoplasmic proteins
由图7 可知,随超声处理时间的延长,浊度呈现先下降后上升的趋势,在40 min 处达到最小值(2.353),与对照组相比降低了19.26%,可能是超声处理过程中由于空化现象产生的高剪切力造成分子键的破坏,导致蛋白聚集体破裂并向小分子蛋白转化,使蛋白质颗粒变小,浊度降低,使颗粒的均匀性增加[32]。浊度在50 min处显著上升(P<0.05),可能是因为长时间的超声处理,蛋白之间由于非共价相互作用发生一定程度的蛋白聚集,使浊度升高。
2.7 超声处理时间对牡蛎SP 溶解性的影响
溶解性可以反映蛋白的变性和聚集程度,影响蛋白的功能特性[33]。不同超声处理时间对牡蛎SP 溶解性的影响如图8所示。
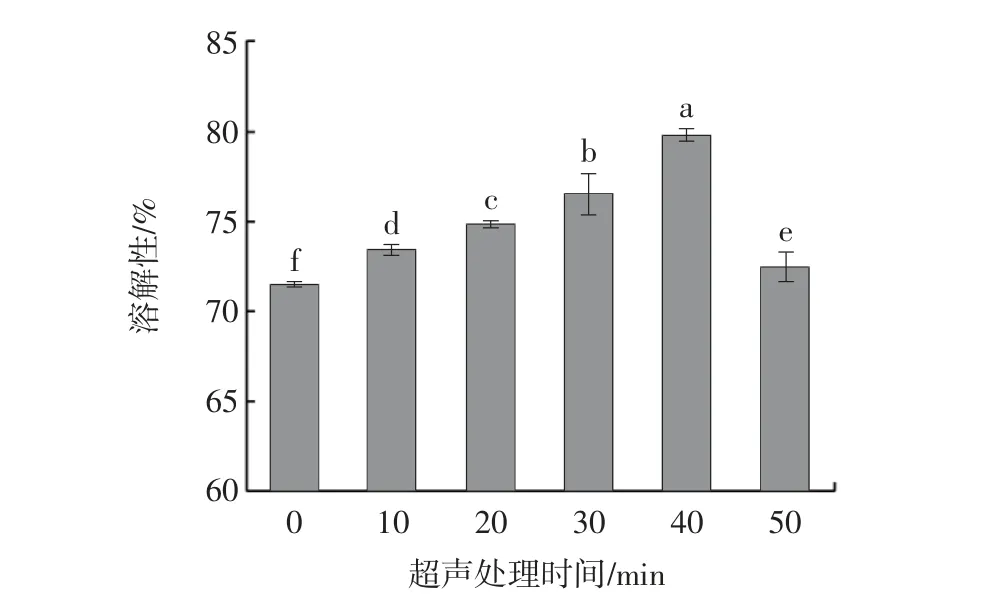
图8 超声处理时间对肌浆蛋白溶解性的影响Fig.8 Effect of ultrasonic treatment time on solubility of sarcoplasmic proteins
由图8 可知,0~40 min 内溶解性随超声处理时间的延长显著上升(P<0.05),并在40 min 处达到最大值(79.92%),比对照组升高了11.59%,当超声处理时间超过40 min 时,溶解性显著下降(P<0.05),但高于对照组。超声产生的空化效应与机械效应使SP 的蛋白聚集体被解离为小分子片段,小分子片段具有更大的表面积和含量更高的极性基团,从而增加了蛋白与水分子的相互作用。一定时间的超声处理也会使蛋白分子发生变性解聚,颗粒减小,浊度降低,导致蛋白质与水之间形成氢键的机会增加,且水和蛋白质之间的接触面积增加[34],使溶解性升高。另外,也有研究表明是由于疏水基团的含量降低,促进蛋白与水之间的亲水基团交联,促使溶解性增加[35]。但长时间的超声处理,SP 的浊度增加,溶解性下降。可能是超声波时间过长所产生的湍流力使蛋白分子之间的碰撞和聚集速度加快,使蛋白发生一定程度的聚集。此外,还可以推断,SP 的溶解性与浊度和表面疏水性均呈负相关。
3 结论
通过对肌浆蛋白结构和溶解性变化的分析,可以发现适当的超声处理可改变SP 结构并提高其溶解性。与对照组相比,一定时间的超声处理可以稳定内源性荧光,降低表面疏水性、总巯基、游离巯基和二硫键含量,使浊度降低,溶解性增加。结果表明,超声处理使蛋白质的三级结构发生改变,二硫键的断裂促进蛋白质结构的伸展,使肌浆蛋白具有更好的溶解性,且试验结果表明,溶解性与浊度和表面疏水性均成负相关。该论文为肌浆蛋白超声处理的研究提供参考,并且为贝类蛋白的加工利用提供理论支持。
