高中化学解题中守恒法的应用
2023-12-08吴凯明
吴凯明
(浙江省义乌中学,浙江 金华 322000)
化学作为一门重要的理科学科,在高考中占有重要的分值比例,通过化学知识学习,能够培养学生的逻辑分析能力与思考能力.化学学科在生活中广泛应用,对学生的学习与生活有着重要作用.在高中化学教学中,不仅要求学生掌握化学知识,同时能够有效利用化学知识.守恒定律是学生必须掌握的定理,守恒法是守恒定律在化学解题中的应用,加深学生对守恒定律的理解,可有效提高学生的解题效率.
1 利用原子守恒,解答化学题
原子守恒法主要是利用化学反应过程中,反应前与反应后其原子种类与个数不变,进行计算或推导的解题方法.在化学解题中,利用原子守恒法,通常不需要利用化学方程式,只需要确定化学反应开始和结束时的粒子关系,根据守恒关系进行计算,得出最终结果[1].
例1在一定的温度下,1 L的密封容器内,加入1 mol N2和3 mol H2,通过化学反应实现平衡,通过检测可以得知平衡混合物中N2的物质的量是M,H2的物质的量是N,NH3的物质的量是Q,在温度不变的情况,改变初始的物质的量,保证M、N、Q不变,N2、H2、NH3具体加入的量用x、y、z表示,需要满足的条件是:
(1)当x=0,y=0时,则z=____.
(2)当x=0.75 mol时,则y=____,z=____.x、y、z需要满足的条件是____.
解析在解答此题时,等效平衡是最为常用的解题方式,但是,利用原子守恒,可以更加简单地解决问题.在容器内增加的物质,需要包含2 mol的N原子和6 mol的H原子,(1)当x=0,y=0时,则z=2;(2)当x=0.75 mol,根据氮原子守恒可以得出z=2 mol-0.75 mol×2=0.5 mol;根据氢原子守恒可以得出y=(6 mol-3×0.5 mol)/2=2.25 mol;(3)根据氮原子守恒可以得出2x+z=2,根据氢原子守恒可以得出2y+3z=6.
2 利用质量守恒,解决化学题
质量守恒是指在化学反应前后,发生化学反应的物质总质量与化学反应后的物质总质量不变.根据质量守恒原理,对化学反应中的化学物质关系进行计算,通过这样的方式,可以有效、准确地解答各种类型的化学问题.
例2现有一块铝铁合金,为了测量出其中铝的含量,进行如下的实验:切下一小块合金,将其溶入盐酸中,之后,加入足量的氢氧化钠溶液,在溶液中沉淀全部变成红褐色之后,对沉淀物进行过滤,并且在空气中燃烧,最后得到的红棕色粉末的质量与原来的合金试样质量相等,那么合金中铝的质量分数是( ).
A.25% B. 30% C. 46% D. 70%
解析在解题中,需要明确从合金到红棕色粉末的过程中铁元素的转化,根据题意可以得出合金中铝的质量与氧化铁中氧的质量相等,最后利用质量守恒定律进行计算.在整个化学实验过程中,铁、铝两种元素转化如图1所示.
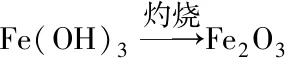
图1 转化关系示意图

根据上述过程分析,可以得出红棕色的粉末是氧化铁,根据题意得知,反应之前合金的质量与得到的氧化铁质量相等.因此,铁元素在每一步反应中都完全转化,所以铁元素的质量守恒,则合金中铝的质量与氧化铁中的氧元素质量相等,所以合金中铝的质量分数是:
因此,正确答案是B.
3 利用得失电子守恒,解答化学题
得失电子守恒通常在氧化还原反应中使用,是根据氧化还原反应中得失电子总数相等,以此进行推导和计算.在氧化还原反应的各种计算中,得失电子守恒广泛使用,还可以用于解决复杂氧化还原反应中的计算以及配平问题.得失电子只在氧化还原反应中发生,因此,只要在氧化还原反应中才可以使用得失电子守恒,根据题目已知,结合所学知识,对氧化剂、还原剂、氧化产物以及还原产物进行判断,根据氧化剂或者还原剂在化学反应前后的化合价变化,确定原子或者离子得失电子数量,根据氧化剂得到的电子数和还原剂失去电子数相等进行列式计算[2].
例3羟胺(H2NOH)是一种还原剂,能够将一些氧化剂还原.现在使用25 mL 0.049 mol/L的羟胺酸性溶液与足量的Fe2(SO4)3溶液在煮沸条件下进行反应,生成的Fe2+恰好可以与24.50 mL 0.02 mol/L的酸性KMnO4溶液发生作用:FeSO4+KMnO4+H2SO4→Fe2(SO4)3+K2SO4+MnSO4+H2O,在上述化学反应中,羟胺的氧化产物是( ).
A.N2B.N2O C.NO D.NO2
解析在此题解答过程中,需要明确氧化剂、还原剂、氧化产物和还原产物,找出氧化剂与还原剂得失电子的情况,根据得失电子守恒列出相应的等式,并且计算得出结果.Fe2(SO4)3被羟胺还原成FeSO4,FeSO4被酸性的KMnO4溶液氧化成Fe2(SO4)3,可以看作没有参与氧化还原反应,所以可以认为羟胺是还原剂,KMnO4是氧化剂.羟胺中的氮元素在化学反应之前是-1价,设化学反应之后氮元素是n价,所以25.00 mL×0.001 L×0.049 mol/L×(n+1)=24.50 mL×0.001 L×0.020 mol/L×(7-2),求解得出n=1,所以羟胺的氧化产物是N2O,正确答案是B.
4 利用电荷守恒,解答化学题
电荷守恒法是根据化学反应前后,离子所带的电荷总数没有变化的原理,进行计算或推导.一般来说,电荷守恒通常在溶液中离子浓度关系的推断中使用,也可以利用电荷守恒,对化学反应某些量进行计算.在电解质溶液的计算中,通常使用电荷守恒法,溶液中的电荷守恒属于隐藏条件,需要注意的是,每种阴离子、阳离子所带的电荷数是该粒子的物质的量与每个粒子所带电荷数量的乘积[3].在解题中,需要根据题意对化学反应过程进行分析,确定反应后的终点溶液.在终点溶液中,找出阴离子与阳离子,根据题目已知条件,进行各种离子物质的量的计算,利用电荷守恒列出等式,完成计算.
例4将0.1 mol镁、铝混合物溶于100 mL 2 mol/L的H2SO4溶液,之后滴入1 mol/L的NaOH溶液,回答下列问题:
(1)如果在NaOH溶液滴入的过程中,沉淀的质量m随着NaOH溶液的体积V的变化如图2所示,当V1=160 mL,则金属粉末中n(Mg)=____mol,V2=____mL.

图2 沉淀m与NaOH溶液体积V的变化曲线图
(2)如果在NaOH溶液滴入的过程中,想要使得Mg2+、Al3+刚好完全沉淀,那么滴入的NaOH溶液的体积V=____mL.
(3)如果混合物依然是0.1 mol,其中Mg粉的物质的量分数是a,使用100 mL 2 mol/L的H2SO4溶解混合物,之后,加入450 mL 1 mol/L的NaOH溶液,得到的沉淀中没有Al(OH)3,满足此条件的a的取值范围是____.

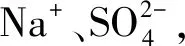
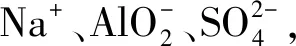
高中化学解题中,守恒法是重要的解题方式,能够简化解题步骤,提高学生解题效率.因此,在高中化学解题教学中,需要对守恒法进行汇总,帮助学生把握守恒法本质,掌握守恒法的应用方法,快速、准确地解答问题.
