晚期胃癌HER2 表达与MSCT多参数影像表现相关性分析
2023-12-06通讯作者陈文坚
陈 龙(通讯作者),叶 薇,王 康,陈文坚
(韶关市第一人民医院医学影像科,广东 512000)
胃癌是全球第五大最常见的癌症,也是第三大癌症死亡原因[1]。我国是胃癌高发国家,发病率占全球43.9%。由于不良生活习惯(高盐饮食、食用亚硝酸盐过多食物、长期饮食不规律)、工作压力增大、幽门螺杆菌的感染、吸烟、饮酒、过度肥胖以及缺乏癌症早期筛查的观念等原因[2-4],临床上多数胃癌患者确诊时已处于晚期,即临床Ⅳ期[5]。ToGA 研究[6]证实,曲妥珠单抗联合化疗一线治疗可使人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)阳性晚期胃癌患者总生存期(overall survival,OS)超过1 年,客观缓解率(objective response Rate,ORR)从34.5% 提高到47.3%,成为胃癌靶向治疗的里程碑,使得胃癌从传统治疗迈入分子靶向治疗新时代。目前,胃镜检查或肝脏活检,被认为是鉴别晚期胃癌中HER2 表达状态的金标准[7]。但取样错误、样本量小、等待免疫组织化学结果时间长以及活检相关的并发症而产生的局限性仍然存在。多层螺旋CT(multi-spiral computed tomography,MSCT)是评估胃癌范围和远处转移的一种重要手段。本研究探讨晚期胃癌HER2 表达与MSCT多参数影像表现的相关性关系,从而为晚期胃癌HER2 表达的诊疗提供依据。
1 资料与方法
1.1 研究对象
收集2017 年6 月至2021 年12 月晚期胃癌患者临床资料并最终纳入患者62 例,其中男性36例,女性26 例,年龄39-85 岁,中位年龄65 岁。纳入标准:①伴有不可切除的局部进展期胃癌(IVa期)和伴有远处转移胃癌(IVb 期)的组织病理学或影像学表现;②具有符合诊断CT 图像;③经免疫组化染色HER2 表达结果。排除标准:①增强CT 检查前已经接受过治疗的患者;②无HER2 检测结果;③质量不符诊断要求的CT 图像。所有患者在接受MSCT 检查前均已进行宣教并签署知情同意书。本研究已通过医院伦理委员会批准。
1.2 方法
1.2.1 HER2 胃癌的检测方法
根据2016 年胃癌HER2 检测指南判断及评分标准,采用免疫组织化学染色(immunohistochemistry,IHC),荧光原位杂交法(fluorescence in situ hybridization,FISH),IHC 结果为3+则确诊为HER2阳性,若结果为2+则需要进一步行原位杂交技术,即免疫结果为2+并FISH 阳性患者则确诊为HER2阳性,IHC 结果为0 或+则确诊为HER2 阴性[7]。由2 名高年资病理医师独立复阅病理切片。
1.2.2 CT 检查方法
采用德国西门子公司Siemens Somatom Definition 128 层螺旋CT 扫描,患者禁食6-8 小时,检查前饮用温水500-800ml,并对患者进行呼吸训练。行仰卧位腹部平扫及增强三期。扫描管电压120kV,自动管电流调制,螺距0.6,重建层厚、层间距均为1mm。增强CT 检查时,碘帕醇造影剂加温至37℃,使用Medrad Stellant 高压注射器以3.0mL/s 速率注射,剂量1.5ml/kg 碘帕醇(300mgI/mL)造影剂;应用对比剂自动跟踪触发技术,动脉期监测降主动脉动脉期CT 值升至120HU 后6s 扫描,门静脉期于动脉期后30s 扫描,延迟期为150s。所有图像资料均传送至syngo.via 工作站进行分析处理,对病灶进行多平面重建(multi-planar reconstruction,MPR),图像再传至图像存储与传输系统(picture archiving and commubnication system,PACS)。
1.3 CT 图像特征分析
所有CT 图像经PACS 略去患者信息标志。由2 位医学影像科高年资CT 医师进行独立盲法阅片,观察并记录肿瘤位置、大小、厚度、边缘、强化程度、强化模式、是否有淋巴结转移、肝转移及腹膜转移,作出全面分析和诊断,如果意见不一致时,则邀请更高职称医师分析讨论达成共识。肿瘤强化程度标准:轻度强化(CT 增强绝对值增加10-30Hu),明显强化(CT 增强绝对值增加40Hu 以上)。强化方式标准:测量肿瘤内同期强化最明显、最不明显的区域分别测量CT 值差值,均匀强化(差值<10Hu),不均匀强化(差值≥10Hu)。淋巴结转移阳性标准:依据UICC/AJCC 第八版分期结合日本胃癌的分类标准,将短径≥10mm 类圆形肿大淋巴结、短长径比>0.7、形态不规则、病灶周围有一簇≥3 个淋巴结,或有坏死灶的淋巴结、高强化或强化不均作为判断转移标准。日本胃癌协会将淋巴结分为23 组,其中No.1-No.12 和No.14v 淋巴结定义为区域淋巴结,余组淋巴结转移时诊断为M[8-9]。
1.4 统计学分析
所有统计检验均采用SPSS25.0 统计软件包分析,用Kappa 一致性检验来评价2 位CT 医师诊断的一致性。计数资料以[n(%)]表示,采用卡方检验比较组间数据的统计学差异。以HER2 表达阳性或阴性为因变量,以两组间差异具有统计学意义的征象为自变量,进行多因素Logistic 回归分析确定阳性组与阴性组的重要CT 特征。结果以OR 值及其95% 置信区间(CI)表示。P<0.05 为差异有统计学意义。
2 结果
2.1 晚期胃癌HER2 表达情况与临床病理特征的相关性
HER2 阴性组47 例(75.8%)、HER2 阳性组15例(24.2%)。发病年龄<60 岁21 例、≥60 岁41 例,男36 例、女26 例;分化程度:中/高分化15 例、低分化/未分化47 例;Lauren 分型:肠型19 例、弥漫型/混合型43 例。两组间进行卡方检验,患者的年龄(χ2=0.003,P=0.960)、性别(χ2=0.030,P=0.861)、分化程度(χ2=0.008,P=0.929)、Lauren 分型(χ2=0.004,P=0.950)比较差异均无统计学意义。见表1。

表1 HER2 阴性组和阳性组晚期胃癌患者的临床病理特点比较
2.2 晚期胃癌HER2 表达情况与MSCT 多参数影像表现相关性
患者的多参数MSCT 影像表现特征方面,2 位CT 医师分别测量62 例胃癌病变的大小、厚度、CT增强绝对值,ICC 均>0.75,一致性较高。肿瘤部位:胃食管交界部3 例、胃部59 例,肿瘤厚度<15mm 17例、≥15mm 45 例,肿瘤大小<50mm 22 例、≥50mm 40例。强化方式:均匀强化38 例、不均匀强化24 例。强化程度:轻度强化26 例、明显强化26 例。是否淋巴结转移:有淋巴结转移47 例、无淋巴结转移15例。是否肝转移:有肝转移20 例、无肝转移42 例。是否腹膜转移:有腹膜转移28 例、无腹膜转移34例。两组间进行卡方检验,胃癌病变影像特征的部位(P=1.000),厚度(χ2=0.000,P=1.000),大小(χ2=1.081,P=0.298),强化方式(χ2=0.014,P=0.906),是否淋巴结转移(χ2=0.008,P=0.929)比较差异均无统计学意义。而强化程度(χ2=3.910,P=0.048)、是否肝转移(χ2=4.022,P=0.045)、是否腹膜转移(χ2=5.058,P=0.025)差异具有统计学意义(P<0.05),见表2。
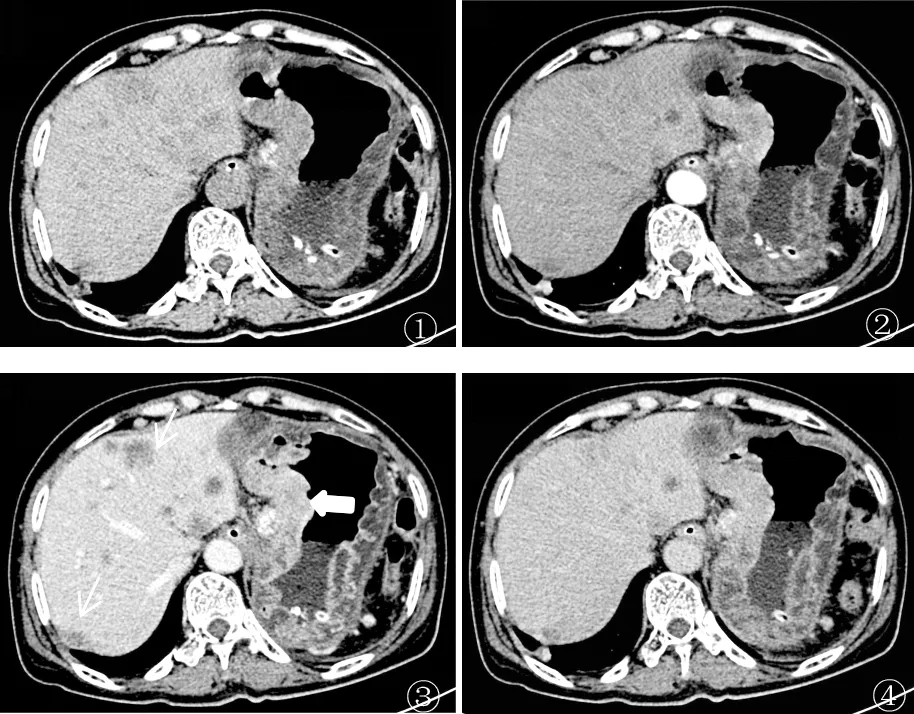
图1-4 HER2 阴性胃癌并腹膜转移(男,80 岁)
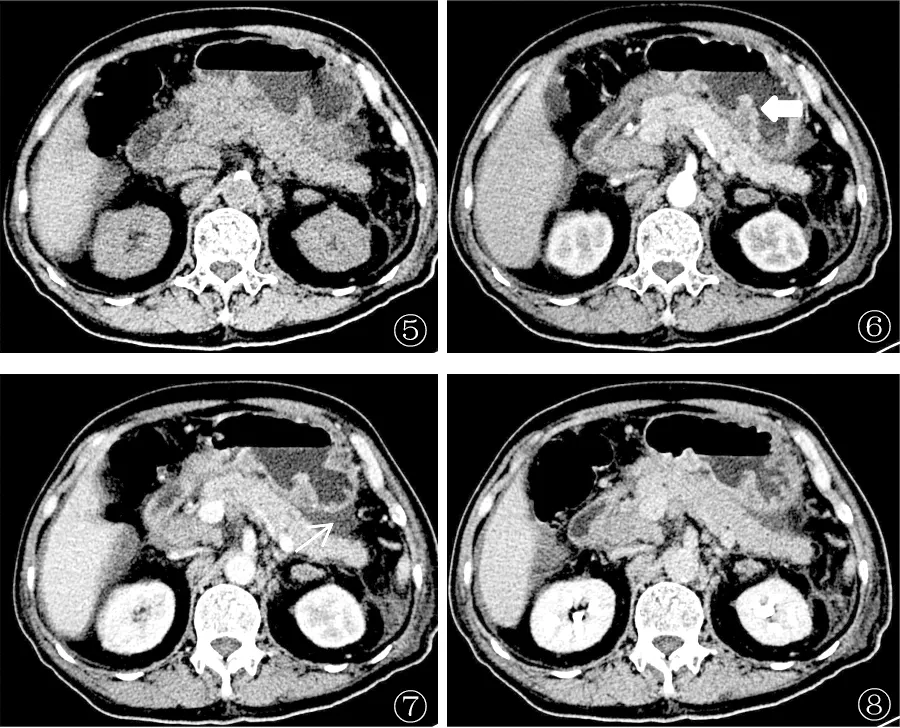
图5-8 HER2 阳性胃癌并肝转移(女,54 岁)
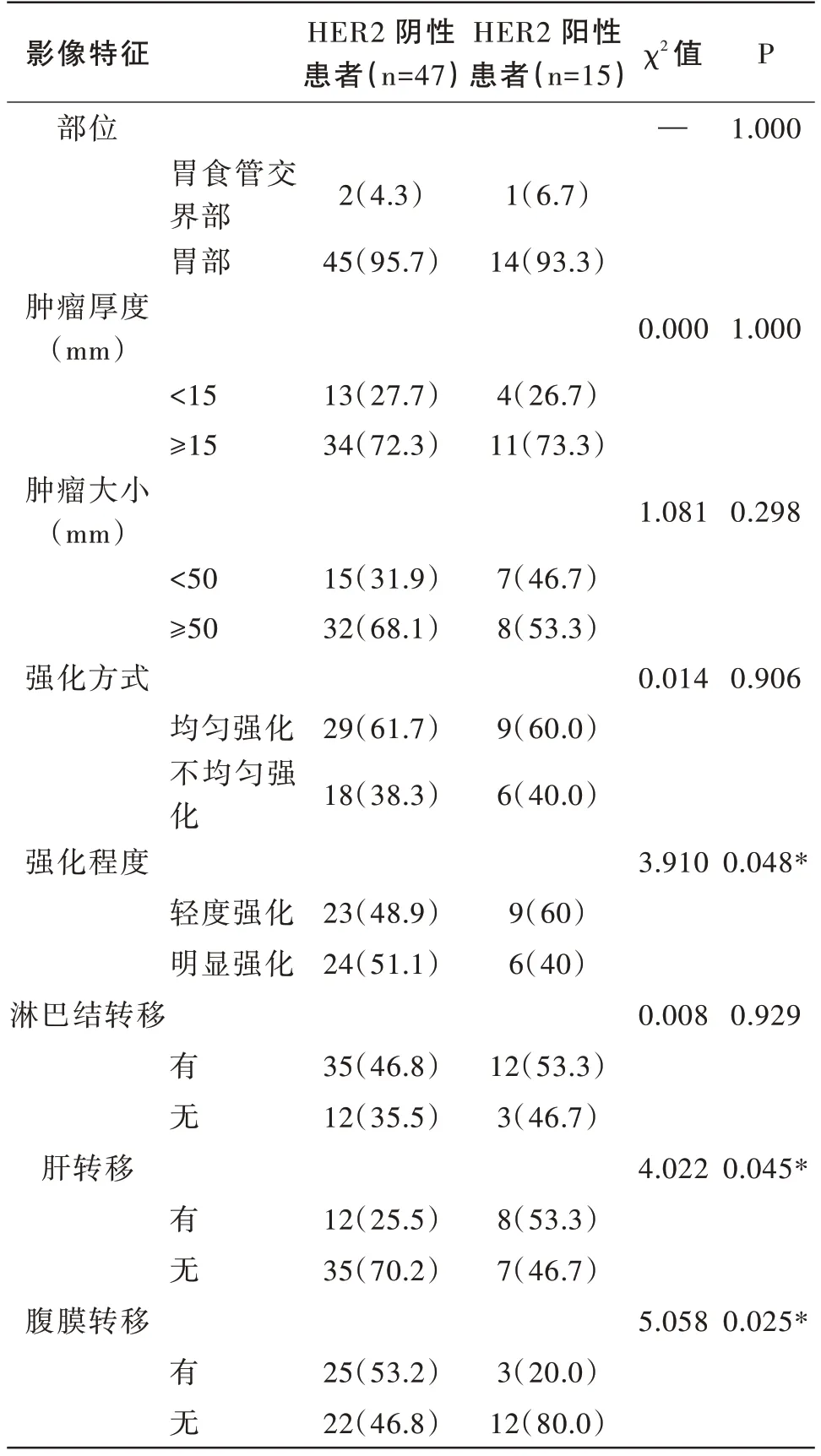
表2 HER2 阴性组和阳性组晚期胃癌患者的MSCT 影像特征比较[例(%)]
2.3 预测HER2 阳性胃癌的独立因素经多因素Logistic 回归分析
肿瘤明显强化(优势比[OR]=8.214,P<0.05)和存在肝转移(优势比[OR]=6.244,P<0.05)是预测晚期胃癌HER2 阳性的独立因素,见表3。

表3 HER2 阳性组晚期胃癌CT 特征的多因素Logistic 回归分析结果
3 讨论
HER2 蛋白是一个酪氨酸激酶,表达于多种肿瘤表面,包括乳腺癌、胃癌、肺癌和结直肠癌[10]。正常细胞含有大约2 万个HER2 的受体,而一些肿瘤细胞却包含有超过200 万(大于100 倍)的HER2受体,这种现象称为HER2 受体的过度表达。HER2 过表达影响肿瘤细胞的生物学行为,使肿瘤细胞迅速增殖,从而导致肿瘤的快速生长和转移[11]。晚期胃癌HER2 阳性组病灶在不同的研究中,8%~53% 的胃癌患者已被证实存在HER2 基因扩增或过表达[12-15]。不同HER2 表达产生肿瘤细胞不同的生物学行为,有研究表明晚期胃癌HER2 阳性患者的预后较差,但ToGA 研究[6]的成功说明了晚期胃癌个体化靶向治疗的发展前景,结果证实曲妥珠单抗联合标准化疗可使HER2 阳性晚期胃癌患者OS 延长至16 个月。基于DESTINY-Gastric 01研究[16],2022 年美国FDA 批准T-DXd 治疗HER2阳性晚期胃癌后线治疗新方案。HER2 阳性胃癌是一类具有特定遗传学改变特征的疾病。对于HER2阳性晚期胃癌患者一线治疗的首选是通过HER2靶向治疗,抑制HER2 通路,能明显延长HER2 阳性晚期胃癌总生存期。因此,准确识别HER2 表达情况在胃癌的治疗中至关重要。
《胃癌HER2 检测指南2016》《胃癌诊疗指南(2022 年版)》[7,17]指出,所有胃癌患者都应接受HER2 检测,只有免疫结果为3+以及FISH 阳性患者才能接受曲妥珠联合化疗治疗。胃镜活检标本或者手术标本进行IHC 和FISH 是获得患者HER2状态的主要方法,因胃癌存在高度肿瘤异质性[18],样本的HER2 状态不能代表全身所有肿瘤的HER2表达情况,且检测方法的有创性使其无法反复进行,也会存在抽样误差导致假阴性,从而可能使潜在的HER2 阳性胃癌患者失去分子靶向治疗的机会。MSCT 是目前术前评估胃癌患者临床常用方法,运用增强CT 在胃癌诊疗中更为常见[19]。MSCT多参数影像表现与肿瘤病理组织的异常改变关系密切,恰好可以弥补上述缺陷,不仅为多次随访检测晚期胃癌患者HER2 状态提供一种无创的新方法,而且可充分挖掘整个肿瘤隐藏的信息,从而避免抽样误差导致的假阴性。
本研究中,HER2 表达晚期患者临床病理年龄、性别、分化程度、Lauren 分型在HER2 阴性组与阳性组之间差异无统计学意义(P>0.05)。对肿瘤部位、大小、厚度、强化程度、强化模式、是否淋巴结转移、是否肝转移及腹膜转移等影像特征进行分析,其中,肿瘤部位、大小、厚度、强化模式、淋巴转移、是否淋巴结坏死在HER2 阴性组与阳性组之间差异无统计学意义(P>0.05)。
本研究将胃癌病变强化程度分为轻度强化、明显强化两种形式。结果显示,与胃癌晚期HER2 阴性组比较,胃癌晚期HER2 阳性组显示病灶强化程度更明显。根据相关研究[20]显示,HER2 表达触发信号下游的蛋白磷酸化,进而调节血管生成和细胞增殖。 血管内皮生长因子(vascular endothelial growth factor,VEGF)是内皮细胞特异性的促分裂原,能够刺激血管生成。HER2 过表达可以VEGF表达,VEGF 促进肿瘤实体内微血管的数量增多,与肿瘤侵袭和转移的潜能成正相关。从而解析了HER2 阳性组明显强化可通过较高的新生血管生成来解释[20]。郑红伟等(2021)[21]研究显示,胃癌HER2 阳性组更常出现增强扫描肿瘤门静脉期明显强化。王凤明等(2020)[22]研究显示,HER2 阳性胃癌门静脉期CT 多表现为高密度。
本研究MSCT 诊断显示,晚期胃癌HER2 阳性组比阴性组更容易转移到肝脏,Selim 等相关研究认为,HER2 阳性患者发生肝转移的概率相对较高,其机制可能与血管生成因子如微血管密度和VEGF的相关性有关[20]。一系列研究表明,胃癌HER2 阳性表达与肝广泛地转移相关[22-24],这是因为胃癌异质性强、病情进展快,肝脏又是胃癌血行转移时最常见的靶器官。
本研究存在一些局限性。首先,这是一项样本数量有限的单中心回顾性研究,虽然严格按照入选及排除标准来筛选病例,但是难以避免出现偏倚。其次,还需进行更多样本数据及多中心的研究,来辅助预测HER2 表达的CT 征象。第三,肝转移、腹膜转移患者只进行MSCT 评估,有必要结合MRI 进行评估,从而利用多模态人工智能技术分析晚期胃癌HER2 阳性组和阴性组肝转移、腹膜转移影像学特征的差异性。本研究初步结果表明,MSCT 可为临床提供一种无创的有价值的胃癌病灶HER2 监测手段,为HER2 生物学提供了无创性、重复性、可视化的研究方法,但今后建立的多变量模型尚需多中心大规模研究和前瞻性研究加以验证。
综上所述,晚期胃癌HER2 阳性表现与肿瘤强化程度(明显强化)、肝转移有一定关系。在目前个体化和MDT 发展的时代,MSCT 在预测晚期胃癌HER 表达情况方面显示了较好的潜在临床应用价值,可为胃癌患者的个性化转化治疗提供一定的临床应用价值。
