真空钙热还原制备金属钛实验研究
2023-12-06张跃宏丁秋霞
高 枫,詹 磊,张跃宏,张 奇,夏 鹏,丁秋霞
(1.长江师范学院,重庆 408100;2.国家电投集团铝电投资有限公司,宁夏 银川 750004;3.沈阳化工大学,辽宁 沈阳 110142;4.重庆建峰工业集团有限公司,重庆 408100)
钛及其合金是第二次世界大战后发展起来的新型结构材料,具有重量轻、强度高、耐高温、耐腐蚀及优良的低温韧性等特性,因此在航空、航天、导弹、船舰、化工及机械制造方面已得到广泛应用。我国是钛矿资源丰富的国家,钛矿资源总量9.65亿吨,占世界探明储量的38.85%。钛矿分布主要集中于广东、广西、海南及云南等省区,其主要类型为锐态型和金红石型。由于钛与氧、氮、碳、氢等元素具有较强的亲和力,致使钛的制取工艺技术复杂、流程长、能耗高且成本高,因而限制了钛的规模应用。钛制取的方法有热还原法,包括克劳尔(Kroll)法[1-2]、亨特(Hunter)法[3-4]、Armstrong法[5],金属氢化物还原法(MHR)[6]、钙热还原法(OS)[7]、预制成型还原法(PRP);电解法包括TiCl4熔盐电解法、钛酸盐容熔盐电解法、FFC剑桥法及离子液体电解法[8],但工业上常用Kroll法生产海绵钛。钙是一种较强的金属还原剂,利用钙作为还原剂可以还原矿石获得多种金属,如铀[9]、锆[10]、钍[11]等。国内有学者曾利用钙蒸汽还原制备TiO2,前苏联学者以CaH2作为还原剂直接还原TiO2制备金属钛,但以CaH2作为还原剂,在高温过程中利用CaH2高温分解后,得到金属钙作为还原剂制备金属钛。重庆大学邓斌[12]CaH2低温热还原TiO2制备钛粉进行了实验探索,得出在温度993 K以上、还原时间3 h可以获得钛粉颗粒,满足行业标准《钛粉》(YS/T 654-2007)钛粉 TF-2牌号要求。但在CaH2还原TiO2过程,固-固反应历程及其能量变化没有详细讨论。本文利用Factsage软件对CaH2热还原制备金属钛过程产物及能量变化进行了分析及计算,并对钙热还原TiO2实验验证,以便对工业生产给予借鉴指导意义。
1 Ca、Ti氧势图分析
金属对氧的亲和力可以用来判断氧化物MxOy稳定性的量度,吉布斯自由能ΔG越负,说明金属对氧的亲和力越大,相应氧化物越稳定。不同氧化物氧势线在氧势图中位置不同,位置越下,ΔG越负,在标准状态下越稳定。同时,氧势线位置在下的单质可以还原上面氧势线相应的氧化物。Ca、Ti氧化物存在有不同的化合物表现形式,如TiO、TiO2、Ti2O3、Ti3O5、Ti2O3、Ti4O7,涉及到的化学反应如式(1)~(7)所示。
(1)
(2)
(3)
Ti(s)+O2(g)=TiO2(s)
(4)

(5)
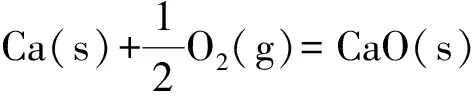
(6)
Ca(s)+O2(g)=CaO2(s)
(7)
通过吉布斯自由能计算得到氧势图如图1所示。
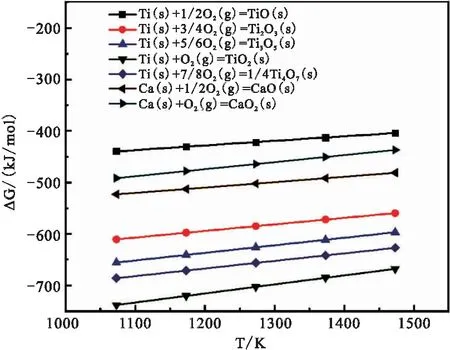
图1 不同Ca、Ti氧化物氧势图
从图1中可以看出,TiO2稳定性最好,TiO稳定性较差,Ca、Ti氧化物稳定性顺序依次如下:TiO2> Ti4O7> Ti3O5>Ti2O3> CaO> CaO2>TiO,钙与氧的亲和能力低于钛与氧的亲和能力,因此在适当的生产工艺条件下,金属Ca可以将 TiO2热还原得到金属Ti。
2 CaH2还原TiO2热力学分析
2.1 CaH2热分解
常压下CaH2分解反应式为:
CaH2(s)=Ca(s)+H2(g)
(8)
由式(8)计算:
ΔGθ=A+BT=247700-230.96T
(9)
真空体系下由于有H2释放,吉布斯自由能依据式(10)计算:
(10)
式中:R为气体常数,8.314 J/(mol·K);P(氢气)为H2分压,本实验取350 Pa;Pθ为标准大气压,1.013 25×105Pa;ΔGθ为常压下的吉布斯自由能,单位kJ/mol。
参照文献[12],在实验过程中,反应器压力50 Pa,由于升温过程CaH2发生分解反应有H2产生,反应器内压力上升至350 Pa,因此后续计算P(氢气)分压采用350 Pa进行计算,常压及压力350 Pa下T-ΔG关系如图2所示。

图2 常压和350Pa下CaH2热分解T-ΔG关系图
由图2可知,常压下CaH2的分解温度约为1 300 K,而在350 Pa压力下CaH2的分解温度973 K,压力降低有利于CaH2的分解温度降低。图3显示温度973 K,还原器内压力对CaH2的分解吉布斯自由能关系图,压力为0.5 atm,CaH2分解吉布斯自由能约为-30 kJ/mol。当压力接近真空时(0 Pa),CaH2分解吉布斯自由能约为-70 kJ/mol。由此可见,随着反应器内压力的降低,CaH2分解所需能量减少,有利于分解反应发生。

图3 CaH2分解P-ΔG关系图
2.2 H2还原TiO2热力学分析
在压力350 Pa,温度973 K下,CaH2可以分解成Ca和H2,H2和Ca均可能还原TiO2反应,H2还原TiO2反应见式(11),吉布斯自由能与热力学温度之间关系如图4所示。

图4 H2还原TiO2T-ΔG关系图
2H2(g)+TiO2(s)=Ti(s)+2H2O(g)
(11)
由图4可以得出,当热分解温度1 100 K时,反应方程式(11)能量ΔG=361.45 kJ/mol,当热分解温度为1 500 K时,式(11)反应所需能量ΔG=333.93 kJ/mol。因此当反应温度低于1 500 K时,所需吉布斯自由能为ΔG正值,由此可以判读出H2与TiO2不能发生还原反应。因此压力350 Pa,温度973 K下,CaH2分解产生的H2将会逸出,而不能作为还原剂还原TiO2得到金属Ti。
2.3 Ca还原TiO2热力学分析
金属钙的熔点:1 115.15K,低于温度1 115.15 K 下,钙以固体形式还原TiO2,可能发生的化学反应如式(12)~(21)所示。
Ca(s)+TiO2(s)=TiO(s)+CaO(s)
(12)
Ca(s)+TiO(s)=Ti(s)+CaO(s)
(13)
2Ca(s)+CaTiO3(s)=Ti(s)+3CaO(s)
(14)
2Ca(s)+TiO2(s)=Ti(s)+2CaO(s)
(15)
Ca(s)+2TiO2(s)=Ti2O3(s)+CaO(s)
(16)
Ca(s)+3TiO2(s)=Ti3O5(s)+CaO(s)
(17)
Ca(s)+4TiO2(s)=Ti4O7(s)+CaO(s)
(18)
Ca(s)+TiO2(s)=CaTiO3(s)
(19)
CaH2(s)=Ca(s)+H2(g)
(20)
在1 100~1 500 K下的,反应式(12)~(21)T-ΔG关系如图5所示。
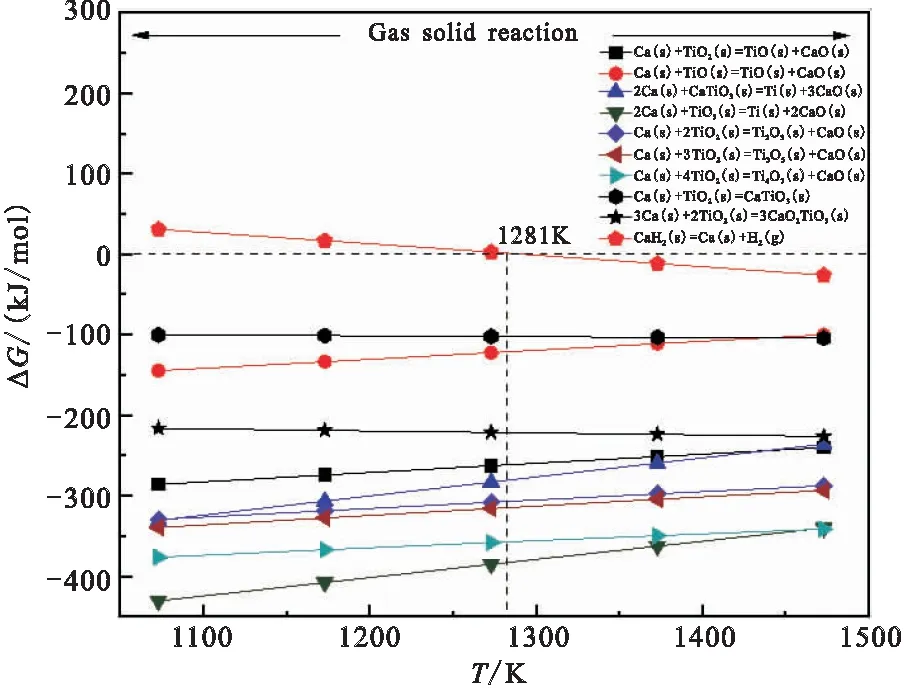
图5 Ca 还原TiO2T-ΔG关系图
由图5可知,钙热还原TiO2过程中,中间产物主要有TiO、Ti2O3、Ti3O5、Ti4O7、CaTiO3、3CaO·2TiO2以及Ti。由反应所需能量来判断,Ti4O7能量最小,CaTiO3生成能量最大,可以判断在1 100~1 500 K温度下,Ca可以作为还原剂与TiO2发生还原反应。从热力学能量角度分析,Ca热还原TiO2生成物的顺序为Ti4O7>Ti3O5>Ti2O3>TiO,即TiO2的钙还原反应由钛的高价化合物向低价钛还原过程,反应历程如图6所示。
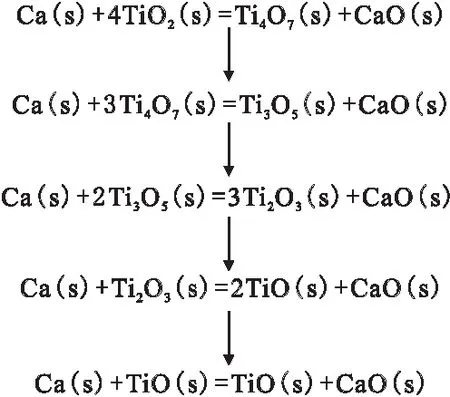
图6 Ca还原TiO2反应历程
图7对CaO-TiO2相图分析,CaO-TiO2体系共有三个化学计量比化合物,其中CaO·TiO2(CaTiO3)是同成分熔融化合物,熔点为1 450℃,3CaO·2TiO2(Ca3Ti2O7)是异成分熔融化合物,熔点为1 690℃。该体系中存在两个低共熔反应:

图7 CaO-TiO2体系相图
1 960℃ Liq↔CaO+Ca3Ti2O7
1 450℃ Liq↔CaO+CaTiO3
TiO2被Ca还原后可以生成不同的钛酸盐,适当的控制体系CaO量可以在较低的温度下产生液相,加快反应速率及降低反应温度。
3 Ca还原TiO2实验研究
反应温度973 K,不同时间Ca还原TiO2还原产物物相分析如图8所示。随着反应时间加长,CaO的衍射峰变得高且尖锐,含量也逐渐增多。反应时间0.5 h,CaH2分解产生少量的固体钙且发生部分还原反应,出现较多中间化合价钛氧化物,分析主要有TiO0.48、Ti0.78O0.937、Ti0.784O2、(TiO1.15)3.19等物相;还原时间1 h时,还原剂Ca含量逐渐增多,一部分低价钛氧化物被还原成Ti2O3和Ti3O5,未见Ti4O7物质存在,由此推断Ti4O7在高温下不稳定,与Ca反应发生反应时所需能量较少,发生还原反应的时间短暂;随着还原时间延长至1.5 h时,还原反应充分,固体Ca大量生成,TiO2被还原成Ti2O3、Ti3O5、Ti4O7以及Ti2O等钛氧化物,部分CaO与TiO2反应生成CaTiO3,微量金属Ti生成;当反应时间增加到2 h,CaTiO3的衍射峰消失,出现少量金属Ti;当反应时间延长至3 h时,反应较为充分,可以发现主要为金属Ti、Ca、CaO,其它钛氧化物衍射峰消失。实验分析结果与热力学计算分析相一致,验证了Ca还原TiO2热力学分析正确性。

图8 不同反应时间TiO2还原产物物相分析(700℃,350Pa,m(CaCl2)∶m(TiO2)=1∶4,m(CaH2)=2.4m(TiO2))
4 结 论
1)通过热力学计算表明,常压CaH2的分解温度1 273 K,当体系压力降低到350 Pa,可在973 K发生分解反应,压力降低有利CaH2的分解。
2)CaH2热分解生成Ca与H2,在温度区间1 100~1 500 K,H2不能与TiO2发生化学反应,Ca作为还原剂还原出TiO2中的金属Ti。
3)Ca还原TiO2存在多种物相形式,TiO2的反应由高阶向低阶进行,反应生成产物的顺序依次Ti4O7、Ti3O5、Ti2O3、TiO,即TiO2的还原反应由高价钛向低价钛还原历程。
