利拉鲁肽抗CXC趋化因子配体16诱导的人足细胞脂质沉积作用及机制
2023-12-05陈瑛曹爱丽
陈瑛,曹爱丽
(上海中医药大学附属普陀医院肾内科,上海 200062)
糖尿病的患病率逐年攀升,糖尿病肾病(diabetic kidney disease,DKD)是其最常见的并发症。据统计,约1/3 的1 型糖尿病患者和1/2 的2 型糖尿病患者进展为DKD[1],DKD 患病率将随着全球糖尿病患病率的上升而增加,预计在2045 年将增加近50%[2]。控制血糖、血压和调整生活方式是DKD的基本治疗策略。近年来,新型降糖药物不断涌现,如钠-葡萄糖协同转运蛋白2(sodium-glucose cotransporter 2,SGLT2)抑制剂、胰高血糖素样肽1 受体(glucagon-like peptide-1 receptor,GLP-1R)激动剂和二肽基肽酶4 抑制剂以及新一代盐皮质激素受体拮抗剂,这些药物在控制血糖的同时具有良好的肾保护作用。非糖尿病患者中使用SGLT2 和GLP-1R激动剂也能获得心肾保护作用[3-5]。提示除高血糖外还存在其他推动DKD发展的关键因素。
有研究表明,脂代谢紊乱与肾功能障碍及其他与DKD 相关的病理改变有关[6]。当人体能量摄入逐渐超过身体在脂肪组织中储存脂肪的能力时,非脂肪组织如肌肉、肝和肾等部位发生脂质沉积。值得注意的是,肾细胞对DKD的脂质沉积表现出不同程度的敏感性,其中足细胞对脂质沉积尤为敏感[7]。足细胞是肾小囊脏层上皮细胞,附着于肾小球基底膜外,其损伤被认为是DKD病理机制中的一个重要事件[8]。代谢紊乱、血流动力学异常、炎症和氧化应激等因素均可引起足细胞肥大,上皮间充质转化,并随着DKD的进展出现足细胞脱落或凋亡,导致肾小球滤过屏障破坏,引起大量尿蛋白产生,继而导致炎症级联反应,肾纤维化发生,最后发展为终末期肾脏疾病[9]。表明足细胞的完整性和生理功能对于延缓DKD 至关重要。高脂环境引起的足细胞脂质沉积可通过激活炎症、氧化应激和细胞凋亡等途径造成足细胞损伤[10]。故寻找改善DKD 足细胞脂质沉积的有效药物和靶点具有重要临床意义。
利拉鲁肽(liraglutide)是一种GLP-1R 激动剂,临床主要用于治疗2 型糖尿病,同时也可减轻2 型糖尿病患者的肾功能恶化和发展为终末期肾病的风险[11-12]。据2021 年美国糖尿病协会指南和中国糖尿病肾病防治指南,GLP-1R 激动剂可作为治疗2 型糖尿病和DKD 患者的首选药[13]。同时,利拉鲁肽对脂质代谢具有一定作用,可减轻2 型糖尿病患者内脏脂肪和异位脂质沉积,降低2 型糖尿病患者和肥胖青少年体重[14-16]。有研究发现,利拉鲁肽通过上调2 型糖尿病大鼠肾中AMP 活化的蛋白激酶(AMP-activated protein kinase,AMPK)磷酸化抑制大鼠肾脂质沉积,并在一定程度上改善糖尿病大鼠肾功能[17]。然而利拉鲁肽调控足细胞脂质沉积的具体作用机制尚不明确。
CXC趋化因子配体16(CXC chemokine ligand 16,CXCL16)是一种趋化因子,可通过激活炎症通路、上调细胞表面清道夫受体、诱导参与脂肪酸合成和储存的酶的表达等方式促进细胞中的脂质沉积。肾其他细胞脂质的摄取往往依赖于CD36,而足细胞中的脂质摄取却有赖于CXCL16 的功能[18]。临床研究表明,血清或尿液中CXCL16 的表达水平可作为2型糖尿病患者肾损伤及预测蛋白尿的新型标志物[19-21]。沉默CXCL16 表达可减轻氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)对小鼠足细胞的损伤[22-23]。说明CXCL16 摄取脂质进入细胞是造成足细胞脂质沉积并引起损伤的关键因子。他汀类药物具有显著的降脂作用,多项脂代谢异常的研究常将辛伐他汀(simvastatin)作为阳性对照药,这已在科学界得到广泛的认可[24-27]。此外,辛伐他汀表现出显著的足细胞保护作用,可通过抑制足细胞CXCL16 的表达减少足细胞对ox-LDL 的摄取进而发挥肾保护作用[22,28]。本研究首先通过高糖和棕榈酸模拟DKD 糖脂代谢紊乱环境,观察足细胞CXCL16 的表达水平。并通过外源性给予重组CXCL16 观察其对足细胞标志蛋白表达、细胞骨架、脂质沉积及炎症因子表达的影响,探讨利拉鲁肽对CXCL16 诱导的足细胞损伤和脂质沉积的作用及机制,进一步为利拉鲁肽在DKD的临床应用提供理论依据。
1 材料与方法
1.1 药物、试剂和主要仪器
重组CXCL16(美国Pepro Tech 公司,批号300-55),预先用纯水配制成100 mg·L-1的储备液,使用时1∶1000 稀释;利拉鲁肽(美国MedChem Express 公司,批号HY-P0014),预先用二甲亚砜(DMSO)配制成10,50 和100 μmol·L-1储存液,使用时1∶1000稀释;辛伐他汀(美国MedChem Express公司,批号HY-17502),预先用DMSO 配置成100 μmol·L-1的储存液,使用时1∶1000 稀释。棕榈酸和D-(+)-葡萄糖(美国Sigma 公司,批号P050,G8270)。澳洲胎牛血清(美国Hyclone 公司,批号SH30084.03);RPMI-1640 培养基、青霉素-链霉素(双抗)混合液、胰岛素-转铁蛋白-硒(Insulin-Transferrin-Selenium Supplement,ITS-G)(美国Gibco公司,批号C11875500BT,15070063,41400045);增强型RIPA 裂解液(武汉博士德生物工程有限公司,批号AR0102);BCA 蛋白定量试剂盒和SDSPAGE 胶配制试剂盒(上海碧云天生物技术有限公司,批号P0011,P0012);彩色预染蛋白Marker(美国ThermoFisher 公司,批号26616);PVDF 膜(美国Millipore 公司,批号IPVH00010);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、转化生长因子β(transforming growth factor-β,TGF-β)和白细胞介素1β(interleukin-1β,IL-1β)的ELISA 检测试剂盒(欣博盛生物科技有限公司,批号EHC103aQT,EHC107b,EHC002bQT);PCR 引物〔生工生物工程(上海)股份有限公司〕;兔抗人裂隙素单克隆抗体、鼠抗人β-肌动蛋白抗体、CytoPainter Phalloidin-iFluor 594 试剂和油红O 染色试剂盒〔艾博抗(上海)贸易有限公司,批号ab216341,ab6276,ab176757,ab150678〕;兔抗人CXCL16 多克隆抗体(Affinity Biosciences 公司,批号DF3312);兔抗人胆固醇调节元件结合蛋白1(sterol regulatory element-binding protein 1,SREBP1)、SREBP 2 和脂肪分化相关蛋白(adipose differentiation-related protein,ADRP)多克隆抗体(一抗)(美国Protein Tech公司,批号14088-1-AP,28212-1-AP,15294-1-AP);HRP 标记的山羊抗兔IgG 抗体(二抗)(美国CST 公司,批号7074P2);PCR 提取试剂盒、反转录试剂盒和PCR试剂盒〔天根生化科技(北京)有限公司〕。
1.2 细胞培养和分组
永生化人足细胞由美国西奈山医学院何慈江教授惠赠。人足细胞用RPMI-1640完全培养基(含10%澳洲胎牛血清、1%双抗、1% ITS-G)于33 ℃、5% CO2培养箱中培养,细胞融合度达70%时转入37 ℃、5% CO2培养箱培养分化7 d 用于实验,分化时所用RPMI-1640完全培养基不含ITS-G。
细胞分组:分组①细胞对照组、棕榈酸组(250 μmol·L-1)、正常糖组(葡萄糖5 mmol·L-1)、甘露醇组(葡萄糖5 mmol·L-1+甘露醇35 mmol·L-1)和高糖组(葡萄糖40 mmol·L-1),其中棕榈酸作用6 h,高糖作用24 h;分组②CXCL16 100 μg·L-1分别处理细胞6,12 和24 h 组;分组③细胞对照组、CXCL16 100 μg·L-1组、CXCL 16+利拉鲁肽10,50和100 nmol·L-1组及CXCL 16+辛伐他汀100 nmol·L-1组;分组④细胞对照组、CXCL16 100 μg·L-1组、CXCL 16+利拉鲁肽100 nmol·L-1组及CXCL 16+辛伐他汀100 nmol·L-1组。在分组③和④中,除细胞对照组外,各组预先给药2 h 后再给予CXCL16 100 μg·L-1继续培养24 h。
1.3 油红O染色检测人足细胞内脂滴面积比
取1.2 分组③处理的细胞,吸弃培养液并用PBS 清洗2 次,4%多聚甲醛固定后以PBS 清洗3 次,丙二醇室温孵育5 min,再以油红染料60 ℃孵育10 min。吸尽丙二醇后再以85%丙二醇溶液室温孵育1 min,蒸馏水冲洗2次后苏木素染色1 min,流水冲洗返蓝,甘油封片后倒置显微镜观察染色结果,脂滴呈橘红色至鲜红色。采集照片后使用Image J 软件分析,以油红染色阳性区域面积与照片总面积比值表示脂滴面积比。
1.4 鬼笔环肽染色检测人足细胞F-肌动蛋白应力纤维百分比
取1.2 分组④细胞,严格按照CytoPainter Phalloidin-iFluor 594 试剂说明书操作进行鬼笔环肽染色,染色完成后于激光共聚焦显微镜观察染色结果,细胞内丝状F-肌动蛋白呈红色,细胞核呈蓝色。采集照片后使用Image J软件分析,以单个细胞F-肌动蛋白染色阳性区域荧光强度总和占该细胞面积的百分比表示F-肌动蛋白应力纤维百分比。
1.5 ELlSA 检测人足细胞培养液中TNF-α,TGF-β和lL-1β浓度
取1.2 分组④处理后的细胞严格按照试剂盒说明书操作检测足细胞培养液中TNF-α,TGF-β和IL-1β的浓度。
1.6 实时荧光定量PCR 检测人足细胞中TNF-α,TGF-β和IL-1β mRNA 水平
取1.2 分组④处理的细胞,吸弃培养液并用预冰的PBS清洗2次后,严格按照RNA提取试剂盒和逆转录试剂盒提取RNA 和合成cDNA。按照说明书配制反应体系,在qPCR 仪器上进行PCR 扩增。反应条件:95 ℃预变性15 min,PCR 反应40 个循环,95 ℃变性10,60 ℃退火/延伸30 s。最终计算结果用β-肌动蛋白标准化目的基因的相对表达,2-ΔΔCt法计算目的基因相对表达水平。引物序列见表1。

Tab.1 Primer sequences for real time quantitative PCR
1.7 Western 印迹法检测人足细胞中CXCL16、裂隙素、SREBP1、SREBP2和ADRP蛋白水平
取1.2①②④分组处理的细胞,弃去培养皿中的细胞培养基,用预冷的PBS 清洗2 次,吸尽PBS后加入RIPA 裂解液(含PMSF、蛋白酶/磷酸酶抑制剂)冰上裂解20 min,收集样品于1.5 mL EP 管,13 800×g,4 ℃离心15 min,取上清;BCA 法蛋白定量变性后取15 μg 样品上样。8% SDS-PAGE 电泳分离蛋白后转至PVDF膜,5% BSA室温封闭1 h;按照说明书稀释一抗4 ℃过夜孵育(CXCL16、裂隙素、SREBP1、SREBP2、ADRP 和β-肌动蛋白稀释比为1∶10 000,脂肪分化相关蛋白(一抗)稀释比1∶500),次日TBST 洗膜3 次后加二抗(稀释比1∶10 000)室温孵育1 h,TBST 再次洗膜3 次后显影。运用Image J 软件分析,以目的蛋白与内参蛋白积分吸光度值比值表示蛋白的相对表达水平。
1.8 统计学分析
实验结果数据用±s,使用GraphPad Prism 9软件进行统计分析,通过单因素方差分析(Oneway ANOVA)进行多组间检验比较组间两两比较采用Tukey检验。P<0.05为差异具有统计学意义。
2 结果
2.1 高糖和棕榈酸对人足细胞CXCL16 蛋白表达的影响
Western 印迹结果(图1)显示,与细胞对照组相比,棕榈酸组足细胞的CXCL16 蛋白表达水平显著升高(P<0.01);与正常糖相比,高糖组足细胞CXCL16 蛋白表达水平显著升高(P<0.01),甘露醇组无显著差异。

Fig.1 Effects of high glucose(HG)and palmitic acid(PA)on expression of CXC-chemokine ligand 16(CXCL16)in human podocytes by Western blotting.Cells were treated with PA 250 μmol·L-1 for 6 h or glucose 40 mmol·L-1(HG)for 24 h.Cells in the normal glucose(NG)group were treated with glucose 5 mmol·L-1 for 24 h.Cells in the mannitol(Mn)group were treated with a mixture of glucose 5 mmol·L-1+mannitol 35 mmol·L-1 for 24 h to exclude the effect of osmolarity on podocytes.B was the semi-quantitative result of A.IA:integrated absorance.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with NG group.
2.2 CXCL16对人足细胞裂隙素表达的影响
Western 印迹结果(图2)显示,与细胞对照组相比,CXCL16 100 μg·L-1作用6,12 和24 h 组足细胞裂隙素蛋白表达水平均显著下降(P<0.01)。提示外源性给予CXCL16可引起足细胞损伤。
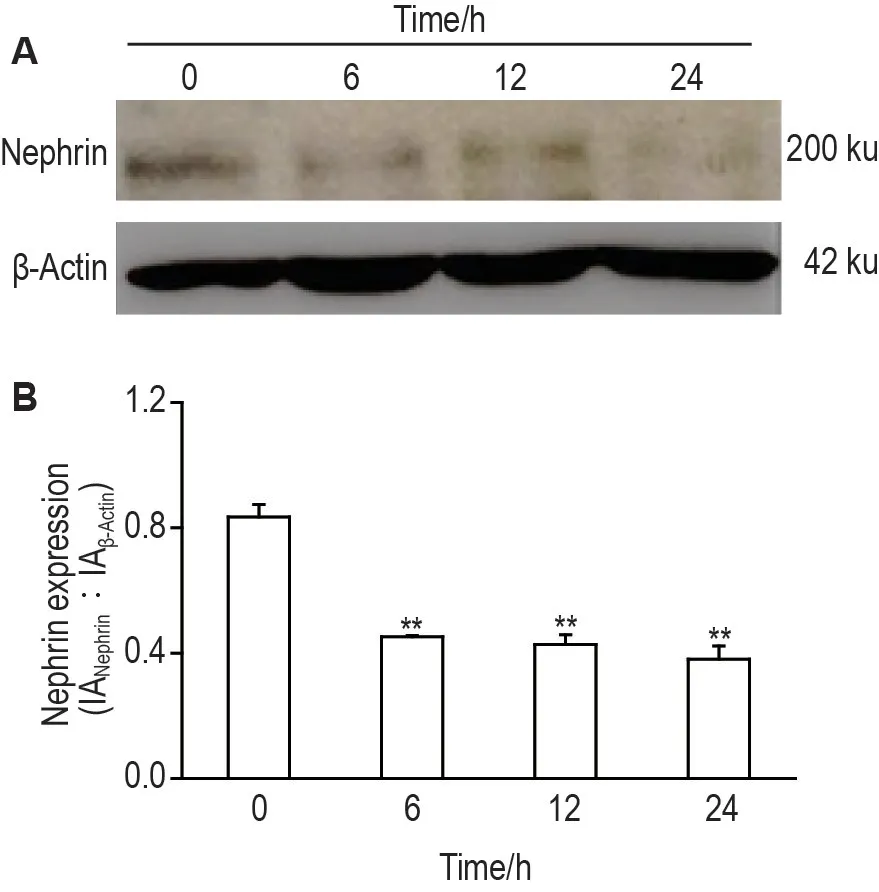
Fig.2 Effect of CXCL16 on nephrin expression in human podocytes by Western blotting.The cells were treated with CXCL16 100 μg·L-1 for 0(cell control)6,12 and 24 h,respectively.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with 0 h group.
2.3 利拉鲁肽对CXCL16 诱导的人足细胞脂质沉积的影响
油红O 染色结果显示(图3),与细胞对照组相比,CXCL16 100 μg·L-1组足细胞脂滴面积比显著升高(P<0.01),表明CXCL16 可以诱导足细胞脂质沉积。与CXCL16 100 μg·L-1组相比,CXCL16+利拉鲁肽10,50 和100 nmol·L-1组及CXCL16+辛伐他汀100 nmol·L-1组足细胞油脂滴面积比显著降低(P<0.01),表明利拉鲁肽可以改善CXCL16 诱导的人足细胞脂质沉积。
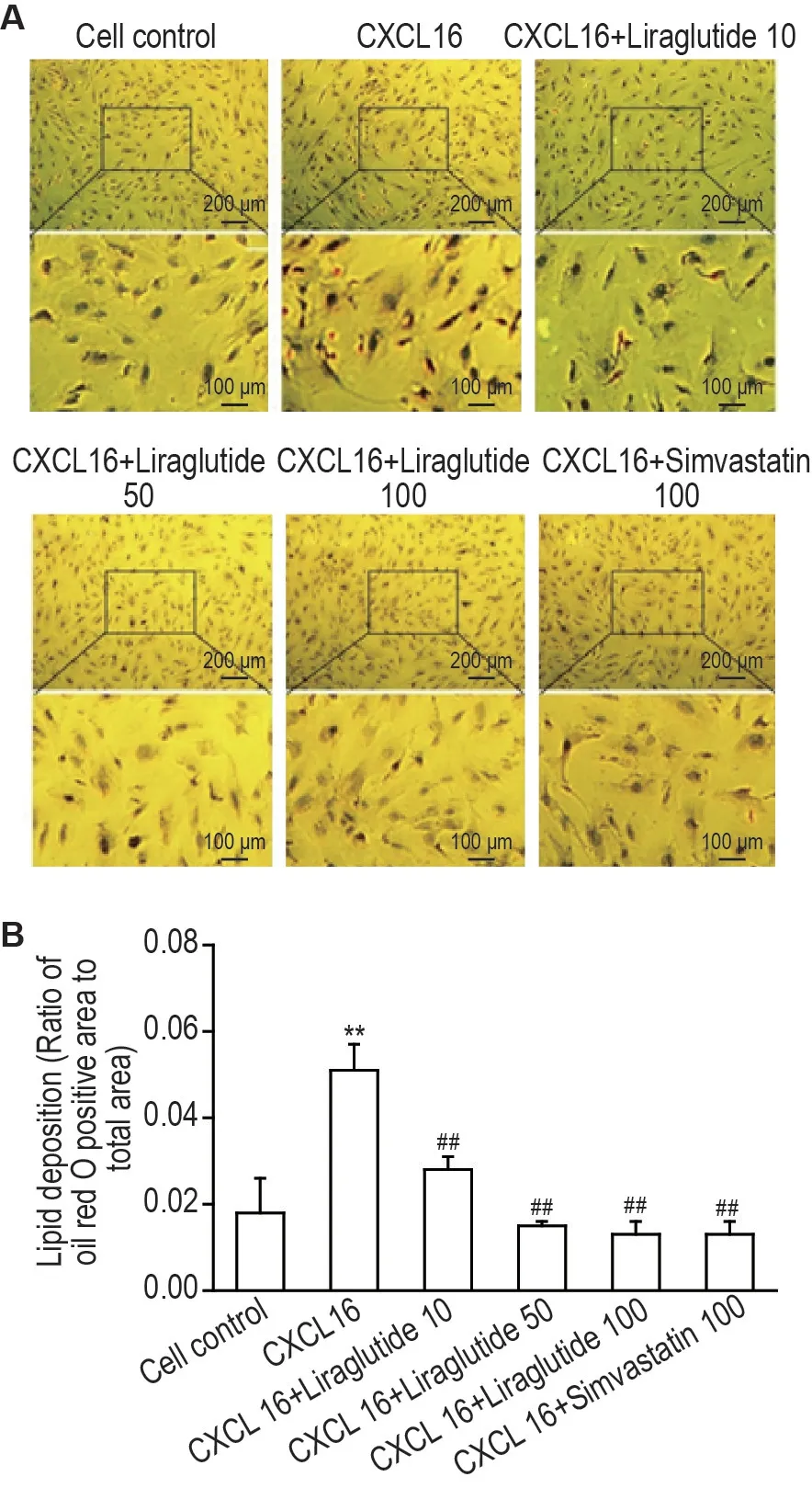
Fig.3 Effect of liraglutide on CXCL16-induced lipid deposition in human podocytes.After two hours of treatment with liraglutide 10,50 and 100 nmol·L-1 or simvastatin 100 nmol·L-1,the podocytes were stimulated with CXCL16 100 μg·L-1 for 24 h.Oil red O staining was used to detect the level of lipid droplets in human podocytes.B was the quantification of A.The number of observation positions for each treatment was chosen from a minimum of three fields.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with CXCL16 100 μg·L-1 group.
2.4 利拉鲁肽对CXCL16 诱导的人足细胞F-肌动蛋白应力纤维百分比的影响
鬼笔环肽染色结果(图4)显示,与细胞对照组相比,CXCL16 100 μg·L-1组足细胞应力纤维百分比显著下降(P<0.01),与CXCL16 100 μg·L-1组相比,CXCL16+利拉鲁肽100 nmol·L-1组和CXCL16+辛伐他汀100 nmol·L-1组足细胞应力纤维百分比显著升高(P<0.01),表明CXCL16 干预可引起人足细胞F-肌动蛋白受损,而利拉鲁肽可以改善该损伤。

Fig.4 Effect of liraglutide on the cytoskeleton of CXCL16-stimulated human podocytes.See Fig.3 for the cell treatment.Red fluorescence represents Phalloidin and blue fluorescence indicates a DAPI-stained nucleus.B was the quantification of A.Percentage of F-actin stress fibers(%)=Sum of fluorescencenintensity in regions of F-actin staining positive for individuat cell/area of the cell×100%.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with CXCL16 100 μg·L-1 group.
2.5 利拉鲁肽对CXCL16 刺激下人足细胞培养液中TNF-α,TGF-β和lL-1β蛋白浓度的影响
ELISA 实验结果(表2)显示,与细胞对照组相比,CXCL16 100 μg·L-1组足细胞培养液中炎症因子TNF-α,TGF-β 和IL-1β 蛋白浓度显著升高(P<0.01)。与CXCL16 100 μg·L-1组相比,CXCL16+利拉鲁肽100 nmol·L-1组和CXCL16+辛伐他汀100 nmol·L-1组足细胞培养液TNF-α,TGF-β 和IL-1β 浓度显著降低(P<0.01);表明利拉鲁肽可以抑制CXCL16引起的足细胞炎症水平升高。

Tab.2 Effect of liraglutide on secretion of TNF-α,TGF-β and lL-1β in CXCL16-stimulated human podocytes
2.6 利拉鲁肽对CXCL16 刺激下人足细胞TNF-α,TGF-β和IL-1β mRNA表达的影响
实时荧光定量PCR 结果(表3)显示,与细胞对照组相比,CXCL16 100 μg·L-1组足细胞中炎症因子TNF-α,TGF-β和IL-1βmRNA 水平显著增多(P<0.05,P<0.01);与CXCL16 100 μg·L-1组相比,CXCL16+利拉鲁肽100 nmol·L-1组和CXCL16+辛伐他汀100 nmol·L-1组足细胞中炎症因子TNF-α,TGF-β和IL-1βmRNA 水平显著降低(P<0.05,P<0.01)。表明利拉鲁肽可以抑制CXCL16 引起的炎症水平升高。

Tab.3 Effect of liraglutide on mRNA levels of TNF-α,TGF-β and IL-1β in CXCL16-stimulated human podocytes
2.7 利拉鲁肽对CXCL16 刺激下人足细胞裂隙素表达的影响
Western 印迹结果(图5)显示,与细胞对照组相比,CXCL16 100 μg·L-1组足细胞裂隙素的表达水平显著降低(P<0.01);与CXCL16 100 μg·L-1组相比,CXCL16+利拉鲁肽100 nmol·L-1组和CXCL16+辛伐他汀100 nmol·L-1组足细胞裂隙素的表达水平显著升高(P<0.01);表明CXCL16 可以引起足细胞损伤,利拉鲁肽可逆转该损伤。

Fig.5 Effect of liraglutide on nephrin expression in CXCL16-induced human podocytes by Western blotting.See Fig.3 for the cell treatment.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with CXCL16 100 μg·L-1 group.
2.8 利拉鲁肽对CXCL16 刺激下足细胞SREBP1,SREBP2和ADRP蛋白表达的影响
Western 印迹结果(图6)显示,与细胞对照组相比,CXCL16 100 μg·L-1组足细胞中SREBP1,SREBP2 和ADRP 蛋白表达水平显著升高(P<0.01)。与CXCL16 100 μg·L-1组相比,CXCL16+利拉鲁肽100 nmol·L-1组和CXCL16+辛伐他汀100 nmol·L-1组足细胞中SREBP1,SREBP2 和ADRP表达水平显著降低(P<0.01)。
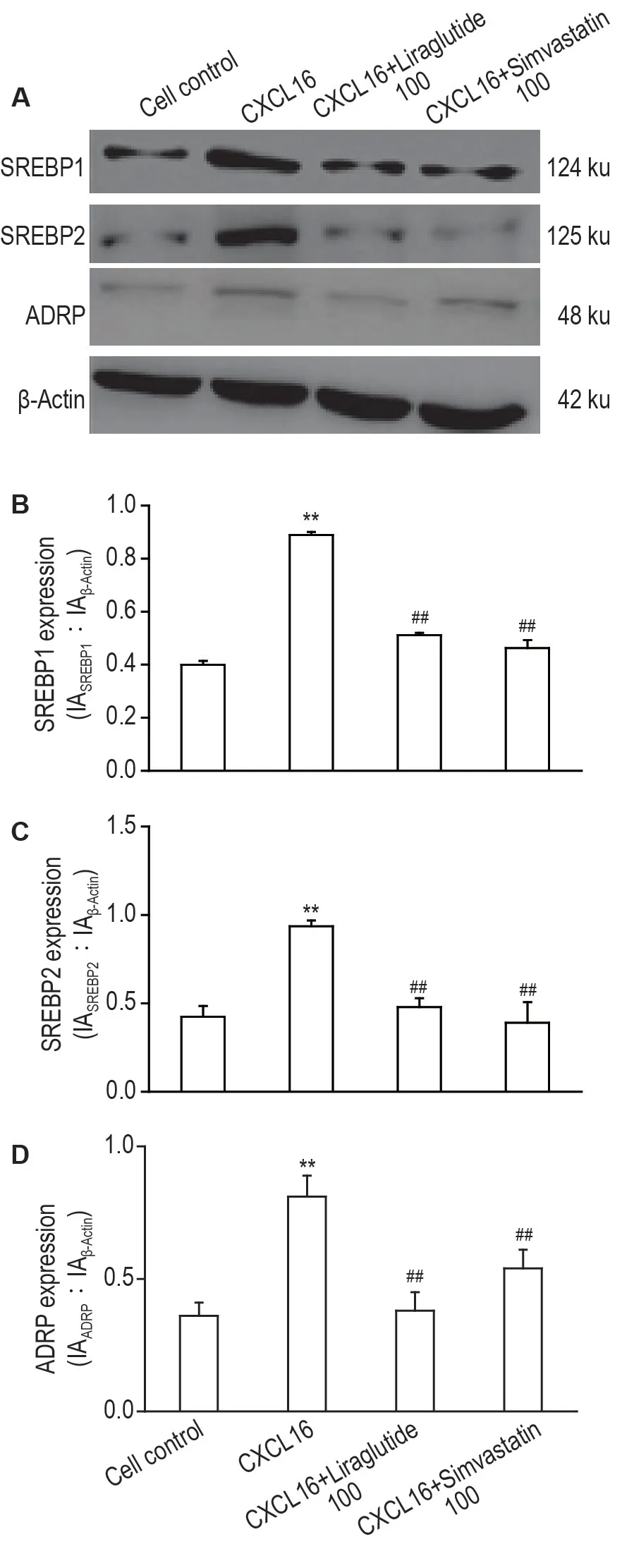
Fig.6 Effect of liraglutide on cholesterol regulatory element binding protein 1(SREBP1),SREBP2 and adipose differentiation-related protein(ADRP)expressions in CXCL16-induced human podocytes by Western blotting.See Fig.3 for the cell treatment.B,C and D were the semi-quantitative results of A.±s,n=3.**P<0.01,compared with cell control group;##P<0.01 compared with CXCL16 100 μg·L-1 group.
3 讨论
本研究结果显示,通过高糖或棕榈酸模拟DKD糖脂代谢异常刺激足细胞,均可引起足细胞CXCL16 表达水平的显著升高。表明CXCL16 在DKD 足细胞损伤中发挥重要作用。CXCL16 是足细胞摄取ox-LDL 的主要受体,ox-LDL 损害小鼠足细胞裂隙素的表达与CXCL16 有关[28]。裂隙素是一种特殊的肾小球黏附蛋白,在肾小球足细胞表面表达,参与肾小球裂隙膜的构成,对维持肾小球滤过及预防蛋白尿至关重要[29]。本研究结果显示,外源性给予重组CXCL16 刺激人足细胞,可引起人足细胞裂隙素的表达下调,说明CXCL16在DKD足细胞损伤中的重要作用。
有研究表明,DKD 与脂质代谢异常和脂质沉积有关[30]。除降糖作用外,利拉鲁肽可以有效降低甘油三酯、低密度脂蛋白等的水平,在调节脂代谢紊乱方面具有一定潜能[31]。本研究的结果表明,外源性给予CXCL16 可引起足细胞脂质沉积明显增多,利拉鲁肽可改善CXCL16 诱导的足细胞脂质沉积,与辛伐他汀效果相当,表明利拉鲁肽具有抗足细胞脂质沉积的作用。同时,本研究结果还显示,利拉鲁肽和辛伐他汀均可恢复CXCL16 引起的足细胞裂隙素表达下调和足细胞骨架受损,说明利拉鲁肽抗脂代谢可减轻足细胞损伤程度。
过多的脂质在细胞中积累时会通过各种机制导致炎症信号的激活,引起IL-1β,IL-18,TNF-α 和IL-6 等各种促炎症细胞因子的产生和释放[32]。在本研究中,CXCL16引起足细胞脂质沉积的同时,炎症因子TNF-α,TGF-β 和IL-1β 的分泌和mRNA 表达水平也显著升高,利拉鲁肽或辛伐他汀干预可显著改善这一变化,说明利拉鲁肽改善足细胞脂质沉积也进一步改善了脂质沉积激活的炎症反应。
SREBP 和ADRP 是介导脂肪酸的摄取、合成和氧化失衡以及脂代谢紊乱的重要分子[7]。SREBP是一类转录因子,包括SREBP1 和SREBP2 亚型,SREBP1 主要负责调控参与脂肪酸和甘油三酯合成的靶基因,而SREBP2 则负责参与胆固醇代谢基因的异常激活[33]。ADRP 主要参与细胞内脂质代谢和运输,可以结合游离脂肪酸和脂质滴泡,从而促进脂质合成和储存[34]。DKD 中发现脂质沉积引起肾小球ADRP 表达显著上调伴随足细胞标志蛋白足细胞素、裂隙素表达下调[35]。此外,在脂代谢异常引起的足细胞损伤中发现细胞骨架受损,可能与SREBP 表达异常相关[17]。本研究结果显示,CXCL16可引起足细胞SREBP1,SREBP2和ADRP的表达显著升高,利拉鲁肽和辛伐他汀均可降低其表达水平,表明利拉鲁肽可通过抑制SREBP 和ADRP 的表达抑制足细胞脂质沉积的发生,减轻足细胞损伤。
综上所述,CXCL16 在DKD 足细胞损伤中发挥重要作用,可诱导DKD足细胞脂质沉积的发生。利拉鲁肽可通过抑制CXCL16 诱导的脂质沉积减轻足细胞损伤程度,并缓解脂质沉积引起的炎症激活,这可能与利拉鲁肽能够抑制SREBP 和ADRP的表达有关。
