肿瘤浸润淋巴细胞在三阴性乳腺癌新辅助化疗预测价值中的研究进展*
2023-12-05韩佳雯苏婷婷徐元兵综述胡超华审校
韩佳雯 苏婷婷 徐元兵 综述 胡超华 审校
目前,随着乳腺癌的发病率在全球范围内不断增加,已成为全世界女性癌症死亡的主要相关因素之一[1]。其中三阴性乳腺癌(triple negative breast cancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)均不表达的一种乳腺癌亚型,由于暂无明确的分子靶点治疗,化疗是其主要的治疗方式[2]。TNBC是乳腺癌中极具侵袭性的一种类型,占浸润性乳腺癌的10%~20%[3],通常治疗选择有限且复发率高,较其他亚型乳腺癌预后差[4]。近年来,越来越多学者关注到肿瘤微环境(tumor microenvironment,TME)在肿瘤免疫抑制、远处转移、局部耐药和靶向治疗反应中的重要作用[5]。而肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs )作为TME 的重要组成部分,尤其在HER-2 阳性和TNBC 中高度表达。有研究对国内360 例TNBC 患者的肿瘤样本分析发现,TNBC进一步细分为管腔雄激素受体(luminal androgen receptor,LAR)为23%、免疫调节型(immunomodulatory,IM)为24%、基底样免疫抑制型(basal-like immunosuppressed,BLIS)为39% 和间充质型(mesenchymal,MES)为15%4种不同的亚型[6]。该研究进一步提出将TNBC 进行“分型而治”,通过分析465 例原发性TNBC 发现TNBC 中IM 亚型的TILs 比例明显高于其他亚型,预后较其他亚型更好,认为“分型而治”具有重要临床意义。因TNBC 复发转移的风险较高,且缺乏靶向治疗的作用靶点,使TNBC 患者的治疗方案相对局限,缺乏有效预测疗效及预后的分子标志物。本文主要针对TILs 作为生物标志物,对TNBC 的新辅助化疗(neoadjuvant chemotherapy,NAC)疗效及预后的预测价值进行阐述。
1 肿瘤浸润淋巴细胞
癌症是一种基因组疾病,由于基因组的不稳定性,许多点突变在肿瘤进展过程中积累,从而导致基因组和表观遗传学产生表型变异[7],引起免疫系统识别产生非自身抗原并引发细胞免疫反应[8]。正常机体由于免疫监视功能可以识别并清除 TME 中的异常增殖细胞,有助于调节肿瘤的进展[9]。TME 主要由肿瘤细胞、TILs,如巨噬细胞、淋巴细胞、自然杀伤细胞等,肿瘤相关基质细胞[肿瘤相关的成纤维细胞(cancer-associated fibroblasts,CAFs)]、细胞外基质(extracellular matrix,ECM)以及多种信号分子等相互作用共同构成[10]。有研究表明,TILs 可能影响TME 中的组成成分改变,进而促进或抑制肿瘤的发生、发展[11]。2014 年,国际免疫肿瘤生物标记物工作组对TILs 定义/检测方法及判读标准进行了详细描述,TILs 分类及作用在不同类型的癌症类型中,各种细胞的组成部分和作用机制存在较大差异性(图1)[12]。TME 可大致分为免疫微环境和非免疫微环境,以免疫微环境为主,其中的免疫微环境主要由TILs 构成,并根据其在TME 中分布位置的位置不同,将TILs 进一步分为间质肿瘤浸润淋巴细胞(stromal tumor-infiltrating lymphocytes,sTILs)和瘤内肿瘤浸润淋巴细胞(intratumoral tumor-infiltrating lymphocytes,iTILs)[13]。其中大部分TME 中TILs以sTILs 为主,大多数sTILs 分布于浸润性肿瘤细胞附近,常被认为是真正的TILs。有研究表明,在乳腺癌TILs 检测中,75% 以T 淋巴细胞为主,20% 为B淋巴细胞,5%左右为其他类型细胞[14]。有研究进一步表明,在不同分子亚型中TNBC 的肿瘤浸润免疫细胞检出比例较高[15]。
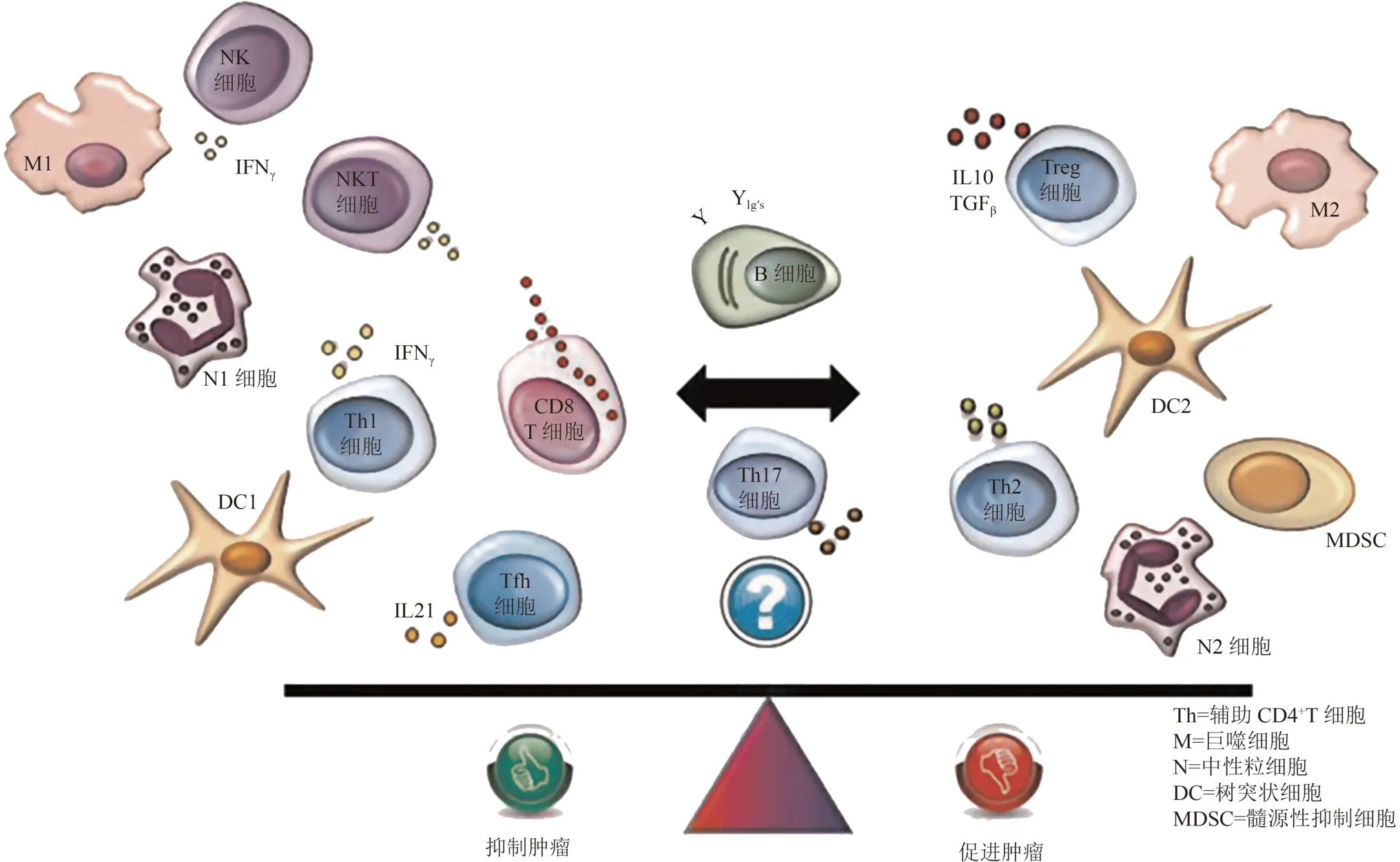
图1 肿瘤浸润淋巴细胞分类及作用[12]
目前,TILs 检测方法主要通过病理检查中标准的苏木精和曙红(haemotoxylin and eosin,H&E)染色或免疫组织化学法染色。近年来,细胞流式技术、组织芯片或组织微阵列技术(tissue microarray,TMA)、多重荧光免疫组织化学(multiplex immunohistochemistry,mlHC)及单细胞DNA 测序等技术均可用于TILs 的分类和计数。目前,常用免疫组织化学法或荧光染色法检测肿瘤组织中的TILs,不仅易于重复检测,而且价格低廉,被广泛应用于临床实践中TILs[16]。在2016 年生物标记物工作组指南中,建议使用sTILs 的百分比来评估TILs 的表达水平,而不是对所有的TILs 进行评估[17]。TILs 评估主要集中于sTILs 与iTILs 有效的检测,iTILs 检测是目前研究的热点之一。乳腺癌中iTILs 检测的难点主要包括下述几个方面:样本取材难度大,乳腺癌组织通常表现为不规则、碎片化的形态,取材难度较大,需要高质量、完整的组织样本才能得到可靠的iTILs 检测结果。对于iTILs 检测的评估标准尚未统一,包括可见度、计数方法、评估指标等均存在差异,导致iTILs 结果的可靠性和可比性有待进一步提高,目前大部分研究集中于便于检测的sTILs。
2 TNBC 的NAC 新辅助化疗的预测评估体系
由于TNBC 作为无特定的分子治疗靶点的乳腺癌亚型,NAC 常为TNBC 标准治疗,使肿瘤降期保乳、因并发症不可手术患者在接受NAC 后可行手术治疗,以及根据患者对化疗药物的敏感性对改变治疗策略等起着重要作用。病理完全缓解(pathologic complete response,pCR)是NAC 疗效评估的常见有效方法。有研究通过Meta 分析表明,达到 pCR 的乳腺癌患者的生存结局显著改善,且达到pCR 的患者比未达到pCR 患者的无事件生存期(event-free survival,EFS)和总体生存期(overall survival,OS)明显延长。因而手术中达到pCR 通常被认为是长期生存的替代指标[18]。尽管如此,有研究表明,提高pCR 率并不一定能改善预后[19],仍有少部分达到pCR 的患者发生远处转移[20]。患者因行NAC 2 个周期内的治疗疗效未知,对于化疗药物敏感性低的患者可以更改治疗方案,从而避免无效治疗产生的不良反应[21]。该研究还发现,若通过评估患者对NAC 疗效不佳,对NAC 疗效的早期评估预测可避免患者错过最佳手术时期。因此,NAC 疗效及预后的预测需要更全面的分析。
目前,临床上对TNBC 新辅助疗效的预测手段有多种手段,主要集中在影像学、分子病理学及组学等。影像学中常用的乳房超声检查、乳房数字乳腺X 光摄影(digital mammography,DM)/数字乳腺断层合成(digital breast tomosynthesis,DBT)均具有一定的预测价值;集成正电子发射断层扫描-计算机断层扫描(positron emission tomography computed tomography,PET-CT),以及最新的混合集成正电子发射断层扫描(positron emission tomography,PET)/磁共振成像(magnetic resonance imaging,MRI)扫描仪均具有一定的预测价值;其中MRI 通常在影像学评估中具有更加客观准确的价值[22]。分子生物标记物主要集中于TILs 检测、Ki-67 高表达、PD-L1 表达。组学主要集中于BRCA 基因、ITPKC 基因、DNA 甲基化、循环肿瘤DNA 的探索研究,每一种评估模式均具有相应的优缺点。
3 TILs 在TNBC 的NAC 预测价值
近年来,关于TILs 作为TNBC 的NAC 疗效预测的分子标记物开展了大量探索性研究。Denkert 等[23]首次报道了TILs 可作为乳腺癌NAC 反应的独立预测因子,TILs 表达水平与新辅助治疗pCR 率密切相关。TILs 高表达的乳腺癌患者,pCR 率维持在40%~42%。然而,该研究TILs 无表达的患者pCR率分别为3%~7%。结果表明,sTILs 表达水平与乳腺癌患者pCR 率密切相关。Ono 等[24]研究显示,180例行NAC 乳腺癌患者同样证实了TILs 的表达水平,在TNBC 对NAC 预后预测发挥重要作用,TNBC 达到pCR 的发生率(32%)较HER-2 阳性乳腺癌(21%)和HR 阳性/HER-2 阴性乳腺癌(7%)pCR 的发生率高于其他亚型乳腺癌。且在TNBC 患者中接受NAC 后,TILs 呈高表达水平的患者有近37% 达到pCR,而TILs 呈低表达水平的患者有近16% 达到pCR。Adams 等[25]通过对481 例TNBC 患者NAC 进行评估,发现大多数乳腺癌肿瘤组织中TILs 能正常表达,其中sTILs 表达水平与预后呈正相关。sTILs 作为连续变量与TNBC 的预后更好相关。该研究提示sTILs 表达水平每增加10%,肿瘤远处复发风险降低18%(P=0.04),患者死亡风险降低19%(P=0.01)。
Denkert 等[26]对TNBC、HER-2 过表达型乳腺癌以及激素受体阳性乳腺癌的TILs 表达研究。在TNBC 患者中,260 例TILs 表达水平较低的患者中有80 例(31%)达到pCR,373 例TILs 患者中有117 例(31%)达到pCR,而TILs 表达水平较高的273 例患者中有136 例(50%)达到pCR。该研究结果表明,TILs表达水平高低与TNBC 患者NAC 的pCR 密切相关。Luen 等[27]探索了TNBC 行NAC 患者残留病灶TILS 表达水平与残留癌症负担(residual cancer burden,RCB)的关系,发现将NAC 后的RCB 的Ⅰ、Ⅱ和Ⅲ 3 类比率分别为11%、50%和39%。Ⅰ、Ⅱ和Ⅲ3 类的3 年无复发生存期(recurrence-free survival,RFS)分别为86%(95%CI:76~98)、67%(95%CI:60~74)和26%(95%CI:20~34)。且RD TILs 水平与CD8+T 细胞密度之间呈正相关(P=0.41)。RD 中高表达水平的TILs 与RFS 显著相关(HR=0.86,95%CI:0.79~0.92,P<0.001);高表达水平的TILs与较长 的OS 率(HR=0.87,95%CI :0.80~0.94,P<0.001)具有显著性相关。Bai 等[28]进一步对TNBC 患者NAC 后残留病灶进行TILs 细胞种类进行分类比较,指出高CD4+TILs 和高CD8+TILs与无病生存期(disease-free survival,DFS)具有显著性相关。74例TNBC 患者在NAC 后24 例达到pCR,达到pCR率为32.4%。进一步的分析表明,CD4+/CD20+比值>1 或CD8+/ CD20+比值>1 是独立预后因子,残留肿瘤(residual tumor,RT)的TILs 亚型是NAC 后TNBC 患者生存的潜在预测生物标志物。Lee 等[29]通过比较基线肿瘤标本组织和NAC 手术后标本组织TILs 表达水平的差异性,在TNBC 接受NAC 后43例(41.3%)TILs 呈低表达低,而29 例(27.9%)呈TILs 水平高表达,而32 例(30.8%)未见明显变化。进一步探讨出TILs 表达水平连续性变化与患者的DFS相关。此外有研究证实,TNBC 患者肿瘤组织中sTILs 的表达水平与NAC 的疗效及预后有关,sTILs高表达患者的治疗效果和预后较低表达患者更好[30]。
4 TILs 对TNBC 的预后价值
研究表明,TILs 作为NAC 疗效预测的有效生物标志物,其对TNBC 的预后值得关注。大型临床试验数据表明,TILs 可作为乳腺癌患者NAC 的预后预测生物标志物,尤其是在TNBC 乳腺癌中,TILs 水平升高与RFS 之间存在强线性关系[31]。TILs 可分为T 淋巴细胞、B 淋巴细胞、NK 细胞等,并以T 淋巴细胞为主[32]。在TILs 中T 细胞可根据其T 细胞受体(T cell receptor,TCR)亚基以及核心系标记CD8 和CD4进行大 致分类,T 细胞主 要可分 为TCRγδ+、TCRαβ+CD4-CD8-双阴性T 细胞以及TCRαβ+CD4+CD8+双阳性T 细胞(其中包含CD4highCD8low、CD4highCD8high、CD4medCD8high和CD4lowCD8high)[32]。该研究认为TCRαβCD4+CD8+T 细胞是包括肿瘤组织在内最丰富的T 细胞亚群。CD8+TCRαβT 细胞,简称为CD8+T 细胞,有较强的抗病毒和抗肿瘤功能,通常被称为细胞毒性T 淋巴细胞(cytotoxic T lymphocytes,CTL),CTLs 能够产生高水平的抗肿瘤细胞因子和细胞毒性分子,如干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、穿孔素和颗粒酶等[33]。因此,通常认为CD8+CTL 表达量与癌症的预后改善相关[34]。该研究显示,外周组织驻留记忆(tissue-resident memory T cell,TRM)CTLs 在肿瘤免疫中的作用已成为热点,在外周组织中的 TRM 细胞表达经典标记CD103,也称为整合素αE,CD103 通常与整合素β7 复合,形成αEβ7 复合物,这种复合物与肿瘤细胞上表达的E-钙黏蛋白相互作用。因此,CD103+CTL 与多种实体瘤的生存率提高相关,包括几种妇科恶性肿瘤、肺癌、乳腺癌、黑色素和几种头部肿瘤[35]。B 淋巴细胞在免疫治疗中的存在与改善不同癌症类型的预后有关,B 细胞的促肿瘤作用也已被广泛应用[36]。有研究发现,伴随CD20+B 细胞的CD8+TILs 对预后有利[37]。随着免疫治疗的不断发展,近年来中国的乳腺癌免疫治疗从分子靶点、药物研发到临床试验,均取得了突破性的进展。研究表明,TILs 中的细胞亚群具有促肿瘤和抗肿瘤的双向作用,目前TILs 免疫治疗在大多实体瘤中都取得了一定的疗效[38],值得进一步研究。然而,在不同研究中对于TILs 表达水平的差异性与预后的关系存在不同的结论。本文通过查阅近年来关于TILs 与乳腺癌相关文献进行总结(表1)。提示上述研究结果的原因可能为:样本取材难度(乳腺癌组织通常表现为不规则、碎片化的形态,取材难度较大,需要高质量、完整的组织样本才能得到可靠的TILs 检测结果)。TILs 评估标准不统一(对于TILs 检测的评估标准目前尚未统一,包括可见度、计数方法、评估指标等均存在差异,导致TILs 结果的可靠性和可比性有待进一步提高)。专业技能要求高(TILs 的检测需要有具备一定的解剖、病理、免疫学专业知识和技能的病理医师来评估和计数,但目前缺乏一批专业、规范的人才队伍,技能水平和经验不足,也会影响到TILs 检测结果的准确性)。检测结果的批次差异(TILs 检测通常需要多个批次测试,如不同实验室、不同测试时间等,由于实验环境的不同,不同批次检测结果会存在波动,如不加以消除会影响到TILs 检测的准确性)。总之,乳腺癌中TILs 检测的难点较多。针对上述难点,需要进一步完善TILs 检测方法,建立统一的评估标准,加大专业技术人才的培养和引进力度,以及进一步采取有效措施,以提高检测结果的准确性和可靠性。
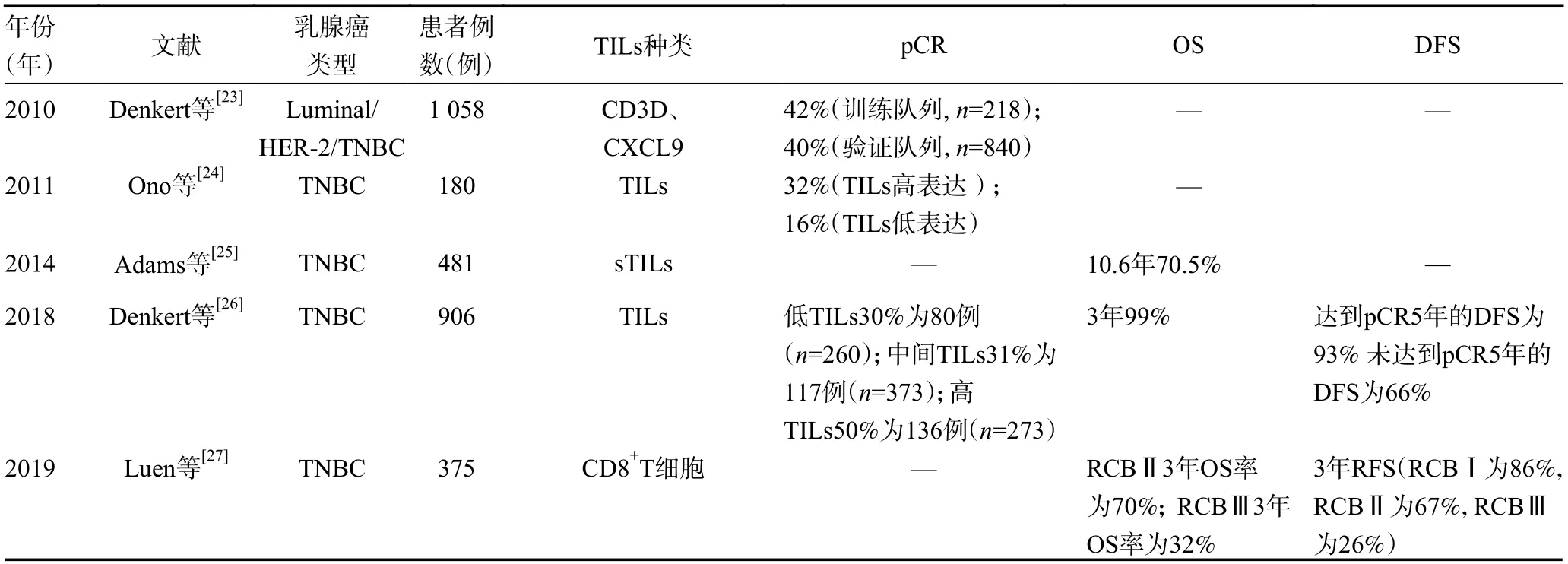
表1 TILs 与TNBC 的NAC 相关文献汇总
5 结语与展望
综上所述,TILs 在TNBC 中提供了重要独立的预后信息,TILs 作为生物标记物可以对TNBC 的NAC 疗效进行有效预测。其中,TILs 以表达CD4+、CD8+TILs 为主,且通常在TNBC 和HER-2 过表达型乳腺癌中呈现高表达;TILs 表达水平越高,对TNBC 患者NAC 疗效及预后越好;以及TILs 的连续性变化可能对TNBC 患者NAC 疗效及预后有影响。但有关TILs 病理评估的质控标准有待进一步探讨和制订。此外,临床前瞻性和回顾性的多中心、大样本量探讨TILs 分型与乳腺癌各亚型的关系相关性研究,为乳腺癌患者的治疗提供了更好的预测价值。
本文无影响其科学性与可信度的经济利益冲突。
