基于血清代谢组学研究黄连解毒汤对SD 大鼠胆汁酸代谢的影响
2023-12-04杨光勇杜海洋张庚鑫苏钢涂小华何光志
杨光勇,杜海洋,张庚鑫,苏钢,涂小华,何光志
(贵州中医药大学基础医学院,贵阳 550025)
黄连解毒汤(Huanglian Jiedu Decoction,HLJD)由黄连、黄芩、黄柏、栀子四味中药组成,功效为清热燥湿、泻火解毒,用于病机为实热火毒、三焦热盛之证。 中医基础理论中强调“异病同治”,故而黄连解毒汤在临床上广泛地用于实热火毒、三焦热盛之证的治疗,在现代医学的研究中常用于心脑血管病、糖尿病、阿尔茨海默病等疾病的研究。 大量文献证实黄连解毒汤具有降糖、降脂、抗炎、抗菌、抗肿瘤、抗内毒素、抗脑缺血及抗氧化等药理学作用[1-4]。 在代谢组学的研究方面主要是从肠道菌群以及肠道内代谢产物、血清学代谢组学以及相关细胞因子检测等方面对其作用机制进行验证与论述。血清代谢组学是对血清成分中所包含的生物标志物的组成进行研究,从而发现这些标志物在健康与疾病中的重要意义。 而胆汁酸是机体糖类、脂质和氨基酸这些能量代谢过程中能够共同影响到的物质,可调节这三大类物质在体内代谢过程中的相互转换。 血清中总胆汁酸含量较低,检测方法以LCMS/MS 的灵敏度、精密度最高[5-6],而血清代谢组学属于非靶向检测,通常检测不出明显的胆汁酸变化,但能检测出与胆汁酸代谢相关的其他物质,与粪便代谢组学结果结合综合分析,从而更加全面地发现胆汁酸代谢的作用机制。
本研究探讨方向为黄连解毒汤对健康大鼠血清代谢组的影响,实验中采用气相色谱-飞行时间质谱(gas chromatography tandem time-of flight mass spectrometry,GC-TOF-MS)非靶向代谢组学技术进行检测,筛选并鉴定差异代谢物,发现黄连解毒汤可能干预与胆汁酸代谢相关的代谢通路,进而分析总结其在机体内影响胆汁酸调节的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级SD 大鼠24 只,10 ~12 周龄,体重200 g左右,雌雄各半,购于北京华阜康生物科技股份有限公司【SCXK(京)2019-0008】。 饲养期间自由饮水,饲喂普通维持饲料由贵州中医药大学实验动物研究所提供。 饲养环境:昼夜各半循环照明,湿度恒定40% ~70%,温度控制在22 ~25℃,饲养于贵州中医药大学实验动物研究所【SYXK(黔)2021-0005】。 所有操作均符合贵州中医药大学实验动物研究所实验伦理学要求(IACUC 20210091)。
1.1.2 药物
黄连、栀子、黄柏和黄芩(购买于北京同仁堂贵阳分店)。
1.1.3 主要试剂与仪器
L-2-氯苯丙氨酸(批号103616-89-3,上海恒柏生物科技)。 气相色谱仪(Agilent 7890A;Agilent 公司,美国);质谱仪(PEGASUS HT,LECO;LECO 公司,美国);色谱柱(DB-5 MS,30 m × 250 μm × 0.25 μm;Agilent 公司美国)。
1.2 方法
1.2.1 黄连解毒汤的制备
取黄连90 g、栀子90 g、黄柏60 g、黄芩60 g,置于煎药锅内,加10 倍量的纯水浸泡1 h,加热沸腾后改中火煎煮40 min,倒出药液,然后加4 倍量的纯水中火煎煮30 min,合并药液,最后分别浓缩至0.63、0.31、0.16 g/mL(为生药量计算)即得黄连解毒汤,冷却分装后于4℃冰箱保存备用。
1.2.2 动物分组及样本采集
SD 大鼠适应性喂养7 d 后,随机分为4 组:空白组(N 组)、HLJD 高剂量组(H 组)、中剂量组(M组)、低剂量组(L 组),每组6 只。 H 组、M 组、L 组分别以6.25、3.125、1.56 g/kg 的HLJD 煎剂灌胃,每次1 mL,每天2 次,H 组、M 组、L 组每次灌胃量0.63、0.31、0.16 g/mL,N 组灌胃生理盐水,各自连续给药21 d。 实验结束禁食不禁水12 h 后,麻醉后,腹主动脉取血,室温静置40 min,3500 r/min 离心15 min,取上清即为血清。
1.2.3 代谢物萃取
在1.5 mL 无菌无酶的Ep 管中依次加入50 μL血清样本、200 μL 色谱级甲醇、5 μL L-2-氯苯丙氨酸(1.0 mg/mL),再依次进行如下操作:涡旋混匀30 s,冰水浴中超声10 min,4℃12 000 r/min 离心15 min。 质控(quality control,QC)样本由每个样本各取40 μL 混合而成,移取200 μL 上清液于1.5 mL Ep 管中,在真空浓缩器中干燥提取物,再用30 μL 甲氧胺盐试剂(CH6ClNO 20 mg/mL,溶质C5H5N)溶解,轻轻混匀后在80℃环境下孵育0.5 h,而后向每个样品中加入40 μL C2H2F3NO(1% C4H11ClSi),每组随机选取6 个样本,进行上机检测[7]。
1.2.4 上机检测
进样量:1 μL;分流模式:Splitless Mode;隔垫吹扫流量3 mL/min;载气氦气;柱流量1 mL/min;柱箱升温程序:50℃保持1 min,以20℃/min 的速率升到310℃,保持6 min;前进样口温度280℃;传输线温度280℃;离子源温度250℃;电离电压-70 eV;质量范围(m/z):50 ~500;扫描速率每秒12.5 光谱;溶剂延迟4.78 min。
1.2.5 数据处理
数据峰提取、基线矫正、解卷积、峰积分、峰对齐等分析采用Chroma TOF 软件(V 4.3X,LECO)进行[8]。 质谱、保留时间指数匹配等物质进行定性分析采用LECO-Fiehn Rtx 5 数据库。 数据降噪采用基于四分位数距对偏离值为主进行过滤,峰面积数据删除单组空值大于50%的结果,缺失值用最小值的1/2 填充,最后利用内标进行归一化处理[9]。
1.3 统计学分析
使用SIMCA 15.2 软件对降噪后的数据进行正交偏最小二乘法判别分析(orthogonal partial leastsquares-discriminant analysis,OPLS-DA),通过第一主成分的变量投影重要度(variable importance in the projection,VIP)值找到两组差异的变量[10]。 同时采用Student’sT检验比较各组间差异的显著性,并计算差异倍数log2(fold change)。 最后以VIP >1 和P<0.05 分别筛选出差异代谢物。 对于筛选出来的代谢物导入MetaboAnalyst 平台进行拓扑分析[11],找到最相关代谢通路。
2 结果
2.1 原始数据的预处理
原始数据包含6 个QC 样本和30 个实验样本,从中共提取到586 个峰。
2.2 OPLS-DA 分析
各组间样本区分显示,样本全部处于95%置信区间内。 在置换检验中(200 次),与空白组比较,H组R2= 0.693,Q2= 0.95;M 组R2= 0.652,Q2=0.964;L 组R2=0.654,Q2=0.963,结果表明模型组间差异具有显著性(图1)。
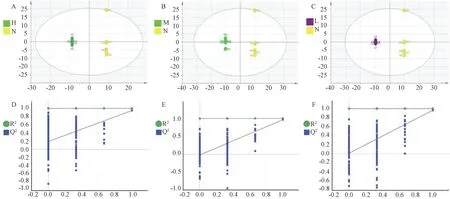
注:A ~C:分别为H 组、M 组、L 组与N 组分散点图;D ~F:分别为H 组、M 组、L 组与N 组模型置换检验图。图1 各组OPLS-DA 模型的分散点图及置换检验Note. A ~C. Scattered point plots for group H,group M,group L and group N. D ~F. Permutation test graphs of group H,group M,group L and group N models respectively.Figure 1 Scatter plot and permutation test of OPLS-DA model scores in each group
2.3 差异代谢物的筛选
OPLS-DA 分析各组大鼠肠道内容物,VIP >1被认为是有潜在差异的代谢物,组间样本t检验中,P<0.05 被认为是组间的差异代谢物,选用上述两种统计方法及阈值进行差异代谢物筛选提高数据可信度(见图2,表1)。 从检测结果发现,H 组、M组、L 组大同小异,3 组分别筛选出16、27、25 种差异代谢物。

注:从左至右依次为N 组与H 组、N 组与M 组、N 组与L 组的对比结果。图2 各剂量的HLJD 与空白组差异代谢物的火山图Note. Comparison results of group N and group H,group N and group M,group N and group L from left to right.Figure 2 Volcanic map of different metabolites between HLJD and blank group
2.4 差异代谢物的代谢通路分析
通过MetaboAnalyst 4.0 对差异代谢物进行通路分析(图3);图中纵坐标轴为lgp(-log(P)),来自通路富集分析,代表通路的显著性水平,P越小即lgp越大,节点的颜色越深;横坐标轴为通路的影响值(Impact),来自通路拓扑分析,代表代谢通路的影响程度的重要性,Impact 值越大,节点半径越大。 以Impact >0.05 为标准筛选主要代谢通路,即潜在的靶标代谢路径。 与N 组相比,H 组筛选得到潜在靶标代谢路径为:初级胆汁酸生物合成(primary bile acidbiosynthesis )、 甘 油 磷 脂 代 谢(glycerophospholipid metabolism)、 α-亚麻酸代谢(alpha-linolenic acid metabolism);M 组与正常组相比,筛选得到潜在靶标代谢路径为:甘油磷脂代谢(glycerophospholipid metabolism)、丙氨酸、天冬氨酸和谷氨酸代谢(alanine,aspartate and glutamate metabolism)、硫代谢(sulfur metabolism)、α-亚麻酸代谢(alpha-linolenic acid metabolism);L 组与正常组相比,筛选得到潜在靶标代谢路径为:甘油磷脂代谢、丙氨酸、天冬氨酸和谷氨酸代谢、α-亚麻酸代谢。在结果中发现,H 组相较于M 组和L 组显示出高剂量HLJD 才能让初级胆汁酸生物合成代谢路径产生强相关性,M 组和L 组丙氨酸、天冬氨酸和谷氨酸代谢路径相关性基本相同,H 组、M 组、L 组3 个组对于α-亚麻酸代谢和甘油磷脂代谢的相关性基本相同。
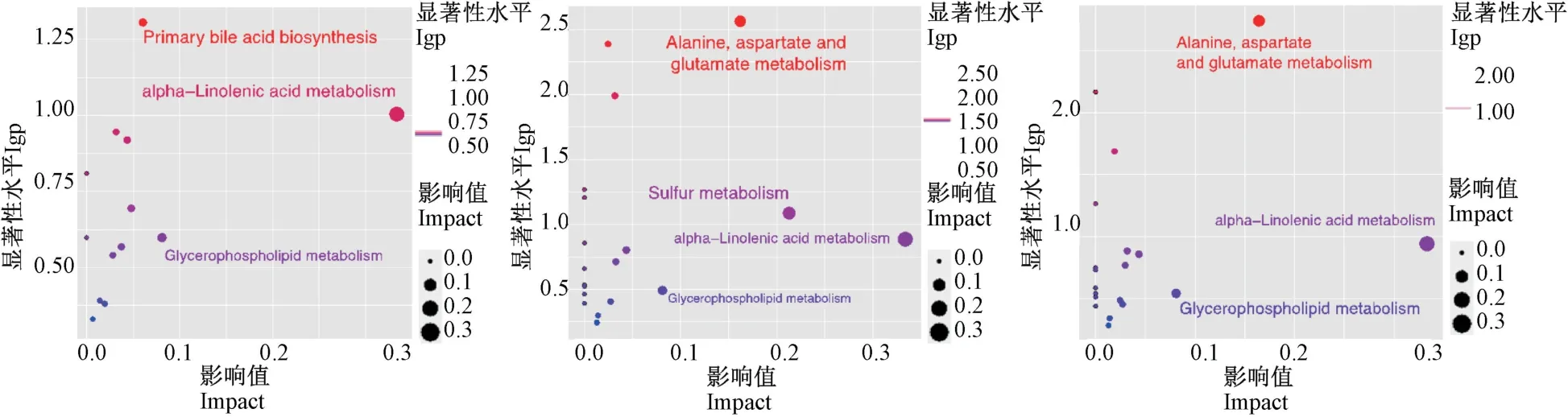
注:从左至右依次为N 组与H 组、N 组与M 组、N 组与L 组的对比结果。图3 差异代谢的代谢通路图Note. Comparison results of group N and group H,group N and group M,group N and group L from left to right.Figure 3 Metabolic pathway diagram of differential metabolism
3 讨论
肝细胞内由胆固醇合成初级胆汁酸后排泄到肠道中被肠道菌群代谢成次级胆汁酸参与机体多种正常生理机能活动,而进入血液中胆汁酸含量极低很难检测。 胆汁酸的生成代谢可通过血清中代谢物进行综合分析来推断药物对胆汁酸代谢的作用机制,不过血清与粪便中的代谢物变化存在不一致,这需要进行一定的分析总结。
首先,经过代谢通路分析可知各剂量黄连解毒汤都可干预α-亚麻酸代谢和甘油磷脂代谢。 Bar等[12]对人类血清代谢组研究发现肠道菌可独立于饮食因素来调控血清代谢物的生成,而高剂量黄连解毒汤促进了初级胆汁酸生成,却并未对丙氨酸、天冬氨酸和谷氨酸代谢路径产生强相关作用。 对比课题组前期实验中粪便代谢组学的检测结果发现,H 组、M 组、L 组都存在与硫代谢的强相关性,但关联性强弱与剂量成反比,H 组和M 组都与类固醇激素生物合成强相关,H 组和M 组都与半乳糖代谢强相关,而H 组还具有与淀粉和蔗糖代谢、脂肪酸生物合成的强相关性,M 组还有与三羧酸循环、二羧酸代谢、酪氨酸代谢、初级胆汁酸生成的强相关性[13]。 因此,粪便代谢组学和血清代谢组学代谢通路预测结果中具有关联的主要是初级胆汁酸生成[14],而丙氨酸、天冬氨酸和谷氨酸代谢路径[15]、半乳糖代谢[16]、淀粉和蔗糖代谢[17]、脂肪酸生物合成[18]、三羧酸循环[19]、二羧酸代谢[20]、酪氨酸代谢[21]、硫代谢[22]都可以在生物体内的代谢相互转化关系中影响胆固醇的生成,进而影响初级胆汁酸的合成。
其次,对比前期实验粪便代谢产物结果发现[13](表2),胆固醇含量显著增加的情况分别是粪便样本M 组及血清样本H 组。 胆固醇是初级胆汁酸生成的原料,与胆酸同是胆汁酸生成及代谢的重要部分,而胆酸是胆汁酸池的重要组成部分[23],H 组粪便样本中胆酸含量显著增加说明了体内胆汁酸生成量相应升高。 此外,比较特别的是2-酮-异戊酸1分别在粪便样本H 组和血清样本M 组、L 组中上升,α-酮异戊酸是一种由支链氨基酸缬氨酸不完全分解代谢产生的中间异常代谢产物,正常情况下缬氨酸应该代谢产生α-酮戊二酸并参与三羧酸循环[24],这也从另一方面说明了黄连解毒汤促进氨基酸代谢增强进而引起初级胆汁酸生成增加。 硫酸在粪便样本中含量全部下降,而在血清样本中只有M 组上升,硫酸还原和硫酸化是两条硫代谢的重要途径,而硫酸还原是多种菌群的主要能量来源,同时菌群又可以通过硫酸化将含硫废物转化为无害的硫酸盐,硫酸盐在激活和解毒异生物素、类固醇、神经递质和胆汁酸方面起着重要的生理作用,硫酸化的胆汁酸盐是胆汁酸池的重要组成部分[22,25],粪便样本中硫酸含量降低而血清样本中含量升高说明硫酸还原和硫酸化途径增强。

表2 血清与粪便差异代谢物中相同物质Table 2 Same substance in differential metabolites of serum and feces
胆汁酸代谢与糖尿病、肥胖、血脂异常、动脉粥样硬化等多种疾病相关,具有潜在治疗作用[26-27]。核糖在细胞内的遗传和能量结构上有着重要作用,比如,D-核糖是一种天然存在的5-碳单糖,其五边形环结构(呋喃糖)是核酸(DNA 和RNA)、辅酶(NADH、NADPH、FADH2 和乙酰辅酶A)和能量分子(ATP、GTP 等)结构的前体,在补充D-核糖的心力衰竭动物模型研究中发现可以增强心肌缺血后的心肌代谢和性能[28],本实验结果发现核糖在粪便和血清样本中的基本趋势都是上升,证明黄连解毒汤能够改善心脏功能。 Bermúdez 等[29]研究发现血浆中游离棕榈油酸的高水平与糖尿病和肥胖相关,可被视为非糖尿病患者胰岛素敏感性、β 细胞功能和葡萄糖耐量的独立决定因素,且血浆中含棕榈油酸的磷脂水平与HDL-胆固醇升高、LDL-胆固醇降低但三酰基甘油水平升高有关。 本研究结果中大鼠血清和粪便样本棕榈油酸都下降,证明黄连解毒确有改善心血管及糖尿病相关疾病的作用。 马来酸和苹果酸的区别在于苹果酸是饱和二羧酸而马来酸是不饱和二羧酸,是二羧酸代谢的产物,与延胡索酸互为顺反异构物,在三羧酸循环中可抑制酵素,有一定的毒性[30],在粪便样本M 组其含量上升,而血清样本L 组则下降,说明黄连解毒汤能够清除一定的马来酸,促进三羧酸循环。 2-脱氧四烯酸在粪便中全部检测出上升但在血清样本中则全部下降,4-羟基-6-甲基-2-吡喃酮在血清样本中都上升,但在粪便样本中上升的只有H 组,相关生物活性研究较少,目前在体内的作用还没有明确,但其在血清和粪便中显著相反的变化可作为潜在标志物。 从以上对比结果可以发现,两种代谢组学中存在不一致的关联性,就如同Deng 等[31]在进行粪便和血液代谢产物的比较肠道微生物群发现的与心脏代谢疾病的不一致关联类似,而出现这种情况的原因是黄连解毒汤剂量的不同导致对机体产生的效果不同。
在前期研究中发现提纯的黄连解毒汤比未提纯方剂对大鼠结肠内容物中胆汁酸生成的影响更大,这可能是因为提纯的黄连解毒汤中栀子苷含量丰富。 王坤等[32]研究黄连解毒汤中促进胆汁酸生成的物质是栀子苷,但栀子苷有一定的肝毒性,过量使用栀子可诱导肝细胞的坏死与凋亡,而黄连解毒汤中其他成分可通过去除自由基酶的活性以及抑制炎症反应等作用缓解这种肝毒性。 刘毓等[33]在使用栀子苷单体对大鼠血清及粪便胆汁酸的研究发现,基于大鼠400 mg/kg 的栀子苷即可导致肝损伤,但对粪便和血清样本中同种胆汁酸的含量的影响却存在一定的差异,这与本研究结果相似,但是否只有栀子苷促进胆汁酸代谢及黄连解毒汤的保护机制还需要进一步研究。
综合以上结果分析得出结论,从血清代谢物中筛选出的潜在的差异代谢产物和靶标代谢路径分析研究发现,黄连解毒汤可通过正向调节血清中胆固醇、胆酸、核糖、白皮杉醇、皮质醇、亚麻酸和油酸等水平促进体内初级胆汁酸生成进而增强胆汁酸代谢通路。
