慢性阻塞性肺疾病合并慢性肾病大鼠模型建立与评价
2023-12-04范正媛李亚李素云李高峰李景梅
范正媛李亚李素云李高峰李景梅
(1. 河南中医药大学第一临床医学院,郑州 450046;2. 河南中医药大学第一附属医院中药药理(呼吸)实验室河南省呼吸病防治中医药重点实验室,郑州 450000;3. 河南中医药大学第一附属医院呼吸科,郑州 450000;4. 河南中医药大学呼吸疾病中医药防治省部共建协同创新中心,郑州 450046)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)是一种进行性发展的慢性气道疾病,由于气道和(或)肺泡暴露于有害颗粒或气体而导致不完全可逆的气流受限和相应的呼吸系统症状,已成为我国和全球第三大疾病死亡原因[1-2]。COPD 的病理生理变化不仅局限于气道和肺部,更是一种累及全身,具有多种合并症的系统性炎症综合征,其中慢性肾病(chronic kidney disease,CKD)是COPD 常见的并发症之一[3-4],发病率6.5% ~26.2%[5],老年COPD 患者发病率高达31%[6]。CKD 是一种慢性进行性肾疾病,以肾结构和功能改变为特征,全球患病率超过10%,预计2040 年将成为全球第五大疾病死亡原因[7-8],COPD 合并CKD可进一步增加患者的住院时间、死亡风险和经济负担[9]。 然而目前有关COPD 合并CKD 的研究多集中于临床流行病学调查,相关的实验研究仍非常有限,因此本研究拟建立COPD 合并CKD 大鼠模型,为深入探讨其发病机制、寻求有效治疗方法提供实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
40 只6 ~8 周龄SPF 级SD 健康大鼠,体重180± 20 g,雌雄各半,由北京斯贝福生物技术有限公司提供【SCXK(京)2019-0010】。 饲养环境湿度为45% ~55%,维持25℃恒温,每天12 h 光照,适应性喂养1 周,饲养于河南省中医药大学第一附属医院中心实验室SPF 级动物房【SYXK(豫) 2017 -0001】。 本研究由河南中医药大学第一附属医院实验动物伦理委员会审查通过(YFYDW2021002)。
1.1.2 细菌
肺炎克雷伯杆菌(46117),购自中国医学细菌保藏管理中心。
1.1.3 红旗渠过滤嘴香烟
购自河南中烟工业有限责任公司,焦油量10mg,烟气一氧化碳含量12 mg,烟碱量1.0 mg。
1.1.4 药物
腺嘌呤(V900471)购自美国Sigma 公司。
1.1.5 主要试剂与仪器
HE 染液(CR2203235)、PAS 染液(CR2206022)、Masson 染液(CR2203222)试剂盒购自武汉赛维尔生物科技有限公司。 大鼠白细胞介素-6(IL-6,E-EL-R0015c)、 白细胞介素-1β ( IL-1β,E-ELR0012c)、白细胞介素-13(IL-13,E-EL-R0563c)、肿瘤坏死因子-α(TNF-α,E-EL-R2856c)试剂盒购自武汉Elabscience 公司;转化生长因子β1(TGF-β1,KE20010)试剂盒购自美国Proteintech 公司。
IVC-Ⅱ型独立送风隔离笼具(江苏冯氏实验动物设备有限公司);FinePointeTM型PFT 测量系统及全身体积描记系统(美国BUXCO 公司);URIT-1600型全自动尿液分析仪(桂林优利特医疗电子有限公司);C8000 全自动生化仪(美国雅培公司);Donatello 型脱水机、Giotto 型染色机(意大利Diapath公司);SpectraMax i3x 型酶标仪(美国Molecular Devices 公司);RM2245 型切片机、DM6000B 光学显微镜、全自动树脂处理机、全自动超薄切片机(德国Leica 公司);EM-1400 型透射电子显微镜(日本JEOL公司);BS210S 电子天平(德国赛多利斯公司)。
1.2 方法
1.2.1 动物分组与处理
将大鼠随机分为对照组(Control 组)、慢性阻塞性肺疾病模型组(COPD 组)、慢性肾病模型组(CKD组)、COPD 合并CKD 模型组(COPD +CKD 组),每组各10 只。
1.2.2 COPD 模型的制备
1 ~8 周,将大鼠连接熏烟箱,使箱内烟雾浓度达到3000 ± 500 ppm,熏吸暴露30 min,每天2 次,同时将浓度为6 × 108CFU/mL 的肺炎克雷伯杆菌液滴入大鼠鼻腔,每只0.1 mL,5 d 1 次。 Control 组给与等体积的生理盐水滴鼻。
1.2.3 CKD 模型的制备
1 ~ 2 周不予处理,3 ~ 6 周给予大鼠含有2.5%腺嘌呤的CMC-Na 混悬液,250 mg/(kg·d)灌胃,7 ~8 周减为125 mg/(kg·d)灌胃。 Control 组给予等体积0.5% CMC-Na 溶液灌胃。
1.2.4 建立COPD 合并CKD 模型
采用香烟暴露联合细菌感染合并腺嘌呤诱导的方法协同建立COPD 合并CKD 大鼠模型。 1 ~2周先给予香烟暴露联合细菌感染,3 ~8 周在此基础上进行2.5%腺嘌呤灌胃。
1.2.5 留取血、尿、肺、肾组织标本
造模结束后,收集大鼠24 h 尿液测定24 h 尿蛋白;经腹主动脉取血,分离血清检测肾功能及炎症因子水平;处死动物后取肺、肾组织进行组织形态学观察。
1.2.6 肺功能检测
以3%戊巴比妥钠麻醉大鼠(60 mg/kg,腹腔注射)后,气管插管检测大鼠用力肺活量(FVC)、第0.1 秒用力呼气容积(FEV0.1)及FEV0.1/FVC。
1.2.7 肺组织病理学观察
将大鼠左右肺分离,结扎右主支气管,左肺连灌流系统,用4%甲醛溶液灌注固定20 min,脱水,固定,石蜡包埋,切片后进行HE 染色,观察大鼠肺泡、细支气管、小血管的结构变化。
1.2.8 肾功能检测
应用全自动生化仪检测大鼠血清尿素氮(BUN)和肌酐(Cr)水平。
1.2.9 肾组织病理学观察
将大鼠左肾去除包膜,取一部分组织切成1 mm3小块,Gluta 固定液固定,经脱水、渗透、包埋、聚合、切片、染色后进行投射电镜观察肾组织超微结构变化(电镜图片由河南中医药大学电镜中心提供)。 将剩余肾组织横切厚度为3 mm 的组织块,固定、石蜡包埋、切片分别进行HE、PAS 及Masson 染色,观察大鼠肾基本病理形态、基底膜及间质纤维化改变。
1.2.10 炎症因子检测
取大鼠血清,按试剂盒说明书,ELISA 法检测血清炎症因子IL-6、IL-1β、IL-13 和TGF-β1 水平。
1.3 统计学分析
采用SPSS 25.0 软件分析数据,结果以平均值± 标准差(±s)表示,组间比较使用单因素方差分析,方差齐使用最小显著值法,方差不齐使用Dunnett’s T3 法,以P<0.05 表示有统计学意义。
2 结果
2.1 大鼠肺功能情况
与Control 组相比,COPD 组大鼠肺功能值显著降低(P<0.01)。 CKD 组大鼠肺功能呈降低趋势,但与Control 组相比无显著性差异。 COPD +CKD组大鼠肺功能显著低于Control 组(P<0.01),且FEV0.1及FEV0.1/FVC 显著低于COPD 组(P<0.01)。 见表1。
表1 大鼠肺功能情况(±s,n =8 ~10)Table 1 Pulmonary function of rats(±s,n =8 ~10)

表1 大鼠肺功能情况(±s,n =8 ~10)Table 1 Pulmonary function of rats(±s,n =8 ~10)
注:与Control 组相比,aaP <0.01;与COPD 组相比,bbP <0.01。 (下表同)Note. Compared with Control group,aaP <0.01. Compared with COPD group,bbP <0.01. (The same in the following tables)
组别Groups用力肺活量(mL)FVC(mL)第0.1 秒用力呼气容积(mL)FEV0.1(mL)FEV0.1/FVC(%)Control 组Control group8.19 ± 1.467.51 ± 1.0392.28 ± 3.79 COPD 组COPD group6.07 ± 0.44aa4.70 ± 0.14aa77.66 ± 5.13aa CKD 组CKD group8.05 ± 1.706.77 ± 1.0484.97 ± 5.14 COPD +CKD 组COPD +CKD group4.80 ± 0.71aa2.72 ± 0.76aabb57.36 ± 15.54aabb
2.2 大鼠肺组织病理变化
Control 组肺泡结构完整,大小均匀,气道管周存在少量炎性细胞。 COPD 组肺泡壁断裂,肺泡腔融合,出现肺大疱,肺泡腔内及气道管周炎性细胞浸润,结合肺功能情况说明成功构建COPD 大鼠模型。 CKD 组肺泡结构较完整,但与Control 组相比气道及肺泡内存在大量的炎性细胞。 COPD +CKD 组病理改变同COPD 组,且肺气肿、炎细胞浸润更明显,可见红细胞漏出。 见图1。

图1 大鼠肺组织病理Figure 1 Lung pathology of rats
2.3 大鼠肾功能情况
与Control 组相比,COPD 组大鼠血Cr 及24 h尿蛋白定量显著升高(P<0.05)。 CKD 组及COPD+CKD 组大鼠血Cr、BUN 及24 h 尿蛋白均显著高于Control 组(P<0.05),且COPD +CKD 组大鼠血Cr、BUN 及24 h 尿蛋白水平较COPD 组及CKD 组均显著升高(P<0.05)。 见表2。
表2 大鼠肾功能情况(±s,n =8 ~10)Table 2 Renal function of rats(±s,n =8 ~10)
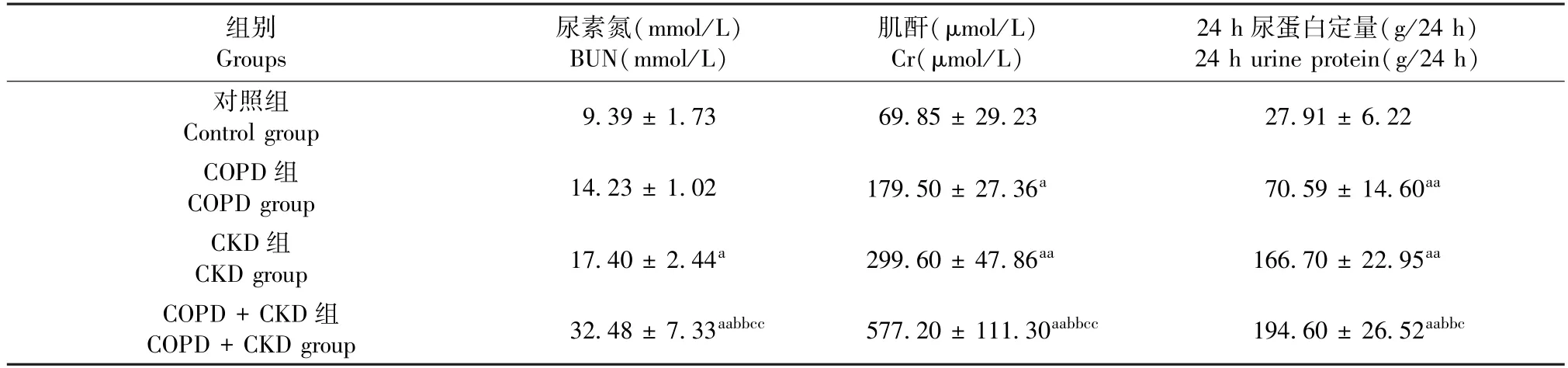
表2 大鼠肾功能情况(±s,n =8 ~10)Table 2 Renal function of rats(±s,n =8 ~10)
注:与Control 组相比,aP <0.05;与CKD 组相比,cP <0.05,ccP <0.01。 (下表同)Note. Compared with Control group,aP <0.05. Compared with the CKD group,cP <0.05,ccP <0.01. (The same in the following tables)
组别Groups尿素氮(mmol/L)BUN(mmol/L)肌酐(μmol/L)Cr(μmol/L)24 h 尿蛋白定量(g/24 h)24 h urine protein(g/24 h)对照组Control group9.39 ± 1.7369.85 ± 29.2327.91 ± 6.22 COPD 组COPD group14.23 ± 1.02179.50 ± 27.36a70.59 ± 14.60aa CKD 组CKD group17.40 ± 2.44a299.60 ± 47.86aa166.70 ± 22.95aa COPD +CKD 组COPD +CKD group32.48 ± 7.33aabbcc577.20 ± 111.30aabbcc194.60 ± 26.52aabbc
2.4 大鼠肾组织病理变化
Control 组肾小球、肾小管及肾间质未见明显异常。 CKD 组肾小球系膜增生,基底膜增厚,球囊腔扩张,肾小管细胞脱落坏死,管腔扩张,可见褐色结晶沉积,肾间质炎细胞浸润,纤维组织增生,结合肾功能表现说明CKD 大鼠模型构建成功。 COPD 组肾小球未见明显异常,肾小管上皮细胞排列紊乱,细胞肿胀,胞质染色不均,肾间质有纤维组织增生。COPD +CKD 组病理改变同CKD 组,可见更明显的肾小管扩张和间质纤维化。 见图2。

图2 大鼠肾组织病理Figure 2 Renal pathology of rats
2.5 大鼠肾组织超微结构改变
与Control 组相比,COPD 组大鼠肾小球足细胞部分足突融合,肾小管细胞间隙增大,线粒体脊减少。 CKD 组肾小球内皮细胞增生,毛细血管襻部分闭合,基底膜厚度不均,足细胞足突融合、微绒毛化,肾小管细胞破裂,线粒体融合崩解、脊模糊减少,溶酶体增多。 COPD +CKD 组超微结构改变同CKD 组,且肾小管细胞内出现脂滴沉积。 见图3。

图3 大鼠肾组织超微结构Figure 3 Renal ultrastructure of rats
2.6 大鼠血清炎症因子表达
如表3 所示,COPD 组、CKD 组及COPD +CKD组血清IL-6、IL-13 和IL-1β 水平均显著高于Control组(P<0.05)。 CKD 组及COPD +CKD 组血清TGF-β1 表达均较Control 组显著升高(P<0.01)。其中,COPD +CKD 组血清IL-6、IL-13、IL-1β 和TGF-β1 水平不仅高于COPD 组,也高于CKD 组(P<0.01)。
表3 大鼠血清炎症因子表达(±s,n =8 ~10)Table 3 Serum inflammatory factor expression of rats(±s,n =8 ~10)

表3 大鼠血清炎症因子表达(±s,n =8 ~10)Table 3 Serum inflammatory factor expression of rats(±s,n =8 ~10)
组别Groups白介素-6(pg/mL)IL-6(pg/mL)白介素-13(pg/mL)IL-13(pg/mL)白介素-1β(pg/mL)IL-1β(pg/mL)转化生长因子-β1(pg/mL)TGF-β1(pg/mL)对照组Control group63.06 ± 12.4722.80 ± 2.995.95 ± 3.704.62 ± 0.58 COPD 组COPD group103.40 ± 13.04aa35.32 ± 3.22a48.34 ± 20.82aa11.88 ± 1.69 CKD 组CKD group119.90 ± 10.93aa47.03 ± 3.45aa44.41 ± 15.42aa22.21 ± 7.83aa COPD +CKD 组COPD +CKD group176.30 ± 21.00aabbcc65.41 ± 15.61aabbcc91.58 ± 16.04aabbcc54.45 ± 8.98aabbcc
3 讨论
越来越多的研究表明,CKD 是COPD 的重要合并症之一,由于CKD 起病隐匿,早期常无明显临床症状,被发现时肾功能大多受损较重进入终末期,除肾替代治疗,尚无有效的措施以延缓肾功能恶化[10],CKD 在COPD 合并症医疗花费支出中排在首位,也加大了COPD 的死亡风险和治疗难度[11-12]。因此,建立COPD 合并CKD 大鼠模型,对阐释COPD 引发CKD 的分子机制,寻求新的治疗手段至关重要。
COPD 大鼠模型分为单因素及复合因素诱导[13],课题组前期建立的香烟暴露联合细菌鼻腔滴注的复合方法,可成功构建COPD 大鼠模型,较单因素诱导的COPD 模型更符合人类COPD 的病理生理特征,且造模时间更短[14]。 本研究采用COPD 诊断金标准的肺功能检测结合肺病理学观察发现COPD大鼠模型制备成功[15],且COPD +CKD 组肺功能指标FEV0.1、FEV0.1/FVC 显著低于COPD 组,肺组织肺气肿及炎细胞浸润更明显。
近年来研究报道单一COPD 模型即可引发肾损伤。 张伟等[16]以改良烟熏加气管滴注脂多糖法干预28 d 建立COPD 大鼠模型,发现COPD 组大鼠尿Cys-C 表达显著升高,肾病理表现可见肾小管上皮细胞肿胀,超微结构改变;Pabón 等[17]以单纯香烟暴露6 个月建立COPD 小鼠模型,发现慢性香烟暴露导致肾小球基底膜增厚、间质胶原沉积和肾小管细胞脂质沉积。 本研究结果与以上研究基本一致,COPD 组大鼠血Cr 及24 h 尿蛋白定量显著升高,肾小球部分足突融合,肾小管细胞肿胀,线粒体脊减少,肾间质胶原纤维增多。
CKD 的造模方法有手术干预、化学诱导等,考虑到手术操作死亡率较高、可用肾组织较少等因素,本研究采用腺嘌呤诱导建立CKD 大鼠模型[18]。肾功能指标Cr、BUN、24 h 尿蛋白定量在CKD 的临床诊断、疗效判定、动物模型构建中具有较为重要的地位[19]。 腺嘌呤可代谢生成难溶性的2,8-二羟基腺嘌呤,在肾小管中形成晶体,增加血清Cr 和BUN 水平,产生蛋白尿,并诱发肾小管萎缩和间质纤维化,这与CKD 患者的临床病理特征相似[20],因此腺嘌呤诱导法被广泛应用于探索CKD 发病机制和治疗靶点的研究[21]。 本研究结合肾功能及肾组织病理变化证实CKD 大鼠模型复制成功,同时COPD +CKD 组肾功能指标显著高于CKD 组,肾小管扩张及间质纤维化更明显,电镜结果显示肾小管细胞内出现脂滴沉积。 以上结果均证实COPD 合并CKD 大鼠模型制备成功。
研究表明多种病理生理机制促进COPD 与CKD 的关联性,其中炎性因子诱发的免疫炎症反应可能在COPD 合并CKD 中起到重要作用[22]。 气道上皮作为天然免疫的第一道防线,受各种外界环境刺激的影响。 香烟烟雾中的有害成分、细菌等可刺激巨噬细胞、中性粒细胞和T 细胞等多种免疫细胞高度活化,释放IL-6、IL-1β 等多种促炎细胞因子和趋化因子,不仅导致肺组织破坏,产生肺气肿、气流受限等肺内炎症表现[23],还可造成全身炎症状态,引发血管生成、内源性生长因子TGF-β 等释放、成纤维细胞募集,促进肾实质细胞损伤,诱导肾间质纤维化[24]。 据报道,CKD 患者体内IL-6、IL-13、IL-1β 及TGF-β 水平升高,且炎症状态的加重与肾功能下降呈正相关[25-28]。 同时,肾损伤后由于炎症介质的清除不足,又可进一步加重肺部疾病,研究报道CKD 小鼠肺组织炎细胞浸润,间质纤维化,氧化应激水平升高[29];肾缺血再灌注大鼠模型中,肺TNF-α 水平升高,诱发肺部炎症损伤,形成肺肾串扰的恶性循环[30]。 本研究结果发现COPD、CKD、COPD +CKD 组血清炎症因子水平均升高,联合组升高最为显著,高于单一模型组,这些结果进一步证实了炎症反应在COPD 合并CKD 中的关键作用。
综上,通过对大鼠肺肾功能及组织病理学的检测表明采用香烟烟雾暴露联合细菌感染合并2.5%腺嘌呤诱导的方法可成功构建COPD 合并CKD 的大鼠模型。 相较于单一模型,合并模型在肺、肾功能、组织形态学、炎症指标方面表现出明显的差异,说明两种造模方法联合可进一步促进疾病进展,与临床相符合,可应用于COPD 合并CKD 的基础研究。 但由于目前对该合并模型的相关研究尚不充分,有待进一步研究评估其稳定性和代表性。
