安替可胶囊联合TP 方案治疗晚期食管鳞癌的临床研究
2023-12-04程鹏赵阳杨红杰韩倩
程鹏,赵阳,杨红杰,韩倩
河南省人民医院 肿瘤中心,河南 郑州 450000
食管鳞癌是食管癌常见的病理类型,占食管癌患者90%以上,发病率呈上升趋势[1]。食管鳞癌早期无显著特征,多数患者确诊时已处于中晚期,丧失手术根治机会,病死率较高[2]。化疗是无法采用手术治疗患者有效的治疗手段,尤其是TP 方案(紫杉醇+顺铂),能有效抑制病情进展,延长患者生存期,提高患者生存质量,但化疗不良反应较大,部分患者因无法耐受而放弃治疗,整体疗效欠佳[3]。安替可胶囊由蟾皮、当归组成,具有软坚散结、解毒定痛、养血活血的功效,具有显著抗肿瘤作用[4]。本研究选取河南省人民医院收治的100 例术后复发转移、晚期转移无法手术治疗的晚期食管鳞癌患者,探讨安替可胶囊联合TP 方案的治疗效果,旨在探究中西药结合治疗食管鳞癌的优势。
1 资料与方法
1.1 一般资料
选取2019 年1 月—2022 年1 月河南省人民医院收治的100 例术后复发转移、晚期转移无法手术治疗的晚期食管鳞癌患者。其中男48 例,女52 例;年龄44~70 岁,平均(57.27±8.93)岁;体质量指数(BMI)18.9~26.2 kg/m2,平均(22.30±1.68)kg/m2;肿瘤位置:颈部13 例、胸部上段19 例、胸部中段39 例、胸部下段29 例;TNM 分期:Ⅲ期59例、Ⅳ期41 例;东部肿瘤协作组(ECOG)[5]评分0~2 分,平均(1.17±0.35)分。本研究符合《赫尔辛基宣言》中涉及医学试验的相关伦理原则,并经医院伦理委员会审批。
1.2 选例标准
诊断标准:符合美国国立综合癌症网络制定的食管癌诊断标准[6],经病理检查确诊为鳞癌;TNM分期Ⅲ、Ⅳ期。
纳入标准:患者不具备手术指征;预计生存期超过3 个月;具备化疗指征;对本研究相关药物无过敏反应;患者意识清晰、无精神疾病;ECOG 评分0~2 分;至少有1 处影像可测量病灶;患者或家属签署知情同意书。
排除标准:合并严重肝肾功能障碍者;合并免疫缺陷患者;合并其他肿瘤患者;凝血功能、全身感染疾病患者;参与本研究前接受其他抗肿瘤治疗者;伴有食管穿孔;明显出血倾向;伴有精神障碍。
剔除标准:被误纳入的病例;未遵医嘱用药导致资料记录不全者;出现其他危急症不能继续治疗者。
1.3 分组和治疗方法
将治疗方案装入信封进行隐藏并进行电子备份,信封由研究者统一管理。将所有患者随机分为对照组(50 例)和治疗组(50 例)。其中对照组男23 例,女27 例;年龄48~70 岁,平均(58.14±9.42)岁;BMI 20.4~26.2 kg/m2,平均(23.14±1.72)kg/m2;肿瘤位置:颈部6 例、胸部上段9 例、胸部中段20 例、胸部下段15 例;TNM 分期:Ⅲ期31 例、Ⅳ期19 例;ECOG 评分0~2 分,平均(1.21±0.35)分。治疗组男25 例,女25 例;年龄44~68 岁,平均(56.39±8.44)岁;BMI 18.9~25.7 kg/m2,平均(22.85±1.64)kg/m2;肿瘤位置:颈部7 例、胸部上段10 例、胸部中段19 例、胸部下段14 例;TNM 分期:Ⅲ期28 例、Ⅳ期22 例;ECOG评分0~2 分,平均(1.12±0.34)分。两组患者的性别、年龄、BMI、肿瘤位置、TNM 分期和ECOG评分比较差异无统计学意义,具有可比性。
两组均给予抗过敏、止吐、营养支持等常规干预。对照组第1 天静脉滴注紫杉醇注射液(Corden Pharma Latina S.P.A.,规格5 mL∶30 mg,产品批号23011111、20170316、20067587),135 mg/m2,第1~3 天静脉滴注顺铂注射液(广东岭南制药有限公司生产,规格10 mL∶10 mg,产品批号601230402、H10920028、H2004081),75 mg/m2。治疗组于对照组基础上口服安替可胶囊(长春雷允上药业有限公司生产,规格0.22 g/粒,产品批号017220601、617220901、017210801),2 粒/次,3 次/d。3 周为1 个治疗周期,两组患者持续治疗3 个周期。
1.4 临床疗效评价标准[7]
完全缓解:可见肿瘤完全消失,并维持1 个月;部分缓解:肿瘤长径减小≥30%,并维持1 个月;稳定:肿瘤长径减小<30%或增加<20%,无新病灶出现;进展:肿瘤长径增加≥20%或出现新病灶。
客观缓解率=(完全缓解例数+部分缓解例数)/总例数
疾病控制率=(完全缓解例数+部分缓解例数+稳定例数)/总例数
1.5 观察指标
1.5.1 生存质量 分别采用生活质量测定量表(QLQ-C30)、卡氏(KPS)评分评估治疗前后患者生存质量。QLQ-C30 包含社会功能、角色、认知、情绪、躯体,总评分为100 分[8]。KPS 评价患者体力情况,总评分为100 分[9]。QLQ-C30、KPS 评分与患者生存质量均呈正相关。
1.5.2 细胞免疫功能因子和血清肿瘤标志物 采集患者治疗前后静脉血5 mL,分成2 份血液标本。一份标本分离核细胞并进行染色,离心后去除上清液。使用FACSCanto II 流式细胞仪(美国BD 公司)和配套试剂盒检测患者治疗前后细胞免疫功能因子水平,包括淋巴细胞CD3+、CD4+、CD8+,并计算CD4+/CD8+。另一份采用离心机以转速3 500 r/min、离心半径10 cm 离心10 min,分离上层血清低温储存。使用Alinity c 全自动生化分析仪(美国雅培公司)以酶联免疫吸附法检测血清肿瘤标志物水平,包括鳞状细胞癌抗原(SCC-Ag)、细胞角蛋白19 片段(CYFRA21-1)、癌胚抗原(CEA)、糖类抗原125(CA125)。
1.6 不良反应观察
观察患者恶心/呕吐、白细胞下降、免疫抑制、消化道出血、骨髓抑制发生情况。
1.7 生存期观察
随访1 年,比较两组患者的生存期,包括中位生存期、肿瘤无进展时间。
1.8 统计学分析
采用SPSS 25.0 统计软件进行数据分析。计数资料以百分数表示,采用χ2检验;计量资料以表示,同组比较采用配对样本t检验;组间采用独立样本t检验。
2 结果
2.1 两组临床疗效比较
治疗后,治疗组客观缓解率(42.00%)、疾病控制率(74.00%)明显高于对照组(22.00%、52.00%),组间比较差异有显著性(P<0.05),见表1。

表1 两组总有效率比较Table 1 Comparison on total effective rates between two groups
2.2 两组生存质量比较
治疗后,两组QLQ-C30 评分、KPS 评分均显著升高(P<0.05),治疗组QLQ-C30 评分、KPS 评分显著高于对照组(P<0.05),见表2。
表2 两组QLQ-C30 评分、KPS 评分比较()Table 2 Comparison on QLQ-C30 scores and KPS scores between two groups ()
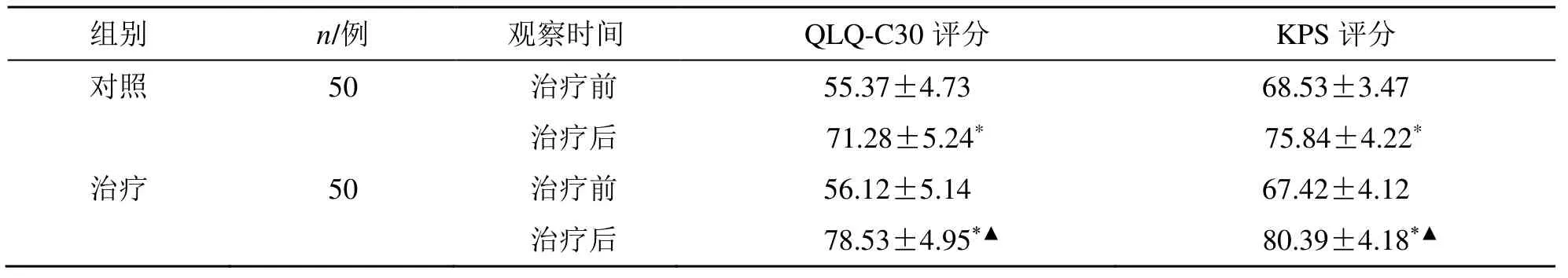
表2 两组QLQ-C30 评分、KPS 评分比较()Table 2 Comparison on QLQ-C30 scores and KPS scores between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.3 两组细胞免疫功能因子水平比较
治疗后,对照组CD3+、CD4+、CD4+/CD8+显著降低,CD8+显著升高(P<0.05);治疗组CD3+、CD4+、CD4+/CD8+明显高于对照组,CD8+低于对照组(P<0.05),见表3。
表3 两组CD3+、CD4+、CD8+、CD4+/CD8+比较()Table 3 Comparison on CD3+,CD4+,CD8+,and CD4+/CD8+ between two groups ()
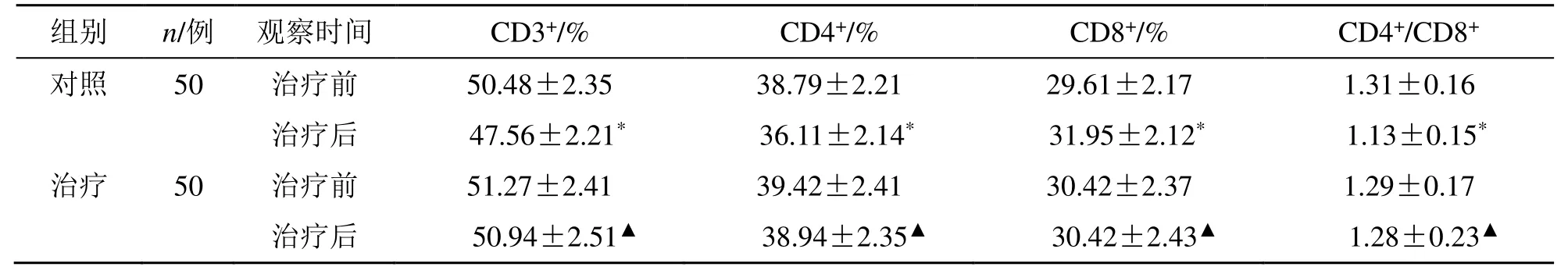
表3 两组CD3+、CD4+、CD8+、CD4+/CD8+比较()Table 3 Comparison on CD3+,CD4+,CD8+,and CD4+/CD8+ between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.4 两组血清肿瘤标志物水平比较
治疗后,两组血清SCC-Ag、CYFRA21-1、CEA、CA125 水平均显著降低(P<0.05),治疗组血清SCC-Ag、CYFRA21-1、CEA、CA125 水平显著低于对照组(P<0.05),见表4。
表4 两组血清SCC-Ag、CYFRA21-1、CEA、CA125 水平比较()Table 4 Comparison on serum levels of SCC-Ag,CYFRA21-1,CEA,and CA125 between two groups ()

表4 两组血清SCC-Ag、CYFRA21-1、CEA、CA125 水平比较()Table 4 Comparison on serum levels of SCC-Ag,CYFRA21-1,CEA,and CA125 between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.5 两组不良反应发生率比较
治疗组不良反应发生率为28.00%,明显低于对照组不良反应发生率48.00%,组间比较差异有显著性(P<0.05),见表5。
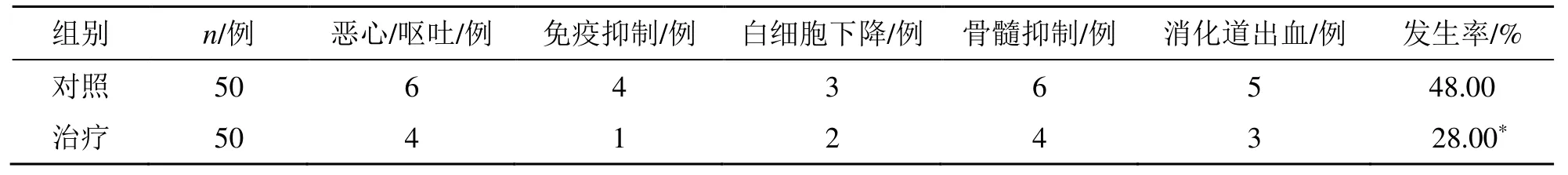
表5 两组不良反应发生率比较Table 5 Comparison on incidence of adverse reactions between two groups
2.6 两组生存期比较
随访1 年后,治疗组中位生存期、肿瘤无进展时间均明显长于对照组(P<0.05),见表6。
表6 两组生存期比较()Table 6 Comparison on survival time between two groups()

表6 两组生存期比较()Table 6 Comparison on survival time between two groups()
与对照组比较:*P<0.05*P <0.05 vs control group
3 讨论
食管鳞癌发病原因尚无统一定论,但临床认为主要与不良饮食习惯、病毒感染、生活环境、营养物质缺乏或强致癌物有关[10]。研究表明,食管鳞癌5 年存活率低于20%,是消化道预后最差的恶性肿瘤[11]。因此延长患者生存期、改善食管鳞癌患者预后是临床基本治疗原则。
TP 方案(紫杉醇+铂类)是无法手术晚期食管鳞癌患者最常用治疗手段,虽能够使患者受益,但在杀灭肿瘤细胞同时也会损伤机体正常组织,引起白细胞下降、消化道出血、骨髓抑制、免疫抑制等不良反应[12]。因此,降低化疗引起的不良反应是提高食管鳞癌疗效的关键。安替可胶囊是一种中药制剂,配合化疗治疗晚期上消化道恶性肿瘤能提高近期疗效,减轻不良反应,改善患者耐受性[13]。本研究结果显示,治疗组的客观缓解率、疾病控制率以及中位生存期、肿瘤无进展时间均显著高于对照组,生存质量评分高于对照组,不良反应发生率低于对照组,可见相较于单纯化疗,安替可胶囊联合TP 方案能提高近期疗效,减轻不良反应,延长患者生存期,改善患者生活质量。
肿瘤标志物能用于临床病情诊断,也能作为反映患者疗效和预后的指标。SCC-Ag、CYFRA21-1、CEA、CA125 是消化道肿瘤常见肿瘤标志物,其表达情况与肿瘤发生、进展密切相关[14-15]。SCC-Ag 是鳞癌特异性标志物,正常情况下血清表达水平较低,当食管鳞癌细胞增殖时,会导致血管屏障功能下降,引起血清SCC-Ag 处于升高状态[16]。CEA 是消化道肿瘤最早发现的免疫球蛋白,对食管癌早期诊断起着重要作用[17]。CA125 在多种恶性肿瘤细胞中异常表达,能辅助诊断病情[18]。CYFRA21-1 是食管癌外周血微转移的生物学标志,近年食管癌的诊断中应用较广泛[19]。本研究结果显示,治疗后,治疗组血清SCC-Ag、CYFRA21-1、CEA、CA125 水平明显低于对照组,提示安替可胶囊联合TP 方案治疗能增强抗肿瘤效果,抑制肿瘤标志物表达。
研究表明,食管癌的发生、进展与机体免疫功能相关[20-21]。患者免疫功能下降会减弱对肿瘤细胞的监视和抵御作用,导致肿瘤细胞增殖、转移。T 淋巴细胞亚群是机体细胞免疫的重要组成部分,通过细胞间相互协调、相互制约维持机体正常的免疫功能[22]。CD3+、CD4+、CD8+是常见淋巴细胞亚群,在免疫应答中通过不同机制增强T 细胞识别作用,进而发挥抗肿瘤作用;而CD4+/CD8+能反映机体的动态平衡,其水平与机体免疫功能呈正相关[22]。本研究结果显示,治疗后对照组 CD3+、CD4+、CD4+/CD8+显著降低,CD8+持续升高,治疗组CD3+、CD4+、CD8+、CD4+/CD8+明显高于对照组,CD8+低于对照组,提示相较于单独化疗,联合安替可胶囊能减轻免疫功能损伤。
综上所述,安替可胶囊联合TP 方案治疗晚期食管鳞癌能增强治疗效果,提高生活质量,减轻免疫功能抑制,降低肿瘤标志物水平,有助于延长患者生存期。
利益冲突所有作者均声明不存在利益冲突
