甲氨蝶呤联合度普利尤单抗治疗特应性皮炎的临床研究
2023-12-04陈岩松刘贝丽康亚兰
陈岩松,刘贝丽,康亚兰
福建医科大学附属南平第一医院 皮肤科,福建 南平 353000
特应性皮炎是一种慢性炎症性皮肤病,儿童中特应性皮炎患病率在10%~20%,成人中特应性皮炎患病率在2%~3%,临床主要表现为皮肤瘙痒、干燥、多形性皮损等症状,具有遗传倾向,易反复发作[1-2]。特应性皮炎病因复杂,目前尚无根治药物,临床主要以缓解症状为主[3]。特应性皮炎的传统治疗方案多样,但对中重度特应性皮炎治疗效果不甚理想,难以满足临床需求[4]。随着医疗技术的飞速发展,生物制剂已开始用于特应性皮炎的治疗,2017年3 月美国食品药品管理局批准白细胞介素-4(IL-4)受体拮抗剂度普利尤单抗为首个治疗特应性皮炎的生物制剂,该药2020 年已于我国上市。
度普利尤单抗属于单克隆免疫球蛋白G4(IgG4)抗体,可通过特异性结合IL-4Rα 亚基,抑制IL-4 信号传递介导的炎症反应,进而改善特应性皮炎患者临床症状。目前有关度普利尤单抗治疗特应性皮炎的研究虽多集中于北美、欧洲国家[5-6],但我国有关临床数据也显示出度普利尤单抗治疗特应性皮炎的高效性及安全性[7-8]。甲氨蝶呤属于临床常用的免疫抑制剂,具有减少炎性T 细胞增殖的作用,近期研究显示,甲氨蝶呤在治疗中重度儿童特应性皮炎方面具有一定优势[9]。基于既往研究,甲氨蝶呤联合度普利尤单抗治疗特应性皮炎能提升治疗疗效,但目前尚缺乏相关临床数据报道,鉴于此,本研究特针对该问题开展了研究,以便为临床治疗特应性皮炎提供参考。
1 资料与方法
1.1 一般临床资料
选取2021 年3 月—2022 年3 月福建医科大学附属南平第一医院收治的76 例特应性皮炎患者为研究对象,其中男43 例,女33 例;年龄18~60 岁,平均年龄(40.97±7.95)岁;病程7~19 个月,平均病程(13.31±2.08)个月;合并哮喘21 例,合并过敏性鼻炎18 例,合并过敏性结膜炎12 例;糖皮质激素治疗史62 例,钙调磷酸酶抑制剂治疗史52 例,紫外线疗法治疗史45 例,抗组胺药治疗史65 例。
诊断标准:符合《中国特应性皮炎诊疗指南》中特应性皮炎诊断标准[10],以湿疹样皮疹及皮肤瘙痒、干燥为主要特征,反复发作,呈慢性过程,皮疹常见于头面部,也可发展至躯干、四肢。
纳入标准:(1)符合特应性皮炎诊断标准;(2)年龄≥18 岁;(3)入组前4 周没有接受系统治疗;(4)近6 个月来对常规药物治疗反应不佳或不耐受者;(5)对本研究知情同意。
排除标准:(1)失访者;(2)伴重要脏器功能障碍、恶性肿瘤、凝血功能异常;(3)伴活动性感染;(4)合并其他皮肤疾病;(5)妊娠、哺乳者;(6)对治疗药物过敏。
1.2 药物
度普利尤单抗注射液由 Sanofi Winthrop Industrie 生产,规格300 mg(2.0 mL)/支,产品批号20 220004;甲氨蝶呤片由通化茂祥制药有限公司生产,规格2.5 mg/片,产品批号200901、210204、220303。
1.3 分组及治疗方法
随机数字表法将患者分为对照组和治疗组,每组各38 例。其中对照组男20 例,女18 例;年龄18~60 岁,平均年龄(41.25±8.03)岁;病程8~19 个月,平均病程(13.75±2.13)个月;合并哮喘12 例,合并过敏性鼻炎8 例,合并过敏性结膜炎5例;糖皮质激素治疗史32 例,钙调磷酸酶抑制剂治疗史28 例,紫外线疗法治疗史21 例,抗组胺药治疗史34 例。治疗组男23 例,女15 例;年龄18~60 岁,平均年龄(40.69±7.87)岁;病程7~18 个月,平均病程(12.86±1.99)个月;合并哮喘9 例,合并过敏性鼻炎10 例,合并过敏性结膜炎7 例;糖皮质激素治疗史30 例,钙调磷酸酶抑制剂治疗史24 例,紫外线疗法治疗史24 例,抗组胺药治疗史31 例。两组一般资料对比差异无统计学意义,具有可比性。
对照组患者皮下注射度普利尤单抗注射液,首周1 次,600 mg/次,然后每2 周注射300 mg;治疗组在对照组基础上口服甲氨蝶呤片,5 mg/次,1 次/周,然后2 次/周,2.5 mg/次,间隔12 h,口服甲氨蝶呤片24 h 后口服叶酸10 mg。两组持续治疗16 周评价效果。
1.4 疗效评价标准
参照《中国特应性皮炎诊疗指南》[10],根据湿疹面积及严重程度指数(EASI)评分[11]情况评价治疗后(持续治疗16 周)效果。治愈:瘙痒、皮疹等症状消失,EASI 评分较治疗前下降≥90%;显效:瘙痒、皮疹等症状明显减轻,75%≤EASI 评分较治疗前下降<90%;有效;瘙痒、皮疹等症状减轻,50%≤EASI评分较治疗前下降<75%;无效:瘙痒、皮疹等症状未明显减轻或恶化,EASI 评分较治疗前下降<50%。
总有效率=(痊愈例数+显效例数+有效例数)例数/总例数
1.5 观察指标
1.5.1 症状评分情况 治疗前后用EASI 评分[11]、研究者整体评分(IGA)[12]、特应性皮炎积分指数(SCORAD)评分[13]评价患者病情严重程度:EASI评分包含头颈、躯干、上肢、下肢,各部分按受累面积评分,再按照不同表现计算各部位皮损严重程度,最后将4 部分评分相加为总分;IGA 评分包括0~4 分,0 分:无皮疹,1 分:几乎无皮疹,2 分:轻度皮疹,3 分:中度皮疹,4 分:重度皮疹;SCORAD评分包括皮损面积、皮损严重程度及主观症状评分。
总分=皮损面积评分/5+7×严重程度评分/2+主观症状评分
1.5.2 外周血炎症有关因子变化 治疗前后抽取空腹静脉血5 mL,离心收集血清,采用流式细胞术测定IL-4、IL-6、干扰素-γ(IFN-γ)水平;试剂盒购自江西赛基生物技术有限公司。
1.5.3 外周血嗜酸性粒细胞(EOS)、IgE 变化情况 分别于治疗前后抽取患者空腹静脉血液5 mL,采用全自动血细胞计数分析仪(日本希森美康有限公司,XN-9000 型)测定EOS 水平,采用化学发光法测定总IgE 水平,试剂盒购自深圳新产业有限公司,MAGLUMI X8-Ⅱ型。
1.5.4 生活质量变化情况 治疗前后采用皮肤病生活质量指数(DLQI)[14]评分评价患者生活质量,DLQI 评分包含10 个项目,每个项目0~3 分,分数越低提示生活质量越佳。
1.6 不良反应观察
统计治疗期间两组患者发热、荨麻疹、结膜炎、注射部位反应、胃肠道不良反应等不良事件的发生情况。
1.7 统计学方法
2 结果
2.1 两组临床疗效比较
治疗后,治疗组临床有效率明显高于对照组(97.37%vs81.58%,P<0.05),见表1。

表1 两组临床疗效比较Table 1 Comparison on clinical efficacy between two groups
2.2 两组病情变化比较
治疗后,两组EASI 评分、IGA 评分、SCORAD评分均明显低于治疗前(P<0.05),且治疗组评分明显低于对照组(P<0.05),见表2。
表2 两组病情结果比较()Table 2 Comparison on the results of disease changes between two groups ()
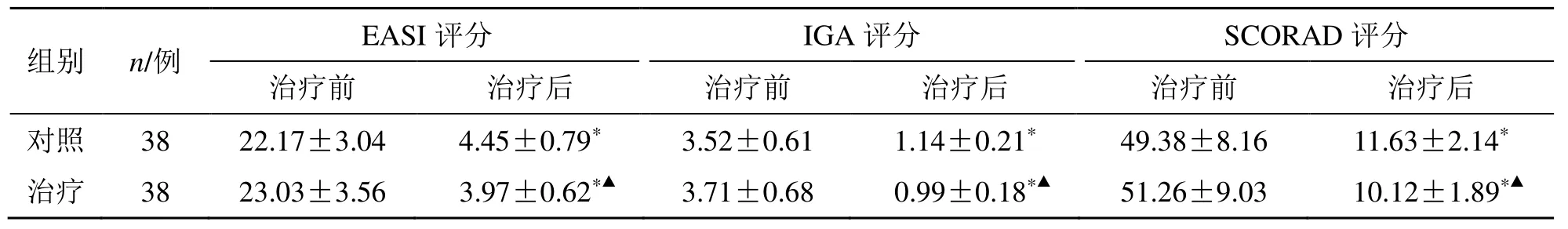
表2 两组病情结果比较()Table 2 Comparison on the results of disease changes between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.3 两组外周血炎症因子比较
治疗后,两组IL-4、IL-6 水平明显降低,而IFN-γ水平升高(P<0.05);且治疗组治疗后IL-4、IL-6 比对照组更低,IFN-γ 更高(P<0.05),见表3。
表3 两组外周血炎症因子比较()Table 3 Comparison on inflammatory factors in peripheral blood between two groups ()

表3 两组外周血炎症因子比较()Table 3 Comparison on inflammatory factors in peripheral blood between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.4 两组外周血EOS 和IgE 比较
治疗后,两组EOS、IgE 水平明显降低(P<0.05),且治疗组比对照组更低(P<0.05),见表4。
表4 两组EOS 和IgE 比较()Table 4 Comparison on EOS and IgE between two groups ()

表4 两组EOS 和IgE 比较()Table 4 Comparison on EOS and IgE between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.5 两组生活质量比较
治疗后,两组DLQI 评分均低于治疗前(P<0.05),且治疗组治疗后DLQI 评分明显低于对照组(P<0.05),见表5。
表5 两组生活质量比较()Table 5 Comparison on quality of life between two groups()
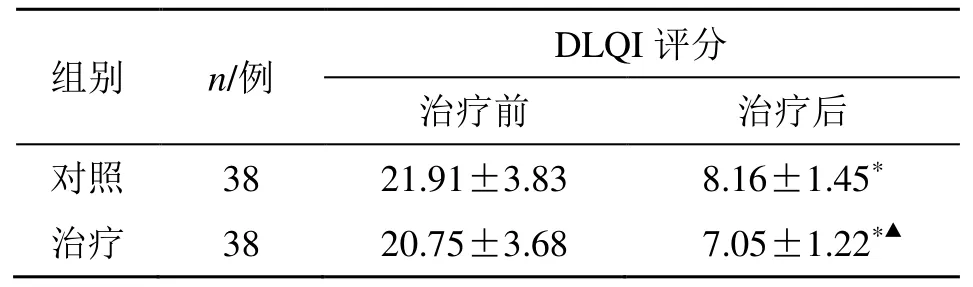
表5 两组生活质量比较()Table 5 Comparison on quality of life between two groups()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.6 两组不良反应比较
治疗期间,对照组出现1 例结膜炎,治疗组出现1 例结膜炎、1 例胃肠道不良反应,两组总不良反应发生率对比差异无统计学意义。
3 讨论
皮肤屏障功能及免疫调节异常是导致特应性皮炎发生的重要原因,皮肤屏障先天缺陷/后天损伤易使过敏原及微生物入侵体内,进而激活局部免疫炎症反应,角质形成细胞等可在炎症反应起始时期产生炎症介质,进一步促进Th2 细胞活化产生IL-4 等2 型炎症因子,参与2 型炎症反应过程,并通过抑制终末分化蛋白合成进一步损害皮肤屏障功能[15]。度普利尤单抗可通过抑制IL-4/13 受体的共同亚基阻断其参与的炎症反应通路。甲氨蝶呤是一种叶酸还原酶抑制剂,在抑制炎症疾病方面有一定效果。甲氨蝶呤联合度普利尤单抗治疗特应性皮炎是否可进一步增强治疗效果值得探讨。
本研究显示,甲氨蝶呤联合度普利尤单抗治疗特应性皮炎可提升治疗效果、减轻患者病情。度普利尤单抗可通过抑制IL-4/13 受体的共同亚基阻断其参与的炎症反应通路,进而抑制促炎细胞因子、趋化因子、IgE 等细胞因子的释放,从而抑制特应性皮炎病情发展[16]。目前甲氨蝶呤多被用于血液疾病与肿瘤的治疗,可通过介导二氢叶酸的还原反应阻断其合成四氢叶酸,并阻滞嘌呤核苷酸、嘧啶脱氧核苷酸合成,从而阻滞炎性T 细胞增殖,活化的过敏原特异性T 细胞的选择性丧失可能缓解特应性皮炎的临床症状[17]。甲氨蝶呤联合度普利尤单抗可协同发挥抗炎作用,进而增强特应性皮炎患者的治疗疗效。苏斌等[9]研究指出,甲氨蝶呤是治疗中重度儿童特应性皮炎的安全、有效药物。
Th2 相关细胞因子过量表达为特应性皮炎的典型免疫学特征,IL-4 主要由Th2 细胞产生,IL-4 能够通过刺激次级淋巴器官中CD4+Th2 细胞群增殖放大级联炎症反应,并促进Th2 细胞分化抑制聚丝蛋白分化及抗菌肽合成,进而抑制特应性皮炎患者表皮脂质合成、诱导其表皮增生及水肿等途径促进特应性皮炎发生、病情进展[18]。IL-6 是一种重要的促炎细胞因子,可促进先天和获得性免疫反应,导致特应性皮炎疾病发展。IFN-γ 是Th1 细胞的重要标志性因子,其浓度降低提示特应性皮炎患者外周血Th1 细胞免疫活性处于抑制状态。本研究显示甲氨蝶呤联合度普利尤单抗治疗特应性皮炎可改善炎性相关细胞因子IL-4、IL-6、IFN-γ 水平,其增强治疗疗效可能与该变化机制有关。Koh 等[19]研究指出,抑制特应性皮炎患者体内IL-4 合成有助于缓解患者临床症状。本研究显示治疗组治疗后EOS、IgE 低于对照组,说明氨蝶呤联合度普利尤单抗治疗特应性皮炎可抑制EOS、IgE 合成,进而阻断EOS、IgE介导的致敏原传递特异性T 细胞信号通路,抑制患者炎性反应发生,进而提升治疗效果。Puar 等[20]研究指出,特应性皮炎患者EOS、IgE 水平降低可抑制体内炎性反应。两组治疗后DLQI 评分均低于治疗前,治疗组治疗后评分更低,提示甲氨蝶呤联合度普利尤单抗治疗特应性皮炎可提升生活质量,推测可能与治疗效果更佳、临床症状缓解更为明显有关。对照组治疗期间有1 例结膜炎,治疗组有1 例结膜炎、1 例胃肠道不良反应,不良反应症状轻微,对症治疗后可自行缓解,安全可靠。
综上所述,甲氨蝶呤联合度普利尤单抗治疗特应性皮炎可提高临床疗效,减轻患者病情,改善炎症相关因子合成,降低EOS、IgE 水平,提高患者生活质量,且药物安全性良好,具有临床推广价值。本研究样本量有限,目前仍在随访中,关于其治疗效果及安全性数据等有待进一步分析。
利益冲突所有作者均声明不存在利益冲突
