MSCT、MRI及血清肿瘤标志物在卵巢卵黄囊瘤诊断中的应用价值*
2023-12-03林生发赵大聪彭昌勇刘一江
蒲 烨 林生发 赵大聪 彭昌勇 刘一江
1.达州市中西医结合医院影像中心 (四川 达州 635000)
2.福建省立医院放射科 (福建 福州 350013)
卵巢卵黄囊瘤又称内胚层窦瘤,约占卵巢恶性肿瘤的1%,是一种原始的恶性生殖细胞瘤(14%-20%),好发于年轻女性(10-30岁),其次为10岁前和30-40岁,偶尔也见于绝经后的妇女[1]。卵黄囊瘤恶性程度较高,预后差,现阶段临床的标准治疗方案为手术联合化疗,对于对侧卵巢和子宫肿瘤未累及且有生育需求的患者可行保留生育功能的手术治疗[2]。随着联合化疗的使用,生存率已经得到大幅提高。王卡娜等[3]对42例卵巢恶性生殖细胞肿瘤的临床病例资料进行回顾性分析研究,结果显示2年生存率为97.5%,5年生存率为88.2%。因此,早发现、早诊断、早治疗对卵黄囊瘤患者的治疗方案及预后情况均显得尤为重要,但卵黄囊瘤患者临床常见症状有腹痛、腹胀、腹部肿块或腹部增大等,无特异性。部分患者血清肿瘤标志物可作为卵巢肿瘤性病变较理想的标志物,对卵巢病变的诊断及鉴别诊断具有重要的筛查意义[4]。影像学检查表现可为完全实性、囊实性或囊性为主[5],但目前多为病例报道,缺乏大样本分析研究,缺乏影像学检查与血清实验室检查指标的联合分析比较研究。基于此,本研究旨在探讨多层螺旋计算机断层扫描(MSCT)、核磁共振成像(MRI)及血清肿瘤标志物在卵巢卵黄囊瘤诊断中的应用价值,特别是尝试建立一套量化方法及规则,把MSCT、MRI的征象描述转化可进行比较分析的数值资料,以期在术前明确病变的良恶性和累及范围,掌握关键的影像学及血清肿瘤标志物特征,进而帮助我们与其他卵巢恶性肿瘤进行特异性的诊断或缩小鉴别诊断。
1 资料与方法
1.1 一般资料收集2019年1月至2022年3月在达州市中西医结合医院经手术病理证实的卵巢卵黄囊瘤的患者93例作为研究对象(研究组),所有患者均为女性,年龄6-67岁,平均(20.49±8.20)岁。另选取同时期内年龄范围相同且经病理证实为其他类型卵巢肿瘤的患者88例(对照组),所有患者均为女性,平均年龄(21.24±8.73)岁,其中浆液或粘液性囊腺癌34例,卵巢癌17例,无性细胞瘤12例,未成熟畸胎瘤11例,间质细胞瘤8例,硬化性间质瘤6例。
纳入标准:患者既往未接受任何治疗;经手术病理证实为卵巢卵黄囊瘤;有完整的CT、MRI及血清实验室检查资料;无其他系统肿瘤病史者。排除标准:具有碘过敏或幽闭恐惧症等致使患者检查不完善者;疾病处于急性发作期(如破裂出血、合并肠梗阻等)的患者。
1.2 MSCT检查采用德国Siemens双源CT(SOMATOM Definition)进行扫描,所有患者均行全腹部CT平扫+增强检查,在检查前嘱患者饮水1000mL左右,在患者有尿意时进行检查。扫描参数:管电压120kV,管电压200mAs,层厚5mm,层间距5mm,矩阵512×512,螺距0.891。增强使用对比剂为非离子型碘海醇(350mgI/mL),在平扫结束后采用智能追踪技术进行动脉期、静脉期(动脉期后30s)和延迟期(动脉期后90s)扫描,注射流速为3-4mL/s,剂量为1.5mL/kg,经静脉注射完毕后追加20mL生理盐水。最后将图像传输至后处理工作站进行重建。
1.3 MRI检查采用德国Siemens Avanto 1.5 T超导型MRI机器进行扫描,线圈为8通道表面线圈,所有患者均行MRI平扫+增强+DWI检查。增强采用对比剂为Gd-DTPA,剂量为0.1mmol/kg。平扫参数:T1WI:TR 680ms,TE 10.0ms,层厚5mm,矩阵480×256,FOV 24cm。T2WI:TR 4000ms,TE 85ms,层厚4mm,矩阵480×256,FOV 24cm。DWI:TR 4800ms,TE 95ms,层厚4mm,b值为800s/mm2。增强扫描:T1-VIBE-TRA,TR 4.25ms,TE 1.5ms,层厚3mm,矩阵480×256,FOV 24cm。
1.4 血清肿瘤标志物检查所有患者均在入院后次日清晨8点空腹抽取5mL静脉血,离心20min,取上清液,置于零下20℃环境中保存。采用甲胎蛋白(AFP)、糖类抗原125(CA125)、糖类抗原199(CA199)、癌胚抗原(CEA)试剂盒(购于罗氏诊断产品(上海)有限公司),血清分析检测仪采用罗氏E602型全自动免疫分析仪检测AFP、CA125、CA199、CEA水平,其阳性标准为AFP>7.3ng/L,CA125>35U/mL,CA199>27U/mL,CEA>3.4ng/L。
1.5 图像分析CT和MRI图像由2位具有8年以上腹部诊断工作经验的影像学医师进行分析,意见不一致时协商解决。主要观察肿瘤影像征象有:病灶部位、大小、形态、最大径、边界、囊实性、强化方式、强化程度(0-10HU无强化,10-20HU轻度强化,20-40HU中度强化,40以上为明显强化)、有无合并腹水、有无淋巴结转移。
1.6 统计学方法使用SPSS 26.0进行研究资料分析。研究资料中的计量数据,以()描述,两组间的比较为成组t检验或校正t'检验(统计量为t)。诊断评估价值分析为接收者工作特征(ROC)曲线分析,其中多指标联合应用采用非条件Logistic回归,建立回归风险诊断模型,以其Log(P/1-P)参量为联合应用的诊断指标。统计检验水准α=0.05,均为双侧检验。
2 结果
2.1 两组血清肿瘤标志物水平比较如表1所示,研究组患者的血清AFP水平明显高于对照组,血清CA125水平明显低于对照组,差异有统计学意义(P<0.05)。对照组和研究组患者的血清CA199和CEA水平比较,差异无统计学意义(P>0.05)。

表1 两组患者血清肿瘤标志物水平比较
2.2 卵巢卵黄囊瘤MSCT、MRI表现93例卵巢卵黄囊瘤患者中85例为单侧发病,8例为双侧发病。肿瘤大小为(3.48-22.61)cm,平均(12.84±3.52)cm。63例表现为椭圆形,30例形态不规则。6例为完全实性肿块,11例为囊性为主肿块,其余76例表现为混合囊实性肿块。27例可见出血,CT表现为高密度,MRI呈表现T1WI高/低、T2WI高/低信号。3例CT上可见高密度钙化灶,MRI上表现为T1WI、T2WI低信号。79例可见腹腔、盆腔积液征象。58例可见腹膜转移或淋巴结转移。CT和MRI增强后均可见病灶边缘明显强化,其余实性和囊实性肿块均表现为中度以上强化;此外,在47例强化的实性病灶中可见肿瘤内增粗血管。
结合以上患者的卵巢卵黄囊瘤MSCT、MRI表现,将MSCT、MRI征象/表现进行对应的量化。如表2所示,按此量化规则,MSCT、MRI征象细分为8个分项指标,每个分项指标量化值为1(即阳性发现=1,未发现记为0)。如此,各检查者的MSCT、MRI征象量化最高分为8分,最低分为0分。按此量化规则和计分方法,本研究93例卵巢卵黄囊瘤的患者的MSCT、MRI征象量化分均值分别为5.5±0.7、6.7±0.5。88例对照组患者的MSCT、MRI征象量化分均值分别为2.2±0.5,1.6±0.4。
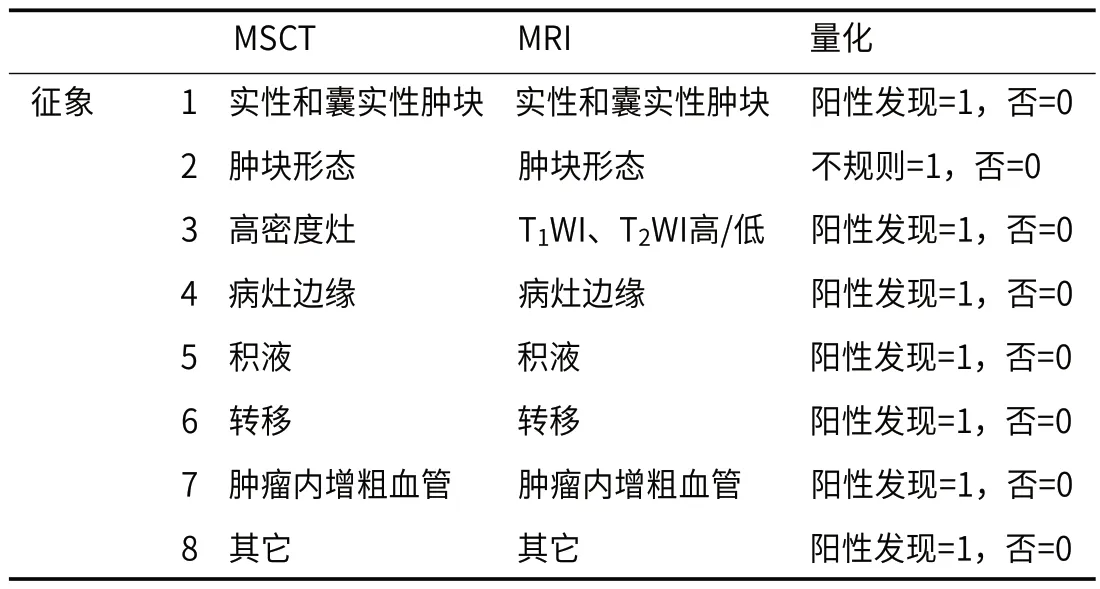
表2 MSCT、MRI征象表现的量化
2.3 MSCT、MRI征象及血清肿瘤标志物及对卵巢卵黄囊瘤的诊断效能分析进一步探讨MSCT、MRI征象及血清肿瘤标志物(AFP、CA125、CA199、CEA)对卵巢卵黄囊瘤的诊断效能:以研究组为阳性样本(n=93),以对照组为阴性样本(n=88),建立ROC诊断分析模型。以是否卵巢卵黄囊瘤为因变量,以MSCT、MRI征象及血清肿瘤标志物AFP、CA125、CA199、CEA为自变量,建立Logistic风险预测模型,如表3所示。在该模型中,CA199和CEA均无显著性意义(P>0.05),给予淘汰(亦将其从单独应用中淘汰),最终获该模型的Log(P/1-P)=0.074×MSCT +0.098×MRI+0.033×AFP -0.078×CA125(去常数项),以其为联合应用的虚拟概率量指标,再行ROC分析。
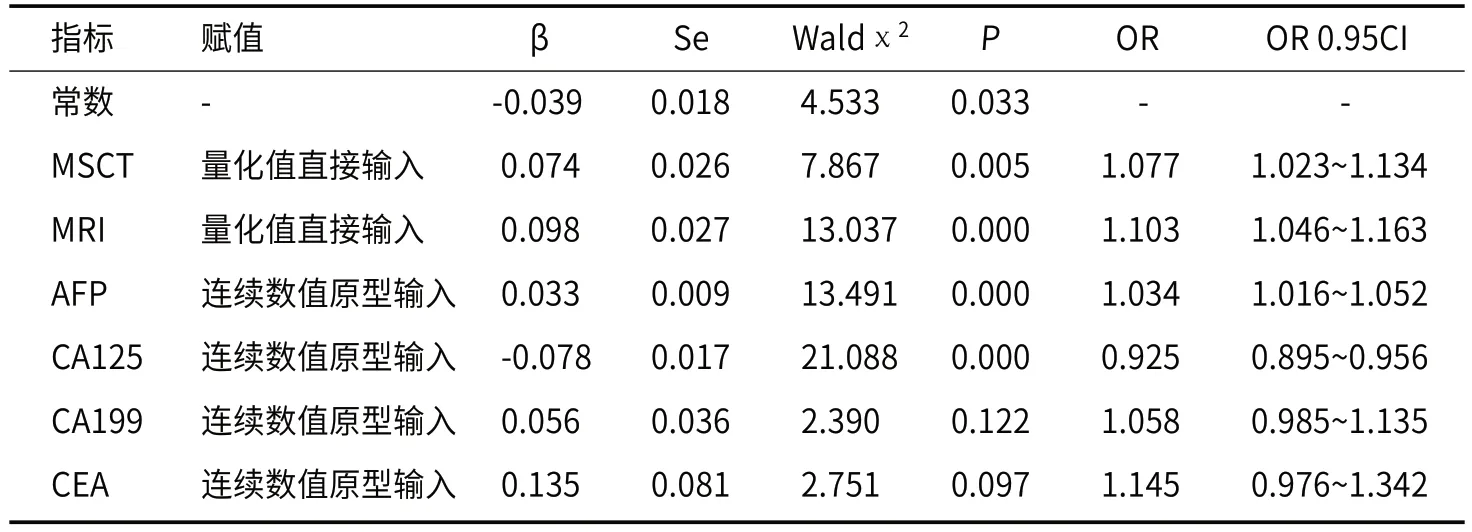
表3 MSCT、MRI征象及血清肿瘤标志物联合应用的Logistic风险评估诊断模型分析结果
如表4和图1所示:MSCT、MRI征象、AFP、CA125单独及联合应用时,曲线下面积(AUC)分别为0.705、0.748、0.723、0.759、0.878,其中联合应用对卵巢卵黄囊瘤诊断效能较高。
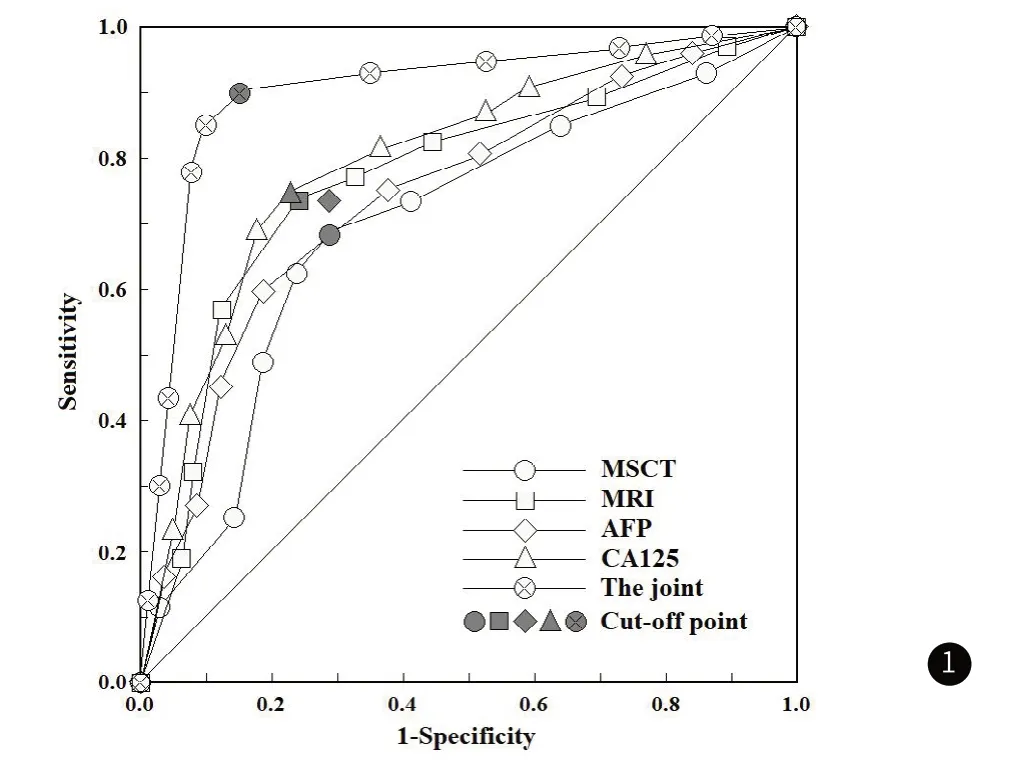
图1 MSCT、MRI征象及血清肿瘤标志物单独及联合应用的诊断价值分析之ROC曲线
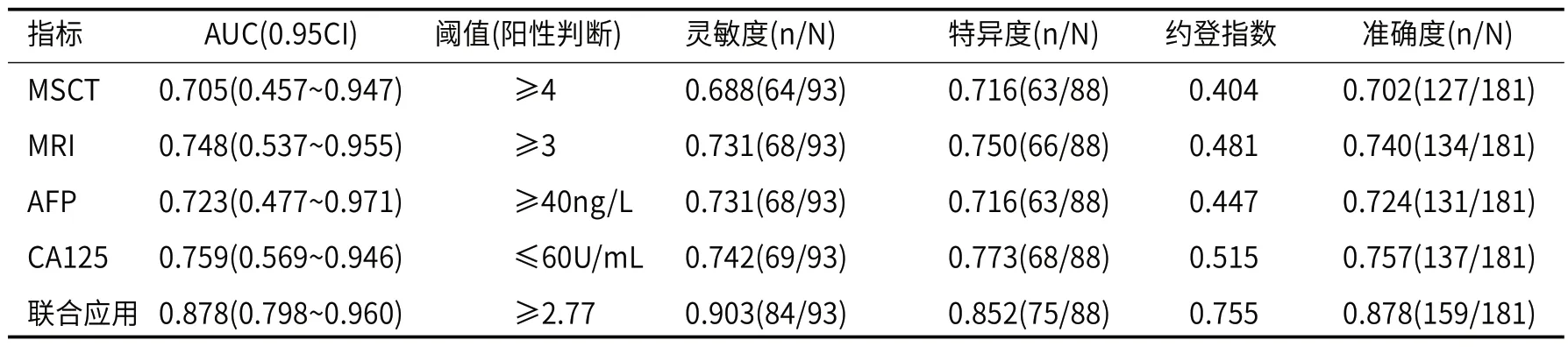
表4 MSCT、MRI征象及血清肿瘤标志物单独及联合应用的诊断价值分析结果
2.4 典型病例(见图2-4)
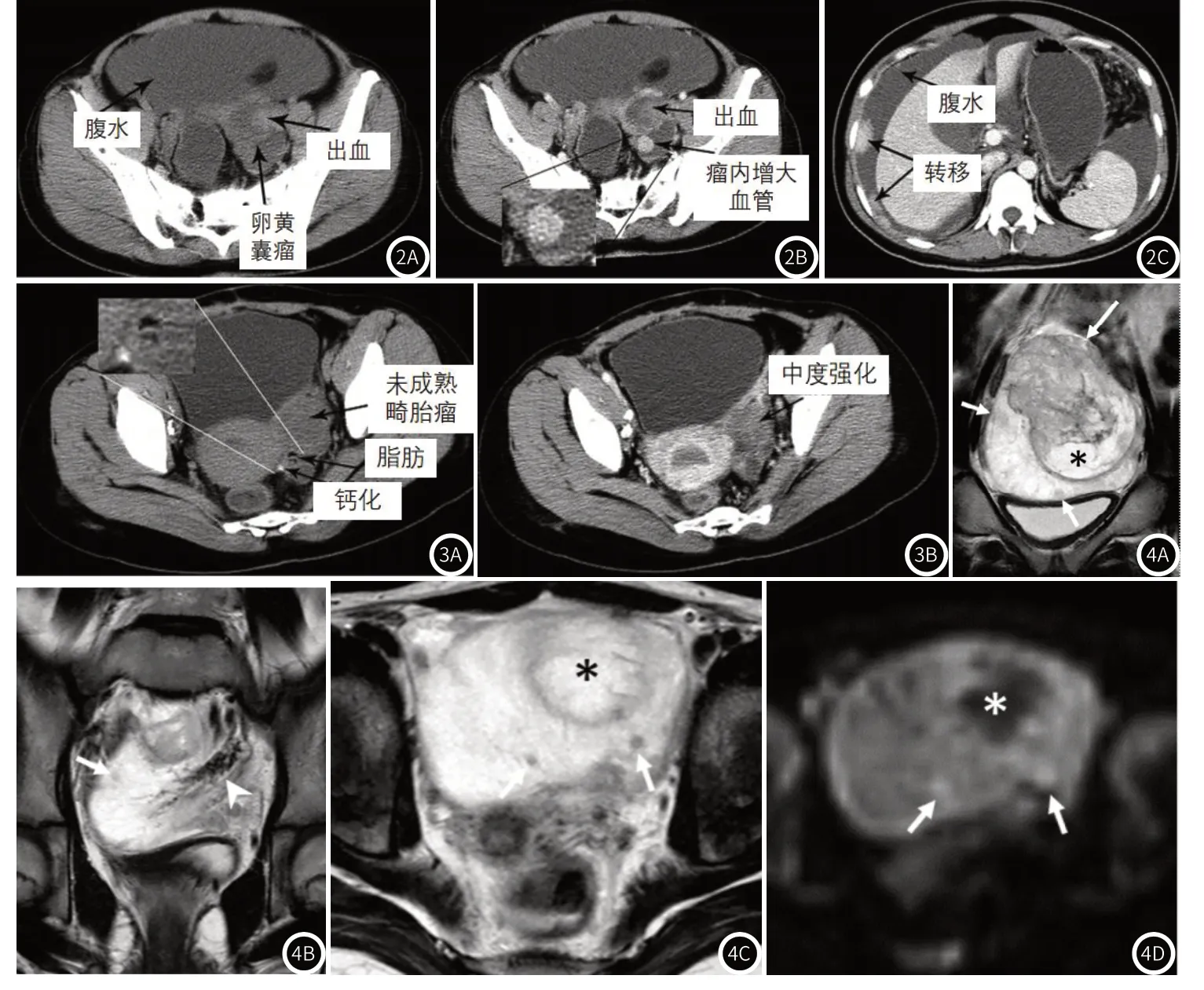
图2A-图2C 卵巢卵黄囊瘤患者的影像图片;患者21岁,女性,病理诊断为卵巢卵黄囊瘤。图2A:CT平扫显示囊实性肿块及病灶内高密度灶,同时可见大量腹水(黑色箭头)。图2B:增强可见病灶内高密度影未见强化,提示为出血(黑色箭头);同时可见肿瘤呈不均匀明显增强,瘤内血管增大(黑色箭头)。图2C:多发腹膜转移灶,病灶明显强化,并见大量腹水(黑色箭头)。图3A-图3B 未成熟畸胎瘤患者的影像图片;患者14岁,女性,病理诊断为未成熟畸胎瘤。图3A:CT平扫显示盆腔内一不规则形囊实性肿块,肿瘤内可见脂肪组织和钙化灶,未见腹水和转移征象。图3B:增强可见病灶呈中度强化,强化程度不如卵巢卵黄囊瘤,未见瘤内血管增大。图4A-图4D 卵巢卵黄囊瘤患者的影像图片;患者10岁,女性,病理诊断为卵巢卵黄囊瘤。图4A:两张冠状位T2加权成像显示左侧卵巢肿块,轮廓光滑;肿块呈高信号,可见较大不均匀肿块(长箭头)伴坏死(星号)和多个小结节(短箭头),即提示肿瘤的多样性;另可见扩张血管(箭头)。图4B:轴位T2加权成像显示在高信号肿块内有多个中等信号的小结节(箭头)和坏死(星号)。图4C:在高b值上(1000s/mm2),多个小结节显示呈高信号弥散受限(箭头)和低信号无弥散受限的坏死区(星号)。
3 讨论
卵黄囊瘤是一种罕见的肿瘤,是卵巢第三大最常见的生殖细胞恶性肿瘤,恶性程度较高,生长迅速,早期易发生转移,在采取有效的联合化疗之前,预后不佳[6-7]。卵黄囊瘤起源于生殖细胞而不是上皮细胞,因此病灶倾向于以膨胀性的向心方式生长,并对周围的组织结构产生质量效应,即邻近的器官通常被推移而不是浸润,常可出现腹腔、大网膜、盆腔等种植转移以及腹水和淋巴结转移等[8]。因此早诊断、早治疗及术前对肿瘤病灶的准确定性诊断和病灶范围评估等对患者具有重要的临床意义。
本研究结果显示,MSCT、MRI、AFP、CA125联合应用对卵巢卵黄囊瘤具有较高的诊断价值。卵黄囊瘤多以囊实性成分为主,CT平扫时实性部分呈等密度,增强后病灶明显强化,病灶内可见囊性、出血或坏死等无强化区,提示病灶的异质性和富血供[9]。多数卵黄囊瘤呈椭圆形,且病灶较大,边界清晰,这与肿瘤起源于生殖细胞而不是上皮细胞有关,这类肿瘤更倾向于膨胀性的向心性生长,从而对周围组织结构产生推移而不是浸润[10]。CT的优势在于可以显示病灶内的出血,出血的产生常常是由于肿瘤的高血管增生或肿瘤较大引起,表明肿瘤内出血性内容物很活跃。Choi等[11]研究显示,“亮点征”可用来描述卵黄囊瘤内大量的瘤内血管,被认为是卵黄囊瘤独特的CT征象。卵黄囊瘤病灶内血管通常有管腔扩张并明显增强,这一经典的影像学发现被认为是肿瘤中血供增加和小血管动脉瘤形成的结果[12]。卵黄囊瘤瘤内出血和明显强化可能对提高卵黄囊瘤的影像学诊断具有较准确的应用价值,并可能有助于区分卵黄囊瘤与其他卵巢肿瘤[13]。但CT对亚急性期和慢性期出血或小出血灶的检测具有局限性,此外对液化出血引起的肿瘤坏死或囊变的鉴别诊断也较困难。而MRI则可提供肿瘤内病灶信号的特点,弥补CT上不能诊断的局限性,作为补充信息,提高鉴别诊断。Elbaz等[14]病例报告结果显示,患者表现为阴道出血和会阴区疼痛,MRI显示宫颈-阴道区域有不均匀肿块。周宙等[15]回顾性分析11例病理证实的卵黄囊瘤影像学表现,发现有2例呈“蜂窝状”改变,反映了该肿瘤病灶容易液化坏死的特点。此外,卵黄囊瘤多发生于生命的第二个十年,而此期间卵巢肿瘤最常见的组织学类型即为生殖细胞肿瘤,其中多为良性畸胎瘤,但也有恶性生殖细胞瘤(如卵黄囊瘤或未成熟畸胎瘤等)。卵黄囊是胚胎产生血清AFP的部位,因此卵黄囊瘤患者的血清AFP会明显升高,对于卵黄囊瘤的诊断具有较高的特异性,同时还可作为检测肿瘤手术及化疗后是否复发或转移,以此来评估其治疗效果[16],但AFP升高的患者并不都是卵黄囊瘤,如大多含卵黄囊瘤成分的未成熟畸胎瘤,其AFP水平也会明显升高,此外,胚胎性癌也能产生AFP[17]。
因此,为寻找诊断卵黄囊瘤的最佳方案、提高术前卵黄囊瘤的诊断准确性,本研究采用MSCT、MRI及血清肿瘤标志物联合应用对卵黄囊瘤进行诊断。ROC分析结果显示,MSCT、MRI、AFP、CA125联合应用对卵黄囊瘤具有较高的诊断价值,其AUC(0.95CI)为0.878(0.798~0.960),灵敏度为0.903(84/93),特异度为0.852(75/88),准确度为0.878(159/181),均明显优于单纯MSCT、MRI、血清肿瘤标志物对卵黄囊瘤的诊断价值。此外,MSCT、MRI及血清肿瘤标志物具有较好的可重复性,可应用于术前及术后患者的诊断、疗效评估及预后预测。
